2019-04-09 東北大学大学院医学系研究科, 日本医療研究開発機構
研究のポイント
- 国の指定難病であるヌーナン症候群注1の原因遺伝子であるRIT1注2の変異マウスを作製した。
- RIT1変異マウスは成長障害、浮腫、心肥大などヌーナン症候群の症状を再現し、βアドレナリン受容体作動薬注3による心臓線維化(固くなること)が進行することを発見した。
- 本研究の成果によりヌーナン症候群患者の低身長、リンパ管形成異常、心疾患の病態解明ならびに治療法開発が期待される。
研究概要
東北大学大学院医学系研究科遺伝医療学分野の井上 晋一(いのうえ しんいち)助教、高原 真吾(たかはら しんご)医師、青木 洋子(あおき ようこ)教授、同心臓血管外科学分野の齋木 佳克(さいき よしかつ)教授らの研究グループは、国の指定難病となっているヌーナン症候群の原因遺伝子RIT1の変異マウス作製に成功しました。ヌーナン症候群モデルマウスは成長障害、胎仔浮腫、心肥大などヌーナン症候群の症状を再現し、βアドレナリン受容体作動薬による心臓線維化亢進を示すことを発見しました。
ヌーナン症候群は、低身長、先天性心疾患、骨格異常、リンパ管形成異常を伴う先天性疾患で、2013年に同グループが、新しい原因遺伝子RIT1を世界に先駆けて報告しました。RIT1変異を持つヌーナン症候群患者では高頻度に心肥大やリンパ管形成異常を合併しますが、詳細なメカニズムはわかっていませんでした。
今回作製されたヌーナン症候群のモデルマウスは、ヌーナン症候群の心疾患、低身長、リンパ管形成異常の病態解明ならびに治療法開発へ利用されることが期待されます。
本研究成果は日本時間2019年3月18日付けLancet誌が運営する学術誌「EBioMedicine」電子版で掲載されました。本研究は国立研究開発法人日本医療研究開発機構(AMED)などの支援を受けて行われました。
研究内容
ヌーナン症候群は、先天性心疾患、低身長、骨格異常、血液凝固異常、リンパ管形成異常、停留精巣などを特徴とする遺伝性疾患です。日本での報告では10,000人に1人とされています。現時点では根本的な治療法がないことから国の指定難病に指定されています。
当研究グループはヌーナン症候群と臨床症状が似ているコステロ症候群注1、cardio-facio-cutaneous(CFC)症候群注1の原因遺伝子として2005年にHRASを、2006年にはKRASとBRAFを世界に先駆けて同定しました(Aoki et al. Nat Genet 2005, Niihori et al. Nat Genet 2006)。さらに2013年にはヌーナン症候群の原因遺伝子の1つとしてRIT1を世界で初めて同定しました(Aoki et al. AJHG 2013)。これらの症候群の原因遺伝子は、がんに関係する遺伝子(がん原遺伝子)を含み、細胞の増殖、分化の制御に関わるRAS/MAPKシグナル伝達経路に関係していることから、国際的に「RASopathies(ラソパシー)注4」と呼ばれるようになりました(図1)。東北大学ではこれまでRASopathies患者の遺伝子診断を行うとともに、新規遺伝子を明らかにしてきました。しかし、がん原遺伝子の変化によってどのような仕組みで症状が現れるのか、またどのような治療が有効であるのかよくわかっていませんでした。
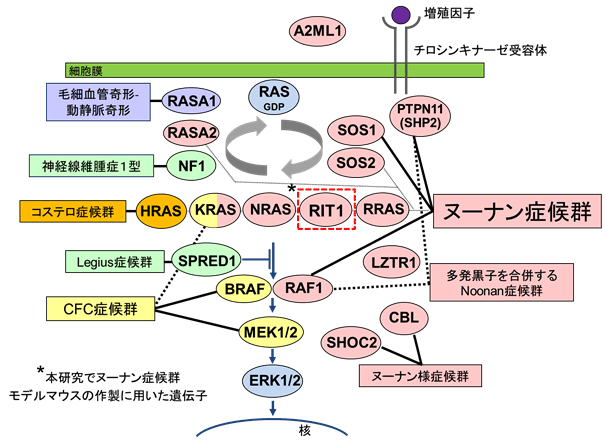
図1.RASopathiesとその原因遺伝子
(Aoki et al. Journal of Human Genetics 2016より一部改編)
本研究で、高原医師、井上助教らはRIT1遺伝子にA57G変異(57番目のアミノ酸がアラニンからグリシンに変化)をもつ遺伝子改変マウス(RIT1変異マウス)を世界で初めて作製しました。RIT1変異マウスは成長障害(体重増加不良、低体長)、骨格異常、脾腫、胎児期の浮腫、線維化を伴う心肥大など、ヌーナン症候群に類似した症状を示しました。さらにRIT1変異マウスの心臓を詳細に解析したところ、線維芽細胞のマーカータンパク質であるS100A4や、筋線維芽細胞注5のマーカータンパク質であるペリオスチン、ビメンチンの発現上昇が見られ、線維芽細胞および筋線維芽細胞の増殖が亢進していることを見出しました。そこで、心臓の線維化を誘導するβアドレナリン受容体作動薬(イソプロテレノール)を投与したところ、RIT1変異マウスではペリオスチン、ビメンチン発現亢進を伴う著明な心臓の線維化を示すことが明らかになりました。またその時の心臓組織においてシグナル伝達タンパク質であるAKTの活性化を認めました(図2)。今後、RIT1変異マウスを利用したヌーナン症候群の病態解明、治療法開発が進められていくことが期待されます。
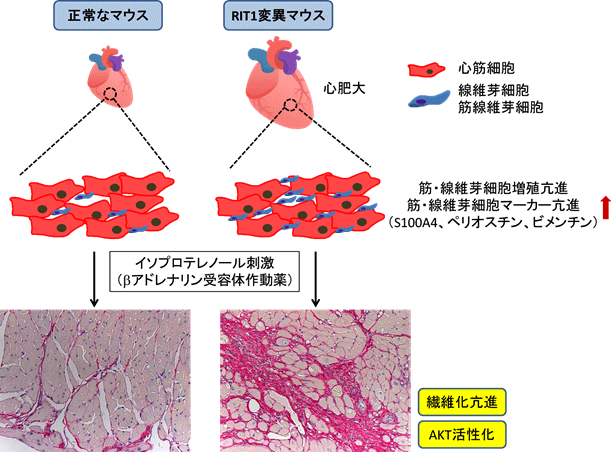
図2.RIT1変異マウスで見られた心臓の特徴
RIT1変異マウスの心臓では、心肥大(心筋細胞肥大を伴わない)、線維芽細胞・筋線維芽細胞の増殖亢進、S100A4、ペリオスチン、ビメンチンタンパク質の発現亢進が見られた。イソプロテレノール刺激によって、AKTシグナル伝達経路が活性化され、著明な心臓の線維化が見られた。
本研究はAMEDの難治性疾患実用化研究事業「細胞内シグナル伝達異常による先天性疾患の新しい治療パスウェイ検索と治療法開発」、JSPS科研費(17H04223, 15K19598, 18K07811)、公益財団法人武田科学振興財団、公益財団法人宮田心臓病研究振興基金の支援によって行われました。本研究は国立成育医療研究センター研究所 松原 洋一(まつばら よういち)研究所長、ヤマザキ動物看護大学動物看護の宮川(みやがわ)‐富田 幸子(とみた さちこ)教授、東京女子医科大学先端生命医科学研究所の松浦 勝久(まつうら かつひさ)准教授、聖隷浜松病院小児科の中嶌 八隅(なかしま やすみ)医師らとの共同研究です。
用語説明
- 注1.ヌーナン症候群・コステロ症候群・CFC症候群:
- 低身長・心奇形・肥大型心筋症・骨格異常・易発がん性を含む先天性疾患。お互いに症状が似ているため臨床症状だけでは鑑別が難しい場合がある。これらの疾患は国の指定難病とされている。
- 注2.RIT1:
- HRAS, KRAS, NRASと同じRASがん遺伝子のサブファミリーである。ヌーナン症候群の原因として同定されるまではその機能はほとんど不明であった。
- 注3.βアドレナリン受容体作動薬:
- 心臓の拍動数と収縮力を増大させ、末梢血管を拡張させる薬。本研究で使用したイソプロテレノールは、徐脈、房室ブロック、気管支喘息等の治療に用いられる。
- 注4.RASopathies(ラソパシー):
- RAS/MAPKシグナル伝達経路に存在するタンパク質をコードする遺伝子の異常によって生じる一連の症候群。ヌーナン症候群、コステロ症候群、CFC症候群、神経線維腫症1型などが含まれる。この疾患概念は2008年に青木らがRAS/MAPK症候群として提唱したものである(Aoki et al. Hum Mutat 2008)。現在、国際的にはRASopathiesとして統一して呼ばれている。
- 注5.筋線維芽細胞:
- 損傷組織の修復・再生、恒常性維持のために働く細胞。例えば心筋梗塞後の壊死部は筋線維芽細胞の増殖・遊走、炎症細胞のリクルート、マトリックスの分解、コラーゲン産生が行われ繊維化され修復される。主に線維芽細胞が分化して筋線維芽細胞になるとされる。
論文題目
- Title:
- New Noonan syndrome model mice with RIT1 mutation exhibit cardiac hypertrophy and susceptibility to β-adrenergic stimulation-induced cardiac fibrosis.
- Authors:
- Shingo Takahara, Shin-ichi Inoue, Sachiko Miyagawa-Tomita, Katsuhisa Matsuura, Yasumi Nakashima, Tetsuya Niihori, Yoichi Matsubara, Yoshikatsu Saiki, Yoko Aoki
- Journal:
- EBioMedicine
- タイトル:
- RIT1変異をもつヌーナン症候群マウスは心肥大を示し、βアドレナリン受容体作動薬によって心臓の線維化が強く誘導される
- 著者:
- 高原真吾、井上晋一、宮川-富田幸子、松浦勝久、中嶌八隅、新堀哲也、松原洋一、齋木佳克、青木洋子
- 雑誌名:
- EBioMedicine 2019 Mar 18. pii: S2352-3964(19)30154-9.
- doi:
- 10.1016/j.ebiom.2019.03.014.
お問い合わせ先
研究に関すること
東北大学大学院医学系研究科遺伝医療学分野
教授 青木 洋子(あおき ようこ)
助教 井上 晋一(いのうえ しんいち)
取材に関すること
東北大学大学院医学系研究科・医学部広報室
AMED事業に関するお問い合わせ先
日本医療研究開発機構 戦略推進部 難病研究課