2019-05-13 京都大学
實吉岳郎 医学研究科准教授、林康紀 同教授らの研究グループは、あらたな分子記憶の原理を発見しました。
私たちは、一瞬にしか過ぎない出来事を、長期間に亘って記憶することが出来ます。そのため、脳には一瞬の情報を長期的な情報として蓄えるメカニズムがあると考えられてきました。しかし、その分子の実態は、よく分かっていませんでした。
本研究グループは、ある2つの分子が結合した時にだけ、2つの分子活性が長期に保たれることを発見しました。普通は一方の分子がもう1つの分子を一方向性に活性化します。ところが、本研究グループが見つけた分子複合体では、逆方向の活性化も引き起こしました。つまり一度分子が結合すると、2つの分子がお互いを活性化し合うことで、その活性を長期に亘り継続することが分かりました。
このメカニズムによって、2つの神経細胞同士のシナプス伝達が強くなり、それが長く継続しました。これは長期増強現象(LTP)と呼ばれ、学習・記憶の細胞でのモデルとして広く受け入れられていますが、一過的な刺激を長期にわたるシナプス機能の増強へと変換する仕組みは分かっていませんでした。本研究グループの発見した原理は、シナプス機能の増強を維持する記憶のメカニズムであると考えられます。
本研究成果は、2019年5月9日に、国際学術誌「Neuron」のオンライン版に掲載されました。
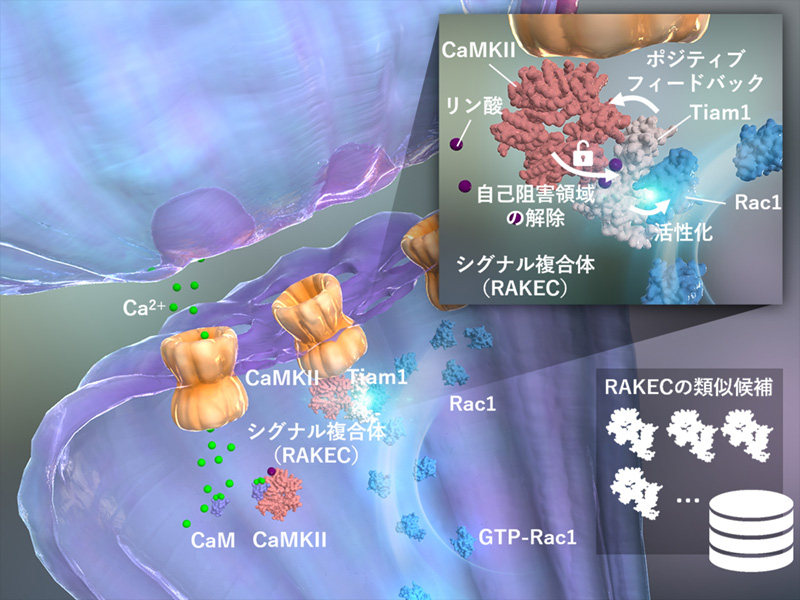
図:本研究のイメージ図
書誌情報
【DOI】 https://doi.org/10.1016/j.neuron.2019.04.012
Takeo Saneyoshi, Hitomi Matsuno, Akio Suzuki, Hideji Murakoshi, Nathan G. Hedrick, Emily Agnello, Rory O’Connell, Margaret M. Stratton, Ryohei Yasuda, Yasunori Hayashi (2019). Reciprocal Activation within a Kinase-Effector Complex Underlying Persistence of Structural LTP. Neuron.
詳しい研究内容について
記憶の持続メカニズムを解明
―あらたな分子記憶の原理を提唱―
概要
京都大学大学院医学研究科 實吉岳郎 准教授 研究当時は理化学研究所)、林康紀 同教授らの研究グループ は、あらたな分子記憶の原理を発見しました。
私たちは、一瞬にしか過ぎない出来事を、長期間に亘って記憶することが出来ます。そのため、脳には一瞬 の情報を長期的な情報として蓄えるメカニズムがあると考えられてきました。しかし、その分子の実態は、よ く分かっていませんでした。實吉准教授らは、ある2つの分子が結合した時にだけ、2つの分子活性が長期に 保たれることに気づきました。普通は一方の分子がもう1つの分子を一方向性に活性化します。ところが面白いことに、實吉准教授らが見つけた分子複合体では、逆方向の活性化も引き起こしました。つまり一度分子が 結合すると、2つの分子がお互いを活性化し合うことで、その活性を長期に亘り継続することが判りました。 このメカニズムによって、2つの神経細胞同士のシナプス伝達が強くなり、それが長く継続しました。これは 長期増強現象 LTP)と呼ばれ、学習 記憶の細胞でのモデルとして広く受け入れられていますが、一過的な 刺激を長期にわたるシナプス機能の増強へと変換する仕組みは分かっていませんでした。實吉准教授らの発見 した原理は、シナプス機能の増強を維持する記憶のメカニズムであると考えられます。
本研究成果は、2019 年5月 9 日に米国の国際学術誌「Neuron」にオンライン掲載されました。
1.背景
私たちは過去の出来事や体験を、あるものは詳細に、あるものはぼんやりと覚えています。脳には過去の記憶を何らかの形で貯蔵する仕組みが備わっています。この仕組みのひとつは、記憶される出来事に反応して神 経細胞間の連絡が変化し、神経細胞同士の繋がり方、すなわち神経回路網に記憶が貯蔵されるものです。この 神経細胞回路の接続部であるシナプスは、刺激の大きさや頻度によって性質や形が変化し、それを持続するこ とが知られています シナプス可塑性)。個々のシナプスの性質の変化は、神経回路網に保存される記憶の素 子であり、その集積によって情報として蓄えられていると考えられています。
シナプス可塑性の中でも長期増強現象 LTP)は、グルタミン酸受容体からシナプスへ Ca2+が流入し、カル シウム カルモデュリン依存性タンパク質リン酸化酵素2 CaMKII)の活性化をへて最終的に長期にわたる シナプス伝達強度を増強します Saneyoshi and Hayashi、2012)。LTP でみられるシナプス強度の持続は、 細胞レベルでの記憶の基礎であると考えられています。LTP 刺激を受けると、シナプスではカルシウムイオン 濃度がミリ秒単位で上昇し、続く CaMKII は1分間程度活性化します Takao ら、2005 Lee ら、2009)。こ れに対してシナプスの形を支えるスパイン 樹状突起上に形成される小突起)内のアクチン細胞骨格の活性化 は 30 分間以上持続します Okamoto ら、2007)。しかし、非常に短いカルシウムイオン濃度の上昇をどのよ うに長期間持続するシナプス伝達強度へと変換するのかは、全く解っていませんでした。
本研究では、CaMKII とアクチン細胞骨格に着目して、長らく未解明だった、シナプス可塑性における一過 的なカルシウムシグナルを持続する生化学反応へ変換するメカニズムの解明を試みました。
2.研究手法・成果
本研究は、ラット海馬興奮性神経細胞をモデルに LTP 刺激により起こる生化学的な変化をライブイメージ ング、生化学、分子生物学的手法を組み合わせて行いました。
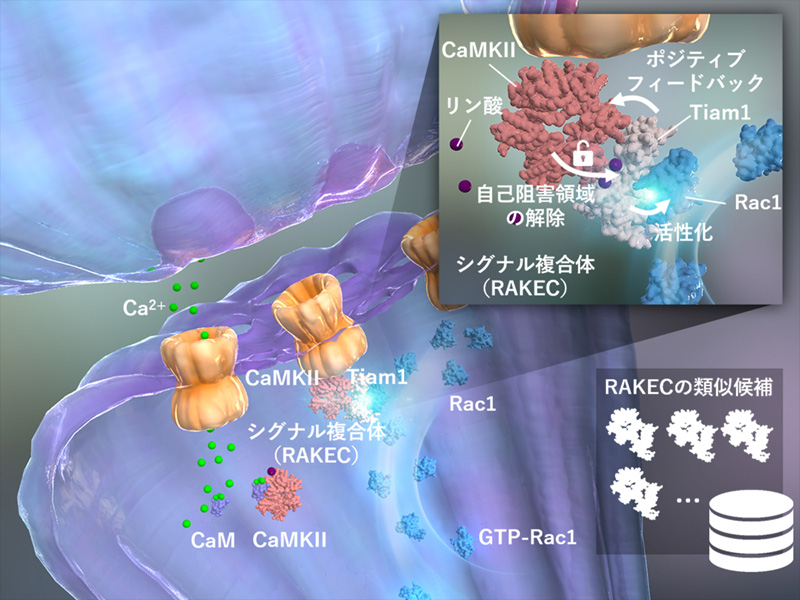
これまでの研究からアクチン重合へ至るコフィリン アクチン線維の脱重合を促進するタンパク質)を介し た情報伝達経路、特に Rho 経路 Rho は細胞骨格を制御する低分子量 G タンパク質ファミリーのひとつ)が 重要であることが分かっていました Bosch ら、2014)。そこで、LTP 発現時に Rho 経路の一つである Rac1 の活性化様式を詳細に調べると、刺激をうけたスパインでは Rac1 の活性化は、LTP 刺激がなくても続いてい ることがわかりました。また、Rac1 を活性化するタンパク質の中で CaMKII と結合するものを調べたところ、 Tiam1 が安定して結合することがわかりました。さらに、結合様式を生化学的に検討したところ、Tiam1 と CaMKII の結合には、1)カルシウム カルモデュリンが必要なこと、2)一度結合が成立するとカルシウム カルモデュリンは必要なくなること、3)CaMKII の酵素活性は必要ないこと、4)CaMKII は Tiam1 の 1543- 1557 に結合すること、5)Tiam1 は、CaMKII の T-site に結合すること、がわかりました。さらにこの複合 体では、Tiam1 は CaMKII によってリン酸化され、活性化すること、CaMKII は Tiam1 との結合によって自己 リン酸化とは独立したカルシウム非依存的酵素活性を獲得することがわかりました。つまり、Tiam1 と CaMKII はお互いを活性化し合う酵素と基質のシグナル複合体であることが明らかになりました。我々は、このような 複合体を RAKEC (reciprocally activating kinase-effector complex)と名付けました。
LTP 誘導に際して、スパイン内での RAKEC の挙動を FRET ライブイメージングの手法で検討すると、神経 伝達物質であるグルタミン酸刺激により急速に Tiam1/CaMKII 複合体が形成され、30 分間以上持続していま した。また、分子置換法による検討で、Tiam1/CaMKII 複合体は Rac1 活性化およびシナプス構造可塑性に必 須である事がわりました。
以上のことから、シナプス可塑性においてシナプス単位の記憶が、Tiam1 と CaMKII からなる RAKEC とし て形成、維持されるメカニズムを明らかにしました。本研究成果は、これまで特定の分子のリン酸化や発現量 などでは説明つかなかった分子記憶が、タンパク質間相互作用として存在するという新しいコンセプトを提案 するものです。
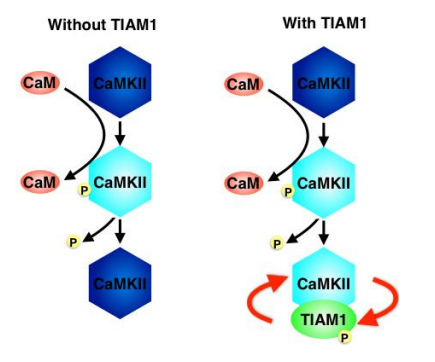
図1 RAKEC のモデル
カルシウム カルモデュリン CaM)が CaMKII に結合すると酵素活性が上昇し、T286 の自己リン酸化が起こ ります。これが自己抑制状態を解除し、活性化を促進します。しかし、細胞内では活性化状態は1分以内に消 失します 左)。一方、活性化した CaMKII と Tiam1 との結合により、CaMKII の自己阻害は解除され酵素とし て活性化状態が維持されます。この酵素活性は Tiam1 のリン酸化による活性も維持します。つまり、CaMKII と Tiam1 は、相互活性化型酵素基質複合体 RAKEC)を形成するのです 右)。
3.波及効果、今後の予定
本研究により分子記憶の一つがタンパク質間相互作用として存在する事を示しました。CaMKII は、Rac1 活 性化だけではなく、様々な情報伝達経路に関わっていることが知られているので、今回の Tiam1 との RAKEC のみならず多くの分子との相互作用が予想されます。CaMKII がシナプスで非常に高い濃度で存在することは、 CaMKIIが維持する情報の多くがRAKECを形成する分子間相互作用によるものである事を示唆します。今後、 発見されたタンパク質間相互作用としての分子記憶の個体レベルで記憶への関与、他の RAKEC の存在や機能 について、など研究を進めていきたいと考えています。
4.研究プロジェクトについて
本研究は、自然科学研究機構 生理学研究所 村越秀治准教授、Massachusetts 大学 Margaret Stratton 助教授、マックス プランク フロリダ神経科学研究所 安田涼平ディレクターとの共同研究として行われま した。 Fig. S5. Saneyoshi et al.
また、本研究は理化学研究所、理化学研究所理事長ファンド、米国国立衛生研究所 NIH)研究プロジェク ト助成プログラム R01-DA17310, DP1-NS096787, R01-MH080047)、文部科学省科学研究費補助金 基盤 研究(A):20240032、16H02455; 基盤研究(B):18H02528; 若手研究(A):24680036; 新学術領域研究:シナプ ス ニューロサーキットパソロジーの創成:22110006, 共鳴誘導で革新するバイオイメージング:18H04733, マルチスケール精神病態の構成的理解:18H05434; 細胞機能と分子活性の多次元蛍光生体イメージング: 25113726、23113522)、ヒューマン フロンティア サイエンス プログラム、公益財団法人 上原記念生命 科学財団、公益財団法人 内藤記念科学振興財団、公益財団法人 武田科学振興財団、公益財団法人 日本応 用酵素協会、公益財団法人 ノバルティス科学振興財団、公益財団法人 光科学技術研究振興財団、公益財団 法人 ブレインサイエンス振興財団、Guangdong Key International Visiting Program、 公益財団法人 京都 大学教育振興財団、公益財団法人 島津科学技術振興財団、公益財団法人 薬理研究会の支援を受けて行われ ました。
<論文タイトルと著者>
タイトル: Reciprocal activation within a kinase-effector complex underlying persistence of structural LTP シナプス構造可塑性の維持に関わる相互活性化型酵素基質複合体)
著 者: 1, 2Takeo Saneyoshi (實吉 岳郎), 1Hitomi Matsuno (松野 仁美), 1Akio Suzuki (鈴木昭夫), 3, 4, 5 Hideji Murakoshi (村越 秀治), 4, 5 Nathan G. Hedrick, 6 Emily Agnello, 6 Rory O’Connell, 6 Margaret M. Stratton, 4 Ryohei Yasuda (安田 涼平) and 1, 2, 7, 8 Yasunori Hayashi (林 康紀)
所属機関:
1. 脳科学総合研究センター, 理化学研究所
2. 京都大学医学研究科 システム神経薬理学
3. 自然科学研究機構 生理学研究所
4. 米国マックス プランク フロリダ神経科学研究所
5. 米国デューク大学メディカルセンター
6. 米国マサチューセッツ大学 生化学分子生物学部
7. 埼玉大学 脳末梢科学研究センター
8. 中国華南師範大学 生命科学部
掲 載 誌:Neuron DOI: 10.1016/j.neuron.2019.04.012