今後の新規治療法開発への期待
2018-02-03 名古屋大学,日本医療研究開発機構
名古屋大学大学院医学系研究科(研究科長・門松 健治)小児科学の高橋 義行(たかはし よしゆき)教授、村松 秀城(むらまつ ひでき)助教、村上 典寛(むらかみ のりひろ)大学院生、小島 勢二(こじま せいじ)名誉教授、東京大学先端科学技術研究センターゲノムサイエンス分野の油谷 浩幸(あぶらたに ひろゆき)教授、京都大学大学院医学研究科腫瘍生物学の小川 誠司(おがわ せいし)教授、国立がん研究センターの間野 博行(まの ひろゆき)研究所長らの研究グループは、若年性骨髄単球性白血病(Juvenile myelomonocytic leukemia; JMML)の小児患者で包括的遺伝子解析を行い、その成果を報告しました。
JMMLは乳幼児期におこる難治性の(予後不良な)小児がんの一種です。これまでの研究により、PTPN11などRAS経路*1に関連した5つの原因遺伝子が見つかっていましたが、一部の症例の原因遺伝子はわかっていませんでした。本研究グループは150人のJMML患者について、次世代シーケンサー*2という強力な解析法を駆使した様々な遺伝学的解析を行いました。その結果、RAS経路遺伝子に異常を認めない3人の患者さんからALK/ROS1チロシンキナーゼ関連融合遺伝子*3を発見しました(RANBP2-ALK、DCTN1-ALK、TBL1XR1-ROS1)。うち過去の2人の患者(DCTN1-ALK、TBL1XR1-ROS1陽性)は標準的な治療(化学療法や骨髄移植)に反応せず、発症後、早期に死亡しており、チロシンキナーゼ関連融合遺伝子を有するJMML患者の予後は非常に不良であると考えられました。また、研究期間中に発症した1人の患者では、診断後、早期にチロシンキナーゼ関連融合遺伝子(RANBP2-ALK)が確認されたため、ALKチロシンキナーゼ阻害薬(クリゾチニブ)を用いた標的治療を行いました。すると、投与開始後およそ1か月で腫瘍細胞がほぼ完全に消失し、病気を完治することができました。
また、JMML患者の中に、遺伝子の制御に関わるDNAのメチル化*4に異常をきたした「高メチル化群」が存在することをつきとめ、他の患者と比較して、非常に予後が不良であることを発見しました。
これらの結果をもとに、チロシンキナーゼ関連融合遺伝子に対する阻害薬を用いた分子標的治療や、DNAメチル化に基づいて疾患の悪性度を評価し適切な治療を行うことで(層別化治療*5)、今後の治療成績の向上が期待されます。
本研究成果は、米国血液学会(American Society of Hematology)発行の科学誌『Blood』に掲載されます(米国東部標準時間2018年2月2日付の電子版)。
ポイント
- 難治性の小児がんである若年性骨髄単球性白血病(JMML)の新たな原因遺伝子として、ALK/ROS1チロシンキナーゼ関連融合遺伝子を発見しました。また、この原因遺伝子を持つJMML患者に、実際にチロシンキナーゼ阻害薬を投与したところ、高い効果が確認されました。
- JMML患者のなかに、DNAのメチル化に異常をきたした“高メチル化群”が存在することをつきとめ、他の患者と比べて予後が不良であることを発見しました。
- 本研究成果に基づき、チロシンキナーゼ関連融合遺伝子に対する阻害薬を用いた治療や、DNAメチル化に基づく層別化治療を開発することにより、今後の治療成績の向上が期待されます。
背景
JMMLは乳幼児期におこるまれな小児白血病の一種です。これまでの長年の研究により、RAS経路に関連した5つの遺伝子(PTPN11、NF1、NRAS、KRAS、CBL)が原因であることが、多くの症例でわかっていましたが、一部の症例の原因遺伝子は見つかっていませんでした。
また、JMMLは通常の化学療法の効果が低く、骨髄移植などの造血幹細胞移植が唯一の根治的治療法です。しかし、造血幹細胞移植をおこなっても、いまだ約40%の患者が亡くなってしまう非常に予後不良な疾患です。一方で、化学療法や造血幹細胞移植を行わなくても、自然に症状が改善する症例も報告されており、治療の選択に苦慮することがあります。いくつかの予後予測に役立つ臨床・検査所見が報告されてきましたが、診断時に疾患の悪性度を正確に評価し適切な治療を行うにはいずれも十分ではありませんでした。
研究成果
本研究グループは、遺伝子変異が明確となっていないJMML症例の分子学的病因や、予後不良因子の相互関係など、明らかにされていない問題を解決するために、150例のJMML患者で、次世代シーケンサーという強力な解析法を駆使して、様々な網羅的な遺伝子解析(全エキソーム解析*6、RNAシーケンス解析*7、全メチル化解析*8)を行いました。その結果、原因遺伝子変異が不明であった16の症例中3例で、ALK/ROS1チロシンキナーゼが関係した異常な遺伝子の融合を発見しました(RANBP2-ALK、DCTN1-ALK、TBL1XR1-ROS1、図1)。ALK、ROS1は受容体型チロシンキナーゼと呼ばれる遺伝子の一種です。肺がんや悪性リンパ腫などの多くのがんで、これらの受容体型チロシンキナーゼが関連した融合遺伝子が原因となることが知られています。本研究で見つかったチロシンキナーゼ融合遺伝子陽性JMML患者のうち2つの症例は、標準的な治療(化学療法や骨髄移植)に反応せず、発症後、早期に死亡しており、非常に予後不良であると考えられました。本研究期間中に発症した1症例の患者では、幸運なことに、診断後、早期にチロシンキナーゼ融合遺伝子(RANBP2-ALK)を同定することができました。この患者の腫瘍細胞を用いた細胞実験の結果、すでに肺がんなどの治療に使用されているALK阻害薬であるクリゾチニブが、腫瘍細胞の増殖を著明に抑制することがわかりました。この結果に基づいて、保険適応外使用に関しての患者・保護者の同意を得た上で、RANBP2-ALK陽性JMML患者にクリゾチニブの投与を行いました。その結果、クリゾチニブ投与開始1か月後に、これまで抗がん剤治療を行っても消失しなかった白血病細胞が消失しました。その後、白血病細胞が消失した理想的な状態で骨髄移植を施行することができました(図2)。現在、移植後約2年が経過していますが、JMMLの再発なく経過しています。JMMLの再発は、移植後1年以内に多いことが知られており、クリゾチニブを用いた分子標的治療により、この患者を完治させることができたのではないかと考えています。
また、全メチル化解析の結果、遺伝子の制御に関わるDNAのメチル化が進んだ「高メチル化群」と DNAのメチル化が進んでいない「低メチル化群」に、JMML患者を分類することができることがわかりました。「高メチル化群」に分類された患者の5年全生存率*9は46.0%であり、「低メチル化群」の73.4%と比較して明らかに予後不良でした。さらには、「高メチル化群」が骨髄移植などの造血細胞移植を受けずに5年間生存できる可能性(5年無移植生存率*10)は2.2%しかなく、「高メチル化群」には造血細胞移植による治療が必須であることがわかりました。(図3)。高メチル化群はこれまでに報告されている様々な予後不良因子と比較しても、非常に強力な予後不良因子でした。
今後の展開
本研究により発見されたALK/ROS1チロシンキナーゼ関連融合遺伝子は、すでに他のがんで標的治療が行われていることから、JMMLでも同様の標的治療の実用化が即時に可能と考えられます。またDNAメチル化に基づく層別化治療の開発により、JMMLの治療成績を改善することが期待されます。
研究プロジェクトについて
本研究は国立研究開発法人日本医療研究開発機構次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)の支援により行われました。
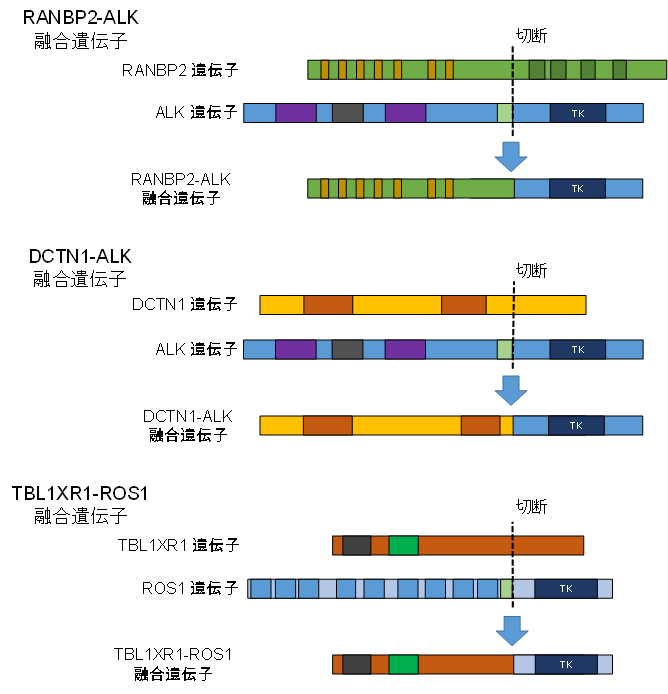
図1. ALK/ROS1関連融合遺伝子
同定されたALK/ROS1関連融合遺伝子はいずれもALK/ROS1チロシンキナーゼの後部とパートナー遺伝子の前部が融合した構造をしている ※TK:チロシンキナーゼ
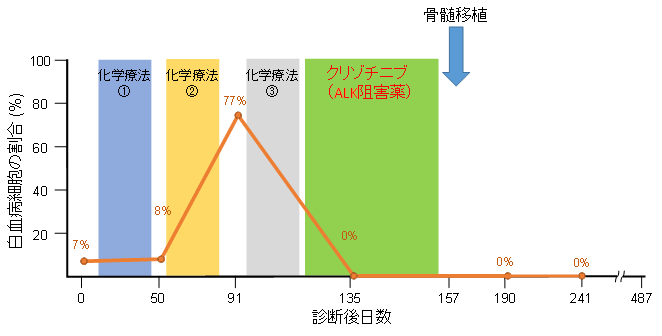
図2.RANBP2-ALK陽性JMML患者に対する標的治療
RANBP2-ALK陽性患者に対し、クリゾチニブ(ALK阻害薬)を用いた標的治療を行ったところ、これまで抗がん剤治療を行っても消失しなかった白血病細胞が消失し、理想的な状態で骨髄移植を施行することができた
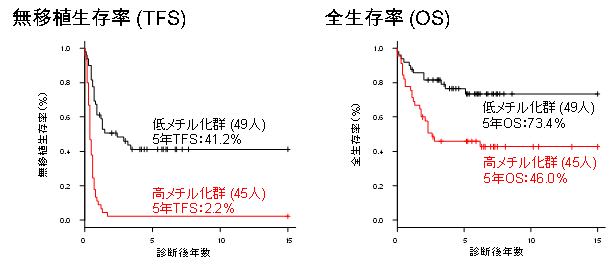
図3. メチル化状態による生存率の比較
高メチル化群は低メチル化群と比較し、統計学的に有意に無移植生存率、全生存率ともに低いことが示さした
用語説明
- *1.RAS経路:
- 細胞増殖に関連した細胞内のシグナル伝達経路の一つで、多くのがんでRAS経路に関連した遺伝子異常により、RAS経路が異常活性化されることが、がん発症の原因となることが知られている。
- *2.次世代シーケンサー:
- DNAなどの塩基配列を読み取る装置をシーケンサーという。「次世代シーケンサー」は従来の「第1世代シーケンサー」と対比させて使われる用語。次世代シーケンサーでは従来のものと比べて大量の塩基配列を低コストで迅速に解析することが可能。
- *3.ALK/ROS1チロシンキナーゼ関連融合遺伝子:
- ALK、ROS1はともに細胞増殖に関連した、細胞内のシグナル伝達に関わる受容体型チロシンキナーゼの一種。肺がんなどの多くのがんでALK、ROS1といった受容体型チロシンキナーゼが、様々な遺伝子と融合し、異常な遺伝子(融合遺伝子)を形成することが、がん発症の原因として知られている。
- *4.DNAメチル化:
- DNAの特定の部位にメチル基が結合する反応。一般的に遺伝子のプロモーター領域のCpGアイランドにおけるシトシンメチル化が起こると、その遺伝子の発現が低下することが知られている。
- *5.層別化治療:
- 予後因子に基づいて患者を分類し、それぞれのリスクに応じた適切な強度の治療を行うことを指す。
- *6.全エキソーム解析:
- 次世代シーケンサーを用いてDNA上の全遺伝子の塩基配列のうち、遺伝子をコードするエキソン領域を網羅的に解析する手法を指す。ヒトの全遺伝子の変異の大部分を同定することができる。
- *7.RNAシーケンス解析:
- 次世代シーケンサーを用いてRNAの塩基配列を網羅的に解析する手法を指す。融合遺伝子の網羅的な検出や、網羅的な遺伝子発現定量解析を行うことができる。
- *8.全メチル化解析:
- ヒトゲノム上に位置する数十万か所のDNAメチル化を一度に解析することで、ゲノム全体のDNAメチル化パターンを評価することが可能。
- *9.全生存率:
- 診断されてから一定の期間が経過した後に生存している人の割合。
- *10.無移植生存率:
- 診断されてから一定の期間が経過した後に造血幹細胞移植を受けずに生存している人の割合。
発表雑誌
“Integrated molecular profiling of juvenile myelomonocytic leukemia”
Blood(米国東部標準時間2018年2月2日付の電子版に掲載)
問い合わせ先
研究内容
名古屋大学医学系研究科小児科学
助教 村松 秀城
広報担当
名古屋大学医学部・医学系研究科総務課総務係
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部がん研究課
関連リンク