2019-06-28 京都大学
ポイント
- ヒトES/iPS細胞から3次元の大脳皮質組織を分化誘導し、3次元イメージングを行なった。
- 分化誘導した3次元大脳組織の分散培養によって、機能評価が容易にできる神経ネットワークを構築し、同期発火を含む複雑な神経活動の計測・評価を行なった。
- ヒト由来の細胞を用いた神経ネットワークの活動は、将来的に大脳の機能異常による精神疾患の病態解析や疾患モデル創出などへの応用が期待される。
1. 要旨
坂口秀哉 日本学術振興会特別研究員PD(元・京都大学CiRA臨床応用研究部門、現・米国ソーク研究所 ポストドクトラルフェロー)、髙橋淳 教授(京都大学CiRA同部門)らの研究グループは、ヒト多能性幹細胞由来の大脳オルガノイドを用いて、機能的な神経ネットワークの形成とその評価方法の確立を行いました。
近年、多能性幹細胞から3次元で分化誘導した組織はオルガノイド注1)という呼称で知られるようになり、多くの神経領域が3次元組織として分化誘導できることが報告されています。一方で、ヒト細胞由来の機能的な大脳神経ネットワークの形成については十分な報告がなく、その評価方法についても十分に確立されていませんでした。今回の研究では、ヒトES/iPS細胞から3次元大脳組織を分化誘導し、そこから神経ネットワーク形成のために組織の分散培養を行い、得られた複雑な神経活動データを包括的に解析することに成功しました。今回確立した方法によって詳細にヒト細胞由来の神経活動の評価が可能となることで、神経機能を対象とした神経科学研究や精神疾患の病態解析・疾患モデルの作製への適応が期待されます。
本研究成果は、2019年6月27日に米国科学誌「Stem Cell Reports」でオンライン公開されました。
2. 研究の背景
大脳は、運動の指令、痛みや熱などの体性感覚、視覚・聴覚などの感覚の受容に加え、意識や記憶などの高次脳機能を含む様々な神経機能の中枢を担うことで知られています。ヒト大脳の神経活動については、大脳の部位によって各種の神経活動が分担して担われていることが知られ、その各神経機能は複数の神経細胞を含む神経ネットワークの活動によって担われていると考えられています。大脳の障害がおこると、脳卒中や神経変性疾患などの器質的な障害の場合は障害の部位に応じて麻痺や知覚異常、高次脳機能障害などが起こることが知られており、一方で神経機能の調節に異常が生じると、精神疾患をきたすと考えられています。
近年、多能性幹細胞から目的の細胞に分化誘導する技術が進歩したことによって、3次元で生体と同じような構造を保った組織への分化誘導が可能となり、このような組織はオルガノイドと呼ばれるようになりました。3次元の構造を保った状態での分化誘導手法は、次世代の再生医療を拓くトピックの一つとして注目されています。神経組織においては、大脳、神経網膜、海馬、脈絡叢、小脳、視床下部、下垂体、中脳、脊髄(CiRAニュース、2018年8月7日参照)などが3次元組織として分化誘導できることが報告されていますが、これまでの研究は大脳におけるネットワークとしての神経機能を十分に評価できていませんでした。そのため、本研究グループはヒトES/iPS細胞を用いた3次元での大脳分化誘導の先に、機能的な神経ネットワークの構築とその詳細な評価方法の確立に取り組みました。
3. 研究結果
1) ヒトES/iPS細胞からの大脳皮質組織の自己組織化的な3次元分化誘導
研究グループは、マウスおよびヒトの多能性幹細胞から中枢神経系を3次元で効率よく誘導する方法として知られる無血清立体浮遊培養法(SFEBq法)注2)を用いて、発生学的な大脳の分化をin vitroで再現するところから研究を始めました。ヒトES細胞を用いて無血清立体浮遊培養法を行い、TGFβ阻害剤による神経組織誘導と、Wntシグナル阻害剤による組織の前方化によって大脳マーカーを発現する3次元神経組織を分化誘導しました(図1 A)。この条件で誘導された組織には、終脳(最終的に大脳になる部分を含む)のマーカーであるFOXG1が上皮全体に発現しており(図1 B)、培養37日目にPAX6+/SOX2+の大脳皮質に存在する前駆細胞の神経上皮が見られ、その外側には胎生期の脳と同様にTBR1+やCTIP2+の大脳皮質神経細胞を認めました(図1 C-D)。同様の結果はヒトiPS細胞を用いても再現でき、ヒト多能性幹細胞の凝集塊から複雑な大脳組織が自己組織化的に誘導されることが示されました。
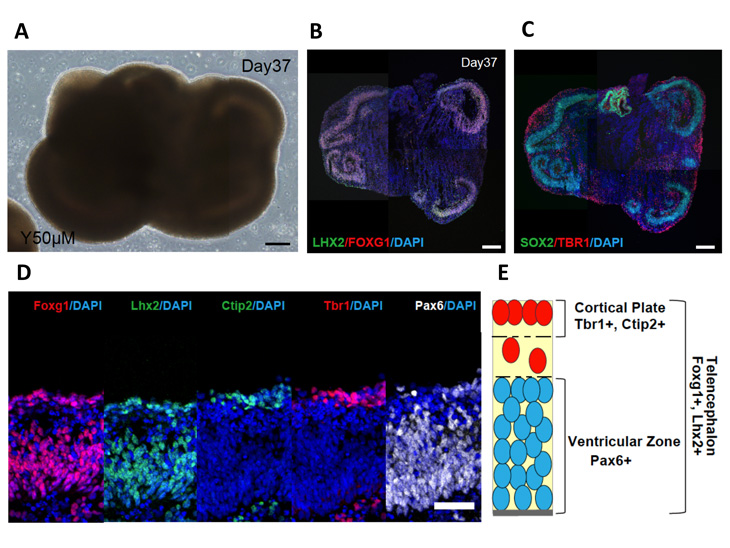
図1:培養37日目の3次元大脳組織
A:位相差顕微鏡像。B-D:免疫染色像。E:Dの模式図。
スケールバー:A-C=200μm、D=50μm。
2) ヒトiPS/ES細胞から自己組織化的に分化誘導した大脳皮質組織の長期培養、3次元イメージング、
およびカルシウムイメージングによる機能評価
誘導した神経組織をさらに長期培養すると100日以上の培養が可能で(図2 A-B)、培養時期に応じて厚みを増しており発生過程を模倣できることも確認できました。さらに、組織の透明化と3次元イメージングを行い、投射性神経細胞マーカーの一つであるCTIP2+の細胞が神経前駆細胞マーカーPAX6+の球状の上皮構造を取り巻くように位置する3次元構造の可視化に成功しました(図2 C-D)。
次に研究グループは、この3次元大脳組織の神経活動について評価しました。2光子顕微鏡を用いて組織表面から100μmほど深部における細胞内カルシウム動態の評価を行ったところ、培養76日、90日、104日のいずれのサンプルにおいても神経細胞における散発的なカルシウム発火を認めました(図2 E)。ただし、神経機能評価における成熟の一つの指標となる同期発火は少数の細胞では認めましたが、ネットワークとしての広い同期発火を認めることはありませんでした。
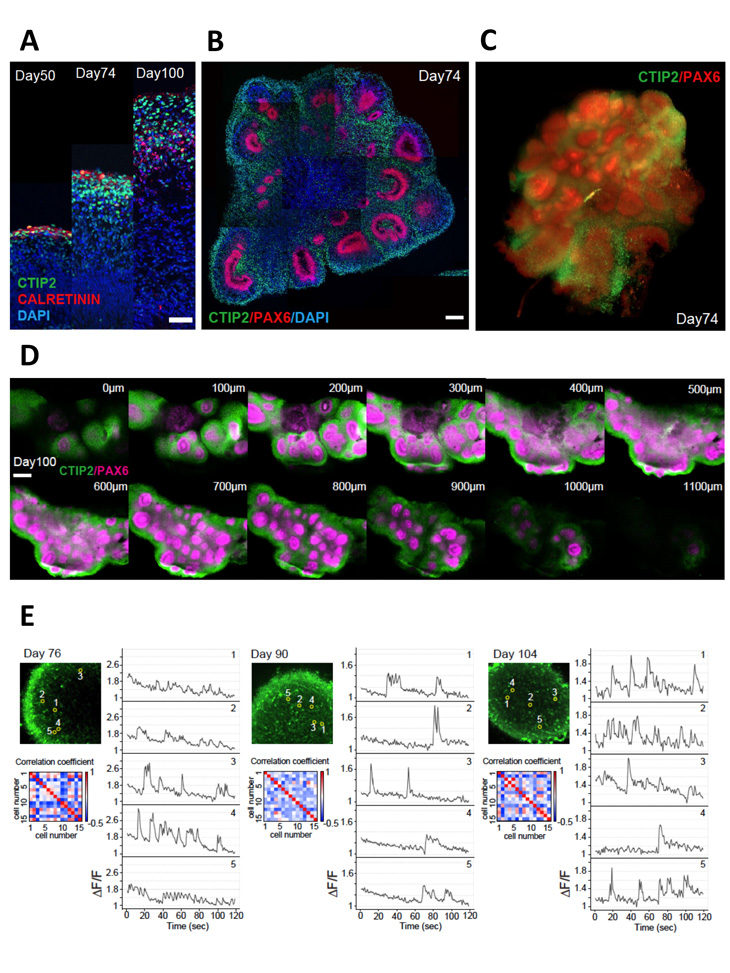
図2:長期培養した大脳オルガノイドの3次元画像および
カルシウムイメージングによる機能評価
A:培養50/74/100日における免疫染色像の比較。
B:免疫染色像。
C,D:透明化大脳皮質組織の免疫染色像と3次元スライス画像。
E:カルシウムイメージングによる神経機能評価。
緑色で示されるのがカルシウム指示薬を取り込んだ神経細胞。
右側のグラフは1〜5のそれぞれの細胞での発火を表示したもの。
左下のグラフは、15個の細胞における同時発火の程度を示したもの。
同期した組み合わせを赤く、そうではないものを青く表示している。
スケールバー:A=50μm、B,D=200μm。
3)大脳オルガノイドの分散培養による機能的神経ネットワークの創出
機能的な神経ネットワークの構築のために、研究グループは次に大脳オルガノイドの分散培養を行いました。まず培養70-100日の大脳オルガノイドを分散培養したところネットワークの形成が確認できました(図3 A)。ここで形成されたネットワーク構造は培養期間が長くなるに応じてより長く、より太いファイバーを形成しました(図3 B)。免疫染色によって、細胞凝集塊を形成するのはおもにグルタミン酸作動性の興奮性神経細胞で、GABA作動性の抑制性ニューロンがその周辺に存在していることがわかりました(図3 C-D)。また、細胞凝集塊の細胞はCTIP2やSATB2を発現することから大脳の投射性神経細胞であることが示唆されました(図3 E)。
次に、この神経ネットワークの機能を確認するために、カルシウム指示薬を用いてネットワークにおける細胞内カルシウム動態を評価しました。分散2週目までは神経活動は散発的で、主に非同期性の発火からなる神経活動を認めました(図3 F)。興味深いことに、培養4週目に評価すると同期性の神経活動が非同期性の活動と共に認められました(図3 G、赤丸)。これは時間依存性の神経活動の成熟を示唆する結果でした。この結果から、ヒト神経活動の評価基盤として、より包括的な評価ができないかを模索しました。新しい評価方法を構築した今回の論文では、1820細胞分の細胞内カルシウム動態を数値化し、細胞の分布、活動細胞と非活動細胞の可視化、発火パターンのラスタープロッティング、発火パターンのクラスタリングなどを示しています(図3 H)。この方法によって、ヒト神経細胞からなるネットワークとしての神経活動を既存の方法では評価が難しかった包括的評価として測定することが可能となりました。 研究グループは、さらに薬剤添加によってこれらの神経活動が変化することも明らかにしています。
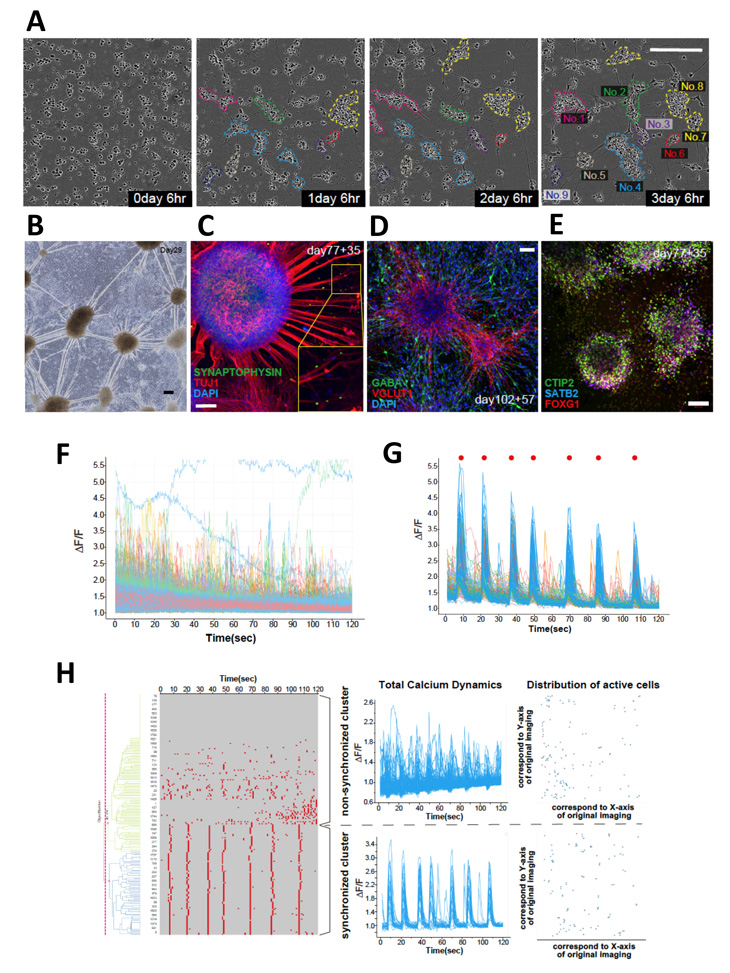
図3:大脳オルガノイドの分散培養による機能的神経ネットワークの創出
A:分散培養初期の位相差顕微鏡による時系列画像。
B:分散後29日の位相差顕微鏡画像。
C-E:分散後の神経ネットワークにおける免疫染色画像。
F,G: 分散後2週(F)と4週(G)におけるカルシウムイメージング。
H:得られたカルシウムイメージングの結果の解析例。
スケールバー:A-B=200μm、C,E=100μm 、D=50μm。
4. まとめ
本研究では、ヒト多能性幹細胞から3次元大脳組織:大脳オルガノイドの分化誘導と3次元イメージング、その分散培養によって得られた同期発火を含む神経ネットワーク活動とその特性評価、および複雑な神経活動に対する新規評価基盤について報告しました。誘導した大脳組織は発生学的な背景を反映したマーカー発現や構造を有しており、ヒト大脳皮質の発生過程を模倣していると考えられ、その応用例としての分散培養を通した神経ネットワーク構築は、将来的にヒト大脳を対象とした疾患へのアプローチをより容易にする可能性を持っていると考えられます。
筆頭著者・共同責任著者である坂口氏は、「本研究での成果は、脳の機能異常が表現系の本質にあるとされる統合失調症や気分障害、自閉症などの神経精神疾患モデルの構築に寄与すると思います」とコメントし、高橋淳教授は「特に神経活動の包括的な動的評価については、これまでに達成することの困難であった精神疾患における創薬スクリーニング基盤の構築に役立てば嬉しいです」とコメントしています。
5. 論文名と著者
- 論文名
“Self-organized synchronous calcium transients in a cultured human neural network derived from cerebral organoids” - ジャーナル名
Stem Cell Reports - 著者
Hideya Sakaguchi1,†, Yuki Ozaki1, Tomoka Ashida1, Takayoshi Matsubara2, Naotaka Oishi3, Shunsuke Kihara4, and Jun Takahashi1,†
† 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)臨床応用研究部門
- 横河電機株式会社 ライフサイエンスセンター
- 株式会社パーキンエルマージャパン
- 京都大学iPS細胞研究所(CiRA)共通機器管理室
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患・組織別実用化研究拠点A」
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 基盤研究 (B) (17H04302)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費基金 若手研究 (18K15046)
- 日本学術振興会 (JSPS)・文部科学省 科学研究費補助金 研究活動スタート支援 (16H06897)
- 日本学術振興会(JSPS)特別研究員PD (17J10294)
7. 用語説明
注1)オルガノイド
多能性幹細胞や組織幹細胞から分化誘導された3次元組織で、生体でみられるような構造や機能を保持しているもののこと。神経領域では、大脳、神経網膜、小脳、海馬、中脳、視床、脊髄などの領域が報告されており、神経以外では、腎臓、胃、肝臓、腸管などのオルガノイドが報告されている。いずれも将来的な疾患モデリングや創薬スクリーニングへの応用が期待されている。
注2)無血清立体浮遊培養法(SFEBq法)
ES細胞などの多能性幹細胞を酵素によりバラバラに分散し、それを3,000-9,000個程度の細胞の塊に再凝集させ、この細胞凝集塊を、血清や転写因子などの神経分化阻害効果のある成分を含まない培養液に浮遊させて培養することで、3次元で神経組織への分化誘導を可能とする神経分化誘導法の一つ。最初のプロトコールは2008年に理科学研究所 笹井芳樹研究室によって確立された。