2018-02-16 理化学研究所,北海道大学
要旨
理化学研究所(理研)統合生命医科学研究センターゲノムシーケンス解析研究チームの中川英刀チームリーダー、藤田征志研究員と北海道大学大学院医学研究院消化器外科学教室IIの中村透助教、平野聡教授らの国際共同研究グループ※は、日本とイタリアの胆道がんの大規模ゲノムシークエンス解析を行い、多数の胆道がんの原因遺伝子や変異を同定し、その発がん機構を解明しました。
胆道は、肝臓で産出された胆汁を十二指腸へ輸送、または蓄える(胆嚢)器官です。その上皮細胞から発生した腫瘍が胆道がんであり、発生部位によって、肝内胆管がん、上部胆管がん(肝門部胆管がん)、下部胆管がん、そして胆嚢がんに大きく分類されます。これらの部位によって、発症リスクや悪性度、予後などの生物学的特性が異なり、また外科手術などの治療法も変わります。
今回、国際共同研究グループは、日本とイタリアの胆道がん、412例の大規模なゲノム解析を行い、分子生物学的特性を調べました。その結果、TP53、KRAS、SMAD4、NF1、ARID1A、PBRM1、ATRなどの32個の遺伝子と今回新たに同定したMUC17遺伝子が、胆道がん発症にとって重要な変異遺伝子であり、それらは患者の予後や再発リスクと強く関連していることが分かりました。特に7番染色体に位置するMUC17遺伝子の欠失が64%の症例で観察され、MUC17タンパク質が欠失する胆道がんは周辺血管への浸潤傾向が強く、再発率が有意に高い傾向にありました。また、全ゲノムシークエンス解析[1]のデータとエピゲノム解析[2]のデータを用いて胆道がんの発生起源細胞をコンピューターで探索し、肝臓内に発生する肝内胆管がんの一部は、胆道上皮細胞ではなく、肝細胞由来であることを明らかにしました。そして、胆道がん患者において、BRCA1/2やMLH1、MSH2などのDNA修復遺伝子の生殖細胞の変異が観察されました。このことは、少なくとも胆道がんの11%にさまざまなタイプの遺伝性腫瘍が含まれており、胆道がんの診療やゲノム医療上、留意する必要があることを示しています。
本成果により今後、胆道がんの詳細な分子生物学的な分類が進展し、その分類に応じて治療方針を決定する個別化医療(がんゲノム医療)が進むものと期待できます。
本成果は、国際科学雑誌『Journal of Hepatology』への掲載に先立ち、オンライン版(2月16日付)に掲載されます。
※国際共同研究グループ
理化学研究所 統合生命医科学研究センター
ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
研究員 藤田 征志(ふじた まさし)
研究員(研究当時) クリストファー・ウォーデル(Christopher Wardell)
北海道大学大学院医学研究院 外科学分野 消化器外科学教室II
教授 平野 聡 (ひらの さとし)
助教 中村 透 (なかむら とおる)
大学院生 山田 徹 (やまだ とおる)
イタリア ヴェローナ大学 病理学
教授 アルド・スカーパ(Aldo Scarpa)
米国 マサチューセッツ工科大学/ハーバード大学 ブロード研究所
研究員 パズ・ポラク(Paz Polak)
主任研究員 ガド・ゲッツ(Gad Getz)
和歌山県立医科大学 第2外科
教授 山上 裕機(やまうえ ひろき)
広島大学 大学院医歯薬保健学研究院 応用生命科学部門 消化器・代謝内科学
教授 茶山 一彰(ちゃやま かずあき)
東京女子医科大学 消化器外科
教授 山本 雅一(やまもと まさかず)
東京大学 医科学研究所附属 ヒトゲノム解析センター
教授 宮野 悟 (みやの さとる)
背景
胆道は、肝臓で産出された胆汁を十二指腸へ輸送、または蓄える器官(胆嚢)です。その上皮細胞から発生した悪性腫瘍が胆道がんであり、発生部位によって、肝内胆管がん、上部胆管がん(肝門部胆管がん)、下部胆管がん、そして胆嚢がんと大きく分類されます。これら部位によって、発症リスクや悪性度、予後などの生物学的特性が異なり、また外科手術などの治療法も変わります。一般的には胆石症、胆管炎、胆嚢炎、胆道寄生虫などが胆道がんの発生リスクとされていますが、ウイルス性慢性肝炎も肝内胆管がんの発生リスクであることが最近分かってきました。
胆道がんは世界的にみると稀ですが、日本においては発生頻度が高く、2017年で年間24,500人が発症し18,900人が胆道がんにて死亡すると予測された、6番目に死亡数が多いがん腫です注1)。胆道がんは転移や浸潤能が非常に高く、周囲に重要な血管があるような複雑な部位に発生するため根治的手術も困難です。また、現在有効な化学療法や分子標的治療も開発されていないため、5年生存率はわずか27%と極めて難治性のがんです注2)。
がんはゲノム変異が蓄積することによって発生し、進化するゲノムの病気です。胆道がんにおいても、これまでKRASやTP53遺伝子の変異など、さまざまな遺伝子変異が同定されていますが、病理学的にも遺伝学的にも非常に多様性に富んでおり、ゲノムが関わる発がん機構は完全には解明されていません。がんのゲノム変異を標的とした分子標的治療の開発や治療の個別化のためのゲノム変異マーカーの開発も不十分であり、多数の胆道がんサンプルを用いたゲノム解析およびゲノム異常と臨床情報との関連を検討していく必要があります。
さらに、遺伝性乳がん・卵巣がん(HBOC)[3]といった遺伝性腫瘍の家系において、胆道がん発生のリスクが高くなると欧米では報告されており、遺伝性腫瘍に関連するがん発症遺伝子の生殖細胞変異の有無についても、胆道がん症例は詳細に検討していく必要があります。
注1)国立がん研究センター がん情報サービス「2017年のがん統計予測」
注2)国立がん研究センター がん情報サービス「胆管がん(2.治療成績)」
研究手法と成果
国際共同研究グループは、主に北海道大学病院とイタリア・ヴェローナ大学付属病院で切除手術を行った412例の胆道がんの切除標本と正常組織からDNAを抽出し、次世代シークエンサー(NGS)[4]を用いて、全ゲノムシークエンス、全エクソーム[5]、および103個の候補遺伝子の全エクソン(タンパク質をコードしている部分)について変異探索を行いました。また、DNAチップ[6]を用いたゲノムワイドでのコピー数異常[6]の探索とRNA発現解析も一部行い、胆道がんの分子生物学的特性を調べました。
解析サンプルの内訳は、肝内胆管がん136例、上部胆管がん(肝門部胆管がん)109例、下部胆管がん101例、そして胆嚢がんが66例であり、日本の胆道がんが218例、イタリアの胆道がんが194例でした。
412例のゲノム変異解析の結果、TP53、KRAS、SMAD4、NF1、ARID1A、PBRM1、ATRなど、胆道発がんにとって重要な32個のドライバー遺伝子に変異が集積していました(図1)。これらの変異遺伝子はDNA安定性、エピゲノム関連、シグナル伝達経路分子の三つの機能的カテゴリーに集約されていました。このうち、ARID1A、KRAS遺伝子の変異の有無および喫煙の有無は、患者の予後や再発リスクと有意に関連が認められました。また、がんのコピー数異常においては、7番染色体長腕(7q22,1)に位置するMUC17遺伝子の欠失が、今回新たに64%の胆道がんで観察され、MUC17遺伝子を欠失している胆道がんは周辺血管への浸潤傾向があり再発率が有意に上昇していました(図1)。この結果は免疫組織染色法[7]でのMUC17タンパク質発現解析においても確認されています。
胆道がん全ゲノムシークエンス解析によって、非コード領域も含む全ゲノムレベルでの変異の分布状況を観察でき、がんの全ゲノム変異のデータと、106種類ものさまざまな組織・細胞のエピゲノム的特徴とを比較し、がんの由来細胞を推定できます。本研究では、39例の胆道がんおよび97例の肝細胞がん(HCC)の全ゲノムシークエンスから得られた変異データを用いて、それらの発生起源の細胞をコンピューターで探索しました。その結果、89%(86/97)の肝細胞がんは肝細胞由来であると判定でき、胆道がんの33%(13/39)も肝細胞由来と判定できました。さらに、慢性肝炎のある肝臓に発生した肝内胆管がんの多くが肝細胞由来であることが証明されました(図2)。この結果は、中川英刀チームリーダーらのこれまでの研究などの結果と一致します注3)。
頻度の高い遺伝性腫瘍であるHBOCやリンチ症候群[8]においては、胆道がん発生リスクが高くなると欧米では報告されており、本研究の日本人の胆道がん147例について、遺伝性腫瘍の原因遺伝子(30遺伝子)の生殖細胞変異を探索しました。その結果、BRCA1/2、MLH1、MSH2、TP53などの病的変異が11%(16/147)の胆道がん症例にて見つかりました。このうち、がんの家族歴があるのは2例のみであり、5例の胆道がん患者においては、他のがん腫が合併発症していました(胃がん、大腸がん、十二指腸がんなど)。がんの家族歴に関係なく、少なくとも胆道がんの11%にはさまざまなタイプの遺伝性腫瘍が含まれており、胆道がんの診療やゲノム医療を実践していくにあたり、留意する必要があります。
注3)2015年1月30日プレスリリース 「慢性肝炎や肝硬変は肝内胆管がんのゲノム異常と発生に強く関与」
今後の期待
本研究では、胆道がんの大規模ゲノム解析によって、30個以上の変異ドライバー遺伝子を同定し、発生起源細胞の一部を明らかにしました。これらのゲノム情報を用いて、胆道がんの詳細な分子生物学的分類が進展し、その分類に応じて治療方針を決定する個別化医療(がんゲノム医療)が進むものと期待できます。また、今回のゲノム解析により同定した胆道がんの悪性度に関わる複数の遺伝子変異は、早期診断法や効果的な治療法がない胆道がんに対して、これらを標的とした新しい治療法や診断法の開発に貢献すると期待できます。
さらに、胆道がんにおいては、がん家族歴の有無に関係なく、11%の症例で遺伝性腫瘍と関連する生殖細胞変異があることが分かりました。これは、胆道がんの一般診療やゲノム医療を展開するにあたり、留意する必要があります。胆道がんのゲノム診断を行うにあたり、これらの遺伝性腫瘍の一部に対して有効な治療法(PARP阻害剤や免疫チェックポイント阻害剤)の適応が考えられます。一方、遺伝性乳がんや卵巣がんと同様に、遺伝性腫瘍の可能性について患者およびその家族とがんの遺伝的リスクについて議論していく必要があります。
原論文情報
Christopher P. Wardell*, Masashi Fujita*, Toru Yamada, Michele Simbolo, Matteo Fassan, Rosa Karlic, Paz Polak, Jaegil Kim, Yutaka Hatanaka, Kazuhiro Maejima, Rita T. Lawlor, Yoshitsugu Nakanishi, Tomoko Mitsuhashi, Akihiro Fujimoto, Mayuko Furuta, Andrea Ruzzenente, Simone Conci, Ayako Oosawa, Aya Sasaki-Oku, Kaoru Nakano, Hiroko Tanaka, Yujiro Yamamoto, Kubo Michiaki, Yoshiiku Kawakami, Hiroshi Aikata, Masaki Ueno, Shinya Hayami, Kunihito Gotoh, Shun-ichi Ariizumi, Masakazu Yamamoto, Hiroki Yamaue, Kazuaki Chayama, Satoru Miyano, Gad Getz, Aldo Scarpa, Satoshi Hirano, Toru Nakamura, and Hidewaki Nakagawa (*equally contributed), “Genomic Characterization of Biliary Tract Cancers Identifies Driver Genes and Predisposing Mutations”, Journal of Hepatology, doi: 10.1016/j.jhep.2018.01.009
発表者
理化学研究所
統合生命医科学研究センター ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀 (なかがわ ひでわき)
研究員 藤田 征志 (ふじた まさし)
北海道大学大学院医学研究院 外科学分野 消化器外科学教室II
教授 平野 聡 (ひらの さとし)
助教 中村 透 (なかむら とおる)
報道担当
理化学研究所 広報室 報道担当
北海道大学 総務企画部広報課 広報・渉外担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 全ゲノムシークエンス
- 次世代シークエンサーを使って、個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、スーパーコンピュータを使って情報解析を行うのが一般的である。全ゲノムシークエンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシークエンス解析を行い、その差分を調べる。
-
- エピゲノム
- DNAやヒストンへの化学修飾、そしてゲノムの立体構造によって制御される遺伝情報。エピゲノムの状態は、組織や固有の細胞ごとに大きく異なり、米国のEpigenomics Roadmap や理研のFANTOM5のように世界中で組織ごとのエピゲノム情報のデータベースが整備されており、今回の研究ではこれらのデータベース上のエピゲノム情報を用いて起源細胞を解析した。
-
- 遺伝性乳がん・卵巣がん(HBOC)
- 乳がんや卵巣がんの5~10%は、遺伝的な要因が強く関与して発症していると考えられおり、その中で最も多くの割合を占めるのが、HBOC(hereditary breast and ovarian cancer)です。HBOCは、BRCA1遺伝子またはBRCA2遺伝子の生殖細胞系列の病的な変異が原因で乳がんや卵巣がんを高いリスクで発症する遺伝性腫瘍です。さらには、前立腺がん、膵臓がん、そして胆道がんについても、HBOCが含まれることが言われています。この腫瘍の治療法として現在、PARP1阻害剤の使用が承認されており、HBOCの診断は治療法にも直結します。
-
- 次世代シークエンサー(NGS)
- ヒトゲノムの全配列約30億塩基を解読できる高速高精度の性能を持つシークエンサー。欧米の政府や企業が技術開発を行い、1,000米ドル以下のコストで解読できる。従来の方法に比べ、超大量のDNAシークエス反応を並列して行うことができ、一回の反応で数人分の全ゲノムの配列を解析可能。NGSはNext generation sequencerの略。
-
- 全エクソーム
- 全ゲノムのうち、タンパク質をコードする約1~2%の範囲のエクソンのみをNGSを用いて解析するゲノム解析手法。
-
- DNAチップ、コピー数異常
- ゲノムDNAの上にある数十万以上の遺伝子の断片の1種類ずつを、小さな点として集積したガラスをDNAチップという。ゲノムワイドでのDNAチップ解析によって、正常では2コピーある染色体や遺伝子のコピー数異常(欠失や増幅)を効率よく、高精度で判定することができる。
-
- 免疫組織染色法
- 抗体を用いて、抗原を可視化する組織染色法。
-
- リンチ症候群
- 遺伝性大腸がんのひとつであるリンチ症候群(遺伝性非ポリポーシス性大腸がん:Hereditary Non-Polyposis Colorectal Cancer:HNPCC)は大腸がんや子宮内膜、卵巣、胃、小腸、肝胆道系、腎盂・尿管がんなどの発症リスクが高まる疾患。全大腸がんの2~5%程度がリンチ症候群と考えられ、最も頻度が高い遺伝性腫瘍の一つとされている。MLH1、 MSH2、MSH6、PMS2というDNA修復酵素をコードする4つの遺伝子の生殖細胞系列の病的変異が原因であり、ゲノム修復機能が破綻しているため、約10倍以上もの体細胞変異ががんゲノムに蓄積している。その結果、免疫原性が高まっており免疫チェックポイント阻害剤により治療の効果が期待されている。
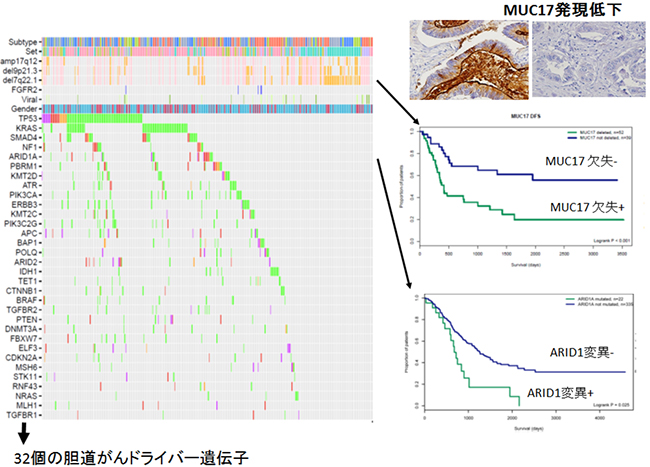
図1 412例の胆道がんのゲノム変異プロファイルと胆道がんの予後との関連
412例の胆道がんのゲノム変異解析により、32個の胆道発がんにとって重要な変異遺伝子を同定した(左)。ARID1A遺伝子の変異の有無は、患者の予後や再発リスクと有意に関連していた(右下)。7番染色体長腕(7q22,1)に位置するMUC17遺伝子の欠失は再発リスクや生存と有意に関連していた(右中)。MUC17の免疫組織染色により約60%の胆道がんがMUC17の発現が低下しており、予後が不良の傾向があった(右上)。
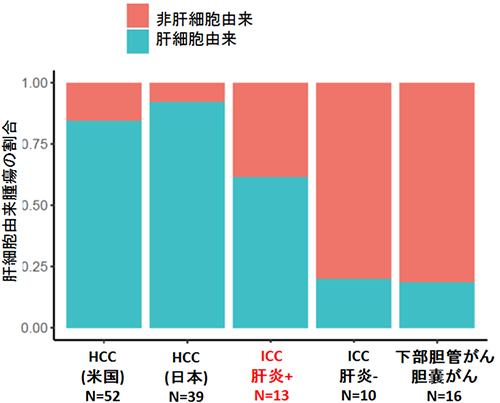
図2 肝臓がん、胆道がんでの肝細胞由来の腫瘍の割合
全ゲノムシークエンスから得られた胆道がんと肝細胞がん(HCC)の変異データを用いて、それらの発生起源の細胞をコンピューターで探索した結果、89%のHCCは肝細胞由来であった。また、慢性肝炎のある肝臓に発生した肝内胆管がん(ICC)の多くも肝細胞由来であった(赤字)。