2019-10-10 理化学研究所
理化学研究所(理研)生命機能研究センター集積バイオデバイス研究チームの田中陽チームリーダー、太田亘俊研究員、合成生物学研究チームの上田泰己チームリーダー、神田元紀研究員(研究当時)らの研究チーム※は、マイクロ流体デバイス[1]を培養液透過膜と組み合わせることで、少量の培養液を自動的に灌流させ、生物組織切片を長期間培養することに成功しました。
本研究成果は、発生生物学や生物組織工学におけるさまざまな研究に広く応用されると期待できます。
マイクロ流体デバイスを用いた生物組織切片培養は従来、培養に必要な栄養の供給と呼吸のバランスを取ることが難しく、数週間から数カ月の長期変化を観察するには、培養組織に栄養と酸素を安定供給する培養方法を開発する必要がありました。
今回、研究チームは、ポリジメチルシロキサン(PDMS)を用いて、培養液供給と除去を制御するマイクロ流体デバイスを作製しました。このデバイスでは栄養供給と呼吸のバランスを適切に保つことができ、概日時計(体内時計)[2]をつかさどる脳組織の視交叉上核(SCN)[3]を25日間にわたり長期培養することに成功しました。また、デバイスを顕微鏡下に常時設置し、培養SCNの概日リズム[2]の2時間ごとの経時観察を行い、概日時計機能が全培養期間を通して、感度よく計測されることも実証しました。
本研究は、国際科学雑誌『Analytical Sciences』(10月10日号)に掲載されます。
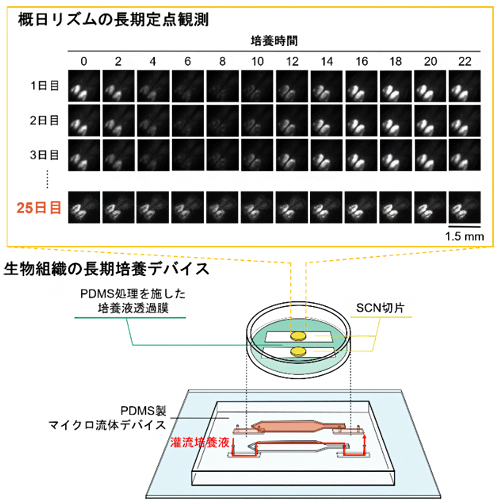
図 PDMS製流体チップ上での25日間の視交叉上核(SCN)活動測定
背景
生物組織の培養方法の一つとして、灌流培養が挙げられます。灌流培養は、培養液を連続的に更新できるため、培養条件を長期間一定に保ち、培養液交換による培養組織への悪影響を減免できるという長所があります。また、灌流培養液に含まれるシグナル分子の量を適切に制御すれば、生体内における対象組織の振る舞いを観察することも可能です。
しかし、簡便な長期灌流培養法は確立されていません。また、従来の灌流培養では、消費される培養液の量が多いため、例えば高価なシグナル分子を混ぜた培養液を、長期間にわたって組織に与える実験は現実的ではありません。さらに、培養液の入れ替わりに時間がかかるため、培養液中のシグナル分子などの成分の切り替えが組織機能に与える影響を高い時間分解能で観察することは困難です。
マイクロ流体デバイスは、組織培養に必要な培養液量を大幅に抑え、従来の灌流培養の欠点を補うことができます。しかし、従来のマイクロ流体デバイスを用いた培養方法では、生物組織片に十分な量の酸素などを長期間にわたって安定供給するために、複雑な構造や運用を用いる必要がありました。
一方で、生物組織によっては週~月単位の長期観察を必要とする現象があります。例えば、器官形成のように時間をかけて進行する現象や、生体リズムの形成など周期的に起こる現象などの機能観察には、生物機能を十分に維持したまま長期間培養する方法が必要でした。
そこで、研究チームは、ポリジメチルシロキサン(PDMS)と培養液透過膜を組み合わせたマイクロ流体デバイスを作製し、マウスから摘出した組織の長期培養を試みました。
研究手法と成果
研究チームは、生物組織の長期培養が可能なPDMS製マイクロ流体デバイスを作製するため、ガラス基板上に流路パターンを転写したPDMS流路チップを貼り合わせ、そのチップ上にSCN切片を静置するための培養液透過膜を設置しました(図1左)。PDMSは可視光を透過しやすいため、生物組織の観察に適します。培養液透過膜は、直径0.4マイクロメートル(μm、1μmは1,000分の1mm)の細孔を多数持つ親水性のポリテトラフロロエチレンでできています。この培養液透過膜に、流路パターンに沿ってPDMSを塗布・硬化しました。この加工により、透過膜が流体デバイス基板に密着し、培養液がPDMSの流路パターンに沿って流れました。さらに、デバイスを37℃に維持する定温培養器中に静置し、顕微鏡を使ってSCN切片を観察できるようにしました(図1右)。
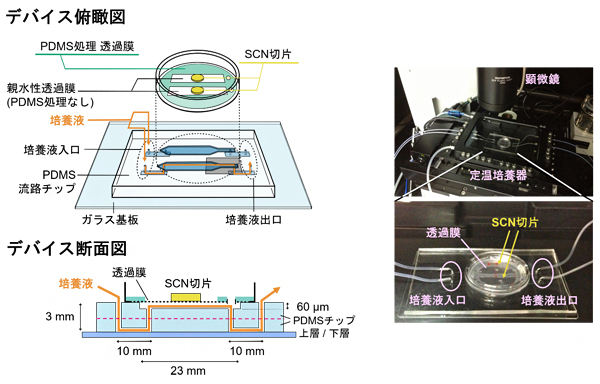
図1 視交叉上核(SCN)の長期培養を行ったPDMS製マイクロ流体デバイス
左:デバイスの俯瞰図(上)と断面図(下)。PDMS(ポリジメチルシロキサン)製マイクロ流体デバイス上にSCN切片を載せた培養液透過膜を密着させる。培養液はPDMSに浸透しないため、PDMSを塗っていない部分の透過膜にのみ広がる。断面図からわかるように、2種類のPDMS流路チップを貼り合わせ、上層と下層に高さ60μmのPDMS流路を形成している。
右:SCN長期観察時の様子。(上)顕微鏡下の定温培養器中にデバイスがセットされている。(下)SCN切片を載せたデバイスの写真。
培養液の灌流は、流路の入口と出口につなげたポンプによって制御しました。生物組織は、乾燥すると栄養の交換ができなくなりますが、一方で組織表面に過剰量の液体が存在すると呼吸が妨げられるため、機能維持が難しくなります。今回のデバイスでは水を灌流させる実験から、供給流量は毎分2マイクロリットル(μL、1μLは1000分の1mL)、除去流量は毎分2.5μLが適切であることが分かりました(図2)。供給流量に対して除去流量の方が多いときに灌流が安定するのは、透過膜越しに流入する空気が培養液流に気泡として吸引される分、培養液流量が増えるためと考えられます。また、同様の流量で培養液を灌流させると、適切な量の培養液がSCN切片に与えられることも確認されました。
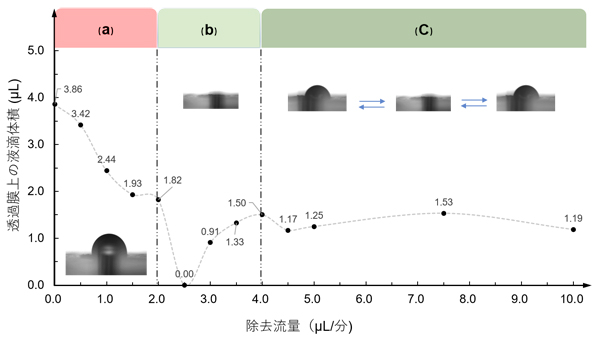
図2 長期SCN組織培養に適した培養液流量の検証
毎分2μLでデバイスに液体供給した場合、(a)毎分2μL以下の除去流量では透過膜上で液滴が大きくなり、(b)毎分2.5μLの除去流量で液滴が形成されず、(c)4μL以上の除去流量では液滴の形成と消失が定期的に起こった。この実験により、除去流量は毎分2.5μLが適切であることが分かった。
次に、開発したデバイスの有用性を特殊な遺伝子改変マウスから採取したSCN切片を用いて検証しました。この遺伝子改変マウスは概日時計遺伝子の一つであるPer2がルシフェラーゼ[4]遺伝子と融合しており、概日時計に従った化学発光の振動を観察することで組織の機能評価が可能です。この遺伝子改変マウスから0.3mm厚のSCN切片を採取し、開発したデバイスを用いた灌流培養と従来法の一つである静置培養を用いて比較しました(図3)。
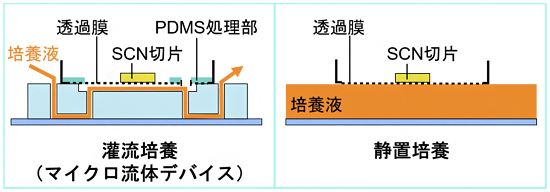
図3 マイクロ流体デバイスを用いたSCN切片の灌流培養(左)と静置培養(右)
遺伝子改変マウスから0.3mm厚のSCN切片を採取し、開発したデバイスを用いた灌流培養と静置培養を行った。
ルシフェラーゼに由来する化学発光を継時的に測定したところ、いずれの方法においても、概日時計に従い、ほぼ24時間周期で発光強度が変化しましたが、その発光強度の低下は、静置培養法で、より早いことが観察されました(図4a)。発光強度近似曲線の平均値の時間変化を追跡すると、静置培養法では培養後1週間で約35%まで低下したのに対し、PDMS製マイクロ流体デバイスによる培養では、ほとんど低下は見られませんでした(図4b)。この差を発光強度の半減期(発光強度の平均が50%まで減少する時間)として表すと、PDMS製マイクロ流体デバイス上で培養した場合は、静置培養法と比べて、平均半減期が20倍以上に延長しました(図4c)。その結果、PDMS製マイクロ流体デバイス上でSCNを培養した場合、灌流開始から25日後においても概日時計に従った発光を感度良く計測することができました(図4d)。
本デバイスによる長期培養の成功は、培養液の灌流によって、組織の生存に必要な栄養が供給されると同時に組織から排出される老廃物の除去も効率的に行われること、また、培養液の灌流のスピードを正確に制御することによって、組織を覆う液体を適切な量に保つことによって、十分な呼吸を確保できることによると考えられます。
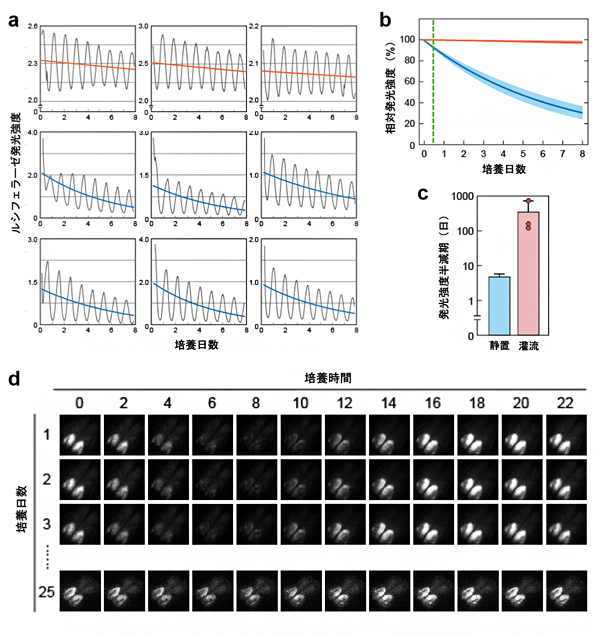
図4 長期培養SCN切片の概日リズム観察
(a)マイクロ流体デバイス上の培養(上段、n=3)と静置培養(中断と下段、n=6)でのSCN切片のルシフェラーゼ発光。黒線が実測値、赤線と青線が近似曲線。
(b)マイクロ流体デバイス上の培養(赤、n=3)と静置培養(青、n=12)の発光強度推移。濃色の線が平均発光強度を、淡色の領域が標準偏差を表す。緑線は培養開始から10時間を示す。
(c)マイクロ流体デバイス上の培養(赤、n=3)と静置培養(青、n=12)の発光強度の半減期。縦軸は対数で表記している。マイクロ流体デバイス上の培養は、静置培養法と比べて発光強度の平均半減期が20倍以上に延長した。
(d)マイクロ流体デバイス上で培養されたSCN切片が発光する様子。灌流開始から25日後においても感度良く発光を計測できた。
今後の期待
本研究では、シンプルな構造のマイクロ流体デバイスを使用し、培養液透過膜と組み合わせることで、微細流路を用いた長期組織培養を実現しました。培養液交換もポンプにより自動で行われるため、デバイスの複製や組織培養・観察が簡便となり、従来の培養方法と比べて必要な労力と培養液量が大幅に抑えられます。また、流路幅を調節することで、大きさが数mm程度の組織切片まで静置できるため、SCN以外の生物組織にも応用可能と考えられます。
ほかにも長期にわたり培養組織を動かすことなく観察できる、複数の組織を同一デバイス上で培養し並行して観察できる、高効率な培養液切り替えができるといった特徴があります。並列観察により、病変組織にさまざまな薬剤を投与して組織の反応を観察できます。また、培養液切り替えによる組織機能変化を高い時間分解能で観察できる特徴を生かし、オルガノイド[5]に成長因子を与えながら培養し、その発生過程を制御・長期観察することも可能です。このように、本技術は発生生物学や生物組織工学へ広く応用されると期待できます。
補足説明
1.マイクロ流体デバイス
半導体製造技術を用いて、微細な流路を樹脂やガラスなどの基盤に形成することで、液体もしくは液体中を流れる微粒子などの分離、濃縮、反応、解析といった操作をマイクロスケールで行うための小型集積装置。
2.概日時計(体内時計)、概日リズム
約24時間の周期を有する生物リズムを概日リズムと呼び、これは生物の体内に約24時間周期を発振する内在性の概日時計(体内時計)が存在することによる。24時間周期で自転する地球環境に適応するために生物が獲得した基本的生命現象と考えられている。地球上に棲むほぼ全ての生物が概日リズムを持つとされる。
3.視交叉上核(しこうさじょうかく)(SCN)
脳の視床下部に存在する神経核で、哺乳類の概日リズムの中枢。動物の視交叉上核を破壊すると概日リズムがなくなることが知られている。SCNは、Suprachiasmatic Nucleusの略。
4.ルシフェラーゼ
ルシフェラーゼは、ホタルなどの生物発光において、光を放つ化学反応を触媒する作用を持つ酵素の総称。生物発光イメージングは、ルシフェラーゼなどをリポーター遺伝子として用いることで、発光強度から対象とする遺伝子の発現量を定量できる。
5.オルガノイド
人工的に作られる、生体内の組織または臓器に似た細胞組織体。
研究チーム
理化学研究所 生命機能科学研究センター
集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 太田 亘俊(おおた のぶとし)
客員研究員 森口 裕之(もりぐち ひろゆき)
リサーチアソシエート ユスフ・アイサン(Yusufu Aishan)
研修生 沈 毅剛(しん きごう)
(大阪大学大学院 生命機能研究科 大学院生)
合成生物学研究チーム
チームリーダー 上田 泰己(うえだ ひろき)
上級研究員 山田 陸裕(やまだ りくひろ)
研究員(研究当時) 神田 元紀(かんだ げんき)
(現生命機能科学研究センター 網膜再生医療研究開発プロジェクト 研究員)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「哺乳類概日振動体の構成的な理解(研究代表者:上田泰己)」、文部科学省新学術領域研究(研究領域提案型)「ソフトロボット学の創成:機電・物質・生体情報の有機的融合(領域代表者:鈴森康一)」のうち「オジギソウ搭載型植物機能利用スマートマシーン創発(研究代表者:田中陽)」などによる支援を受けて行われました。
原論文情報
Nobutoshi Ota, Genki N. Kanda, Hiroyuki Moriguchi, Yusufu Aishan, Yigang Shen, Rikuhiro G. Yamada, Hiroki R. Ueda and Yo Tanaka, “A Microfluidic Platform Based on Robust Gas and Liquid Exchange for Long-Term Culturing of Explanted Tissues”, Analytical Sciences, 10.2116/analsci.19P099
発表者
理化学研究所
生命機能科学研究センター 集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 太田 亘俊(おおた のぶとし)
合成生物学研究チーム
チームリーダー 上田 泰己(うえだ ひろき)
研究員(研究当時) 神田 元紀(かんだ げんき)