2019-10-10 徳島大学,日本医療研究開発機構
ポイント
- 特発性肺線維症(IPF)[1]は、診断後3~5年で死に至る重篤な疾患であり指定難病の一つです。IPFの病態については数多くの研究がありますが、未だ詳細な発症機序は不明でした。
- IPFを模倣する動物モデルとしてはブレオマイシン誘導性モデル[2]がよく使われていますが、ヒトのIPFを正確に模倣しているわけではないことから、IPFの動物モデルの開発が求められています。
- 家族性に発症するIPFの頻度は極めて低いものの、遺伝性疾患から単一の原因変異を同定することができれば、IPFの発症あるいは進展の機序に迫ることができると考えられます。今回の研究では、家族性IPFのゲノム解析から原因となる遺伝子としてSFTPA1[3]を同定することに成功しました。SFTPA1変異によりII型肺胞上皮細胞(AEII細胞)のnecroptosis[4]が亢進することが病態の起点であることを、同変異を持ちヒト疾患を模倣することができるモデルマウスを樹立することで解明しました。
- 本研究から、IPFのこれまで知られていなかった原因遺伝子と発症機序が明らかになり、necroptosis経路を標的としたIPFの新たな治療法の開発が期待されます。
概要
徳島大学大学院医歯薬学研究部(医学系)の安友康二教授らの研究グループは、家族性IPFのゲノム解析から、その原因遺伝子としてSFTPA1を同定し、SFTPA1の変異によりAEII細胞のnecroptosisが亢進することが病態の起点になっていることを解明しました。
IPFは、診断後3~5年で約半数が死亡する非常に重篤な疾患です。これまでIPFの病態解析については数多くの研究がなされ、各種の知見が蓄積されているものの、未だその正確な病態は不明でした。また、IPFの動物モデルとしては、主にブレオマイシン誘導性のマウスモデルが用いられてきましたが、ブレオマイシン誘導性の動物モデルはヒトIPFを正確に模倣できているとはいえず、IPFの治療薬開発のためにはIPFと同様の経過をとる動物モデルの開発が求められていました。
今回、安友教授らのグループは家族性IPFの家系を対象としたゲノム解析により、SFTPA1の変異がその原因であることを見出しました。SFTPA1はサーファクタントプロテインAをつくる遺伝子の一つであり、SFTPA1の遺伝子変異により、SFTPA1の分泌が障害されていました。
SFTPA1は、AEII細胞から分泌されることが知られています。その分泌障害がどのようにIPFの発症に寄与するかを知るために、同じ変異を持つマウスを樹立したところ、マウスでもヒトと同様の肺線維症を自然発症することがわかりました。IPF患者では各種の肺感染症で急性増悪することが知られていることから、本モデルマウスでも同様の病態が観察されるかを検討したところ、インフルエンザウイルス感染で急性増悪することが確認され、このモデルマウスはヒトIPFを模倣する優れた自然発症モデルになると考えられました。このモデルマウスを利用した実験の結果、AEII細胞ではSFTPA1の分泌障害により、IRE1αの活性化とそれに引き続くJNK経路の活性が誘導されることが明らかになりました。その結果、RIPK3が発現上昇し、AEII細胞のnecroptosisの亢進が観察されました。
本研究から、IPFの新たな原因遺伝子が同定され、未解明であったIPFの発症機序としてnecroptosisの亢進が解明されたことから、necroptosis経路を標的とするIPFの治療法の開発につながることが期待されます。
本研究成果は、10月10日付けで米国科学雑誌「The Journal of Experimental Medicine」オンライン版に公開されます。
背景
IPFは、多くの場合には50歳以上で発症し、喫煙との関連性が高いことが知られています。発症率としては10万人あたり10~20人とされていますが、未発症で診断がついていない早期病変の患者さんを含めると更に頻度は高いと考えられています。IPFは診断後早期に死亡することが多いことから、その病態解明と治療薬開発が求められていますが、未だ死亡率を劇的に改善させる薬剤は開発されていないのが現状です。IPFの大半は孤発性ですが、稀に家族性IPFもあることが知られています。これまで、家族性IPFの患者さんのゲノム解析では、TERCやTERTなどのテロメラーゼ関連の遺伝子あるいはサーファクタントプロテインCの遺伝子などが報告されていましたが、家族性IPFの中でも70%以上はその原因遺伝子が不明でした。
疾患の病態解析には、その疾患の一部を模倣する各種の動物モデルが用いられます。これまで、IPFのモデルマウスとして、ブレオマイシンを全身あるいは気管内に投与するモデルが世界中で用いられてきました。しかし、ブレオマイシンを投与するモデルマウスのような薬剤誘導性のモデルは、ヒトのIPFを正確に模倣しているとはいえず、IPFの自然発症モデルが求められていました。
今回、安友教授らの研究グループは日本における家族性IPFの家系例を調査し、IPFの一家系を見出しました。その家系例のゲノム解析を実施することで、原因遺伝子としてSFTPA1を同定し、さらにSFTPA1の変異を持ちかつ病態を正確に模倣することができるモデルマウスを樹立することで、その後の発症機序の解析を行いました。
研究手法と成果
近親婚歴を有する家族性IPFの家系例のゲノムサンプルを用いて、連鎖解析[5]、ホモ接合体マッピング[6]とエクソーム解析[7]を行い、その原因となる変異としてSFTPA1のミスセンス変異を同定しました(図1)。SFTPA1のミスセンス変異[8]によってSFTPA1の分泌が障害されていることがわかりました。
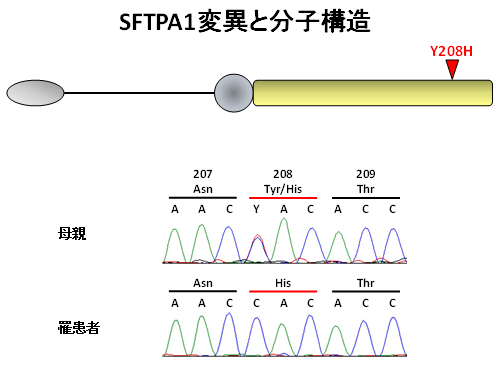
図1:SFTPA1分子の構造と遺伝子変異
上段;SFTPA1分子の全体構造と今回発見された変異部位(208番目のアミノ酸がチロシンからヒスチジンへ変わっている)。
下段;母親と罹患者の遺伝子変異を示している。
SFTPA1のミスセンス変異がどのようにIPFの発症に関与するかを知るために、マウスのSftpa1にもヒトと同じ変異を導入しました(Sftpa1-KIマウス)。Sftpa1-KIマウスでは、約40週齢頃からマウスが肺線維症で死亡し始めることが観察され、ヒト疾患を正確に模倣しているマウスであると考えられました(図2)。また、Sftpa1-KIマウスにインフルエンザウイルスを感染させると肺線維症を急性増悪することも観察され(図3a)、肺線維症の発症機序を解析するために非常に有用なマウスモデルであると考えられます。
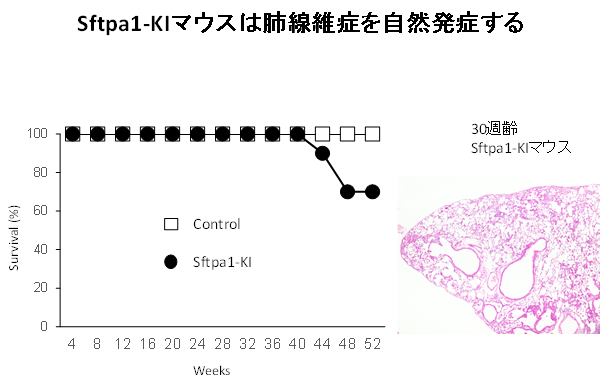
図2:Sftpa1-KIマウスは肺線維症を自然発症する
Sftpa1-KIマウスとコントロールマウスの生存率(左側)と30週齢のSftpa1-KIマウスの肺組織像(右側)を示している。30週齢のマウスの肺では既に線維化像が観察されている。
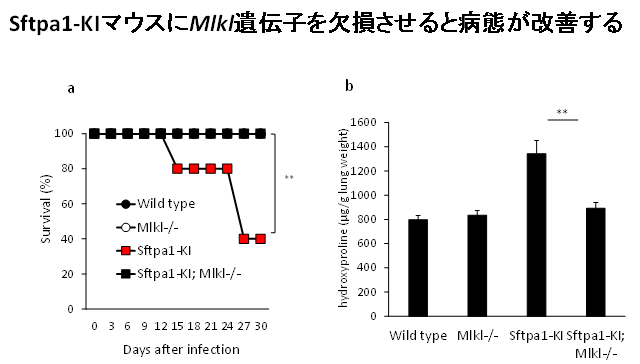
図3:Sftpa1-KIマウスにMlkl遺伝子を欠損させると病態が改善する
- インフルエンザウイルス感染後のマウス生存率:Sftpa1-KIマウスにMlkl遺伝子を欠損させるとマウスの生存率が改善する。
*○と●についての生存率はグラフ上で■と全く重なっている。 - インフルエンザウイルス感染後の肺のhydroxyproline量;Sftpa1-KIマウスにMlkl遺伝子を欠損させると、肺線維化の指標の一つであるhydroxyproline量が低下する。
Sftpa1-KIマウスの肺組織を検証した結果、AEII細胞の細胞死が亢進していることが同定されました。どのタイプの細胞死が関与しているかを検証した結果、necroptosisがその細胞死に関与していることが明らかになりました。実際に、Sftpa1-KIマウスにおいて、necroptosisの制御分子であるMlklを欠損させると肺線維症の発症が抑制されることが観察されました(図3)。
次にnecroptosisの亢進の機序について解析を行ったところ、IRE1α経路[9]とそれに引き続くJNKが活性化してその結果RIPK3の発現が亢進していることを見出しました。RIPK3がAEII細胞で過剰に発現することによってAEII細胞のnecroptosisへの感受性が亢進していることも明らかになり、それがSFTPA1変異によるIPFの起点であることが解明されました(図4)。
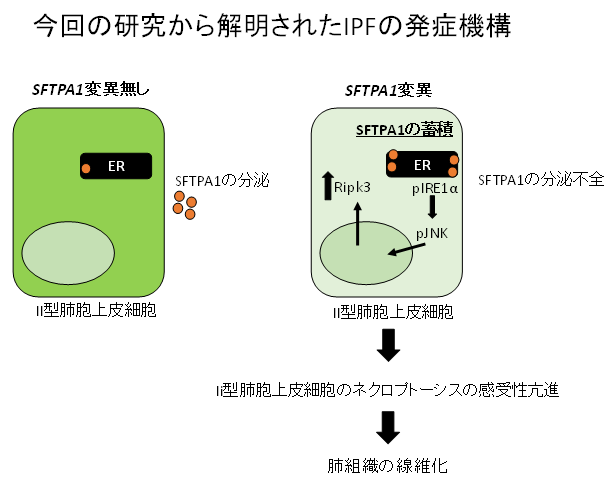
図4:今回の発見の模式図
SFTPA1の変異によってAEII細胞にSFTPA1(オレンジ色の○)が小胞体(ER)に蓄積し、その結果としてIRE1αが活性化する。IRE1αはJNKを活性化することでRIPK3の発現を増強させる。その結果、AEII細胞がnecroptosisに陥りやすくなる。Necroptosisの亢進から肺線維化に至る過程については今後の検討課題である。
研究成果の意義・今後の展望
本研究により、IPFの原因となる新たな遺伝子が明らかになり、未解明であったIPFの発症機序としてnecroptosisの亢進が明らかになりました。またその上流経路としてER(小胞体)ストレスの亢進が寄与していることも解明されました。以上の成果から、それらの分子経路がIPFの新たな治療標的になり得ることが考えられます。また、本研究からnecroptosisが病気の起点になっていることが解明されましたが、その後にどのような経路を介してIPFが進むかについては、明らかになっていません。今回の研究で開発したSftpa1-KIマウスを用いることで、necroptosis以後の経路を明らかにし、線維化を誘導する新たな治療標的を見出す研究に取り組んでいきたいと考えています。
用語解説
- [1] 特発性肺線維症(IPF)
- 原因が不明の肺の線維化を特徴とする疾患で、診断後3~5年で大半は死亡する重篤な疾患である。多くは孤発例として発症するが、稀に家族性に発症することが知られている。
- [2] ブレオマイシン誘導性肺線維症モデル
- ブレオマイシンを気管内に一回投与することで誘導する肺線維症のマウスモデル。
- [3] SFTPA1
- サーファクタントプロテインAの構成分子の一つである。サーファクタントプロテインAはリン脂質とアポタンパクから構成され、自然免疫作用や肺胞内のリン脂質を保つ作用を持つ。
- [4] necroptosis
- 上流経路により活性化されたリン酸化MLKLが細胞膜に穴を空けることで誘導される細胞死。
- [5] 連鎖解析
- 原因遺伝子が染色体のどの部分に存在するかを解析する方法。
- [6] ホモ接合体マッピング
- 劣性遺伝子がホモ接合体で存在する染色体上の領域を解析する方法。
- [7] エクソーム解析
- エクソン領域およびエクソンとイントロンの境界領域の遺伝子配列を解析する方法。
- [8] ミスセンス変異
- 遺伝子配列上の塩基が異なる塩基へと置換する変異。
- [9] IRE1α
- 細胞の小胞体膜上に存在するタンパク質であり、小胞体ストレスにより活性化するタンパク。
発表論文
- 論文名:
- “A homozygous SFTPA1 mutation drives necroptosis of type II alveolar epithelial cells in patients with idiopathic pulmonary fibrosis”
- 著者名:
- Akio Takezaki1, 2, Shin-ichi Tsukumo1, Yasuhiro Setoguchi3 , Julie G. Ledford4, Hisatsugu Goto2, Kazuyoshi Hosomichi5, Hisanori Uehara6, Yasuhiko Nishioka2, Koji Yasutomo1* (責任著者)
- 所属:
-
- 徳島大学大学院医歯薬学研究部・生体防御医学
- 徳島大学大学院医歯薬学研究部・呼吸器膠原病内科
- 東京医科大学・呼吸器内科
- アリゾナ大学・分子医学講座
- 金沢大学医薬保健研究域・革新ゲノム情報学
- 徳島大学病院・病理部
- 雑誌名:
- The Journal of Experimental Medicine
- DOI:
- 10.1084/jem.20182351
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究開発領域における研究開発課題「稀少遺伝性炎症疾患の原因遺伝子同定に基づく炎症制御法の開発」(研究開発代表者:安友康二)、新学術領域研究「ダイイングコード」などの支援を受けて行われました。なお、AMED-CRESTの研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
お問い合わせ先
研究に関すること
安友 康二(やすとも こうじ)
徳島大学 大学院医歯薬学研究部(医学系)生体防御医学分野 教授
報道に関すること
徳島大学 総務部総務課
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部研究企画課