2019-11-05 国立遺伝学研究所,理化学研究所
■ 概要
わたしたちの脳は、DNA 配列に書き込まれた設計図をもとに作られます。その設計図は、どの遺伝子が「どのような細胞で働き」、「どれくらいのタンパク質を生産するか」を正確に指示しています。もし、設計図が壊れて、胎児期の脳を形成する重要な時期に、遺伝子の「制御」にエラーが起これば、重篤な先天異常につながります。
情報・システム研究機構 国立遺伝学研究所の嵯峨井知子博士研究員、城石俊彦名誉教授(現理化学研究所(理研)バイオリソース研究センター(BRC)センター長)、理研 BRC の天野孝紀チームリーダーらの共同研究グループは、脳の形成に重要な「遺伝子の働きを制御する」仕組みを発見しました。脳の形成には、SHH(ソニックヘッジホック)遺伝子が重要であることが知られていましたが、本研究ではこの遺伝子の遺伝子発現を調節する「制御 DNA 配列(エンハンサー(1))」をマウスのゲノムから見出しました。ヒトを含む他の脊椎動物ゲノム中にもこの配列に類似の配列が存在していました。そして、この配列の機能不全は、ヒトの先天異常である全前脳胞症(holoprosencephaly)の発症原因となり得ることがわかりました。
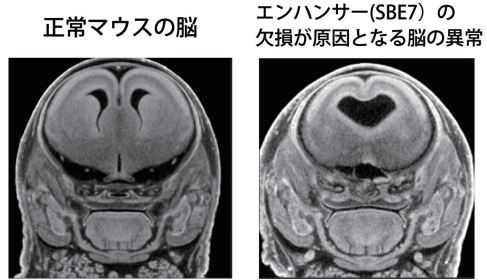
図 1:X 線 CT 解析で撮影された正常マウスの脳(左)と異常をきたした脳(右)。異常をきたした脳(右)は、エンハンサー(SBE7)の欠損によって大脳不分離となった。
■ 成果掲載誌
本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」に 2019 年 11 月 4 日午後 3 時(米国東部標準時間)に掲載されます。
論文タイトル: SHH signaling mediated by a prechordal and brain enhancer controls forebrain organization (脊索前板と脳の新規発現調節配列による SHH シグナリングの制御)
著者: Tomoko Sagai, Takanori Amano, Akiteru Maeno, Rieko Ajima, Toshihiko Shiroishi (嵯峨井知子、天野孝紀、前野哲輝、安島理恵子、城石俊彦)
■ 研究の詳細
●l 研究の背景
全前脳胞症は、胎児期の前脳(2)形成不全に起因した先天異常で、大脳不分離や眼間狭小、鼻中隔欠損、口唇・口蓋裂などの脳と顔面正中部の形成障害を特徴としています。発症の原因は多岐にわたり、遺伝性要因としていくつかの遺伝子の関与が知られています。中でも SHH は、疾患発症との強い相関が認められています。
マウスの発生学研究から、組織分化誘導因子の Shh 遺伝子が脳形成に重要な二つの部位に発現することがわかっていました。一つは中軸中胚葉の「脊索前板(3)」で、もう一つはその直上に存在して最終的に脳に分化する「神経上皮」です。脊索前板で分泌された SHH タンパク質は、直上に存在する神経上皮に働きかけ、その神経上皮からさらに SHH タンパク質が分泌されます。そして、神経上皮で分泌された SHH は、周辺の神経上皮で他の神経分化遺伝子を活性化し、前脳正中部の形態形成を促進します。
発生過程の脳で Shh の発現を調節する DNA 配列として、今まで6つのエンハンサーが同定・報告されていましたが、脳の形成初期に重要な脊索前板でどのようなエンハンサーが Shh を制御しているのか、まったくわかっていませんでした。脊索前板での Shh 発現制御機構が明らかになれば、全前脳胞症のもっとも初期の発症メカニズムが明らかになるのです。
●本研究の成果
本研究グループは、7番目となる Shh の脳エンハンサーを発見し、SBE7 と名付けました。SBE7 は、既知の前脳エンハンサーである SBE2・SBE3・SBE4 の近傍のゲノム領域に見つかり、SBE2-4 と同様にマウス胚の前脳領域正中部での発現制御活性がありました。もっとも重要な点は、SBE7 が脊索前板での Shh 発現も制御していたことです。すなわち、SBE7 は脊索前板から前脳正中部への SHH シグナルの橋渡しに寄与する脳分化の初期エンハンサーだったのです(図 2)。
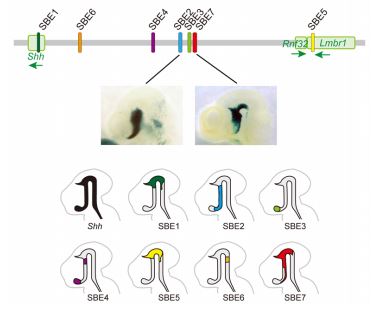
図 2:Shh の脳エンハンサー(上段)Shh の脳エンハンサーのゲノム DNA 上の位置を模式的に表したもの。Shh のタンパク質コード領域の上流に7つの脳エンハンサーが見つかっている。(中段)エンハンサーの活性化領域を検出できる組織染色法でマウス胎仔を処理したもの。SBE2 と SBE7 の活性化領域が青色で示されている。(下段)各エンハンサー活性化領域の模式図。7つのエンハンサーが入れ子状に Shh の発現領域をカバーする。
ゲノム編集によって SBE7 を Shh 遺伝子座から取り除いたところ、脊索前板ならびに前脳領域正中部で Shh が発現しなくなりました。このことは脊索前板から前脳正中部への SHH シグナルの伝達がうまく機能していないことを示します。脊索前板と前脳領域で Shh が発現しなくなった結果、SBE7 欠損マウスでは左右の目の間の距離が縮まり、鼻や口の正中構造の形成不全になりました。さらに、脳の内部構造を X 線マイクロトモグラフィー(4)(X 線μCT)によって詳細に調べたところ、大脳の左右不分離や脳正中構造の欠失というヒト全前脳胞症の症状によく似た形態異常が観察されました(図 3)。これらの組織学的な解析の結果は、SBE7 が前脳形成に必須の役割を果たすこと強く示しています。
一方で、既知の前脳エンハンサーSBE2・SBE3・SBE4 を同時に全て欠損させたゲノム編集マウスを作製したところ、脳の下垂体領域や鼻など SBE7 欠損マウスで異常が確認された組織と同じ場所に、軽度の形態的な異常が認められました(図 3)。これは、前脳と顔の形成過程に、SBE7 だけでなく他の前脳エンハンサーも協調的にはたらく可能性を示しています。
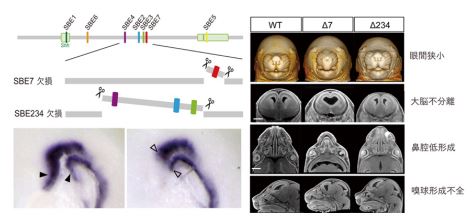
図3:(左)ゲノム編集酵素によって、マウスのゲノムから SBE7 ならびに SBE2, 3, 4 をそれぞれ欠損させた。SBE7 欠損マウスでは、正常マウスでは観察される脊索前板と前脳の先端部の Shh 発現が消失している。(右)正常マウスと2種類のエンハンサー欠損マウスの X 線 CT 解析像。SBE7 欠損マウスでは、眼間が狭くなる、大脳が左右に分離しない、鼻腔の形成が不全、嗅球が形成されない、など脳・顔面の形態異常が認められた。これらの異常は、SBE2, 3, 4 欠損マウスでも軽度に観察された。
SBE7 のエンハンサーは、マウスの脳発生初期の Shh 遺伝子の発現場所ではたらいているため、脳発生初期の発現制御には SBE7 が重要な役割を果たしていると考えられます。しかし、発生の後期では、SBE7 のエンハンサー活性と実際の Shh の発現場所がずれていました。つまり、発生後期の SBE7 はエンハンサーとしての機能を十分に発揮できていないと思われ、そのかわりに他のエンハンサーが、Shh 遺伝子の発現制御を引き継いで、前脳領域正中部の発生と分化に関係しているのではないかと予想できます(図 4)。
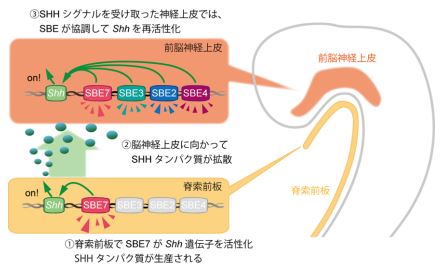
図 4:脳発生における Shh エンハンサーの分化誘導メカニズム。 ① 発生初期に SBE7 が、脊索前板で Shh 遺伝子の発現をオンにする。Shh 遺伝子が転写翻訳されて、脊索前板から SHH タンパク質が分泌される。 ② 分泌された SHH は、神経上皮まで拡散する。このシグナルが、神経上皮で再度 Shh を活性化するトリガーとなる。 ③ SHH シグナルにより、前脳神経上皮細胞で様々な転写調節因子が誘導され、SBE2・ SBE3・SBE4・SBE7 にそれぞれ特異的に結合する。この転写調節因子と SBE エンハンサーの相互作用により、前脳神経上皮でも SHH シグナルが再活性化されて、脳の形態形成が進行していく。
●今後の期待
脳形成のトリガーとなる Shh エンハンサーの発見は、脳の発生メカニズムや全前脳胞症の発症メカニズムの解明に大きく貢献することが期待されます。将来的に SBE7 に結合する転写調節因子を突き止められれば、全前脳胞症や類縁疾患に関わる未知の遺伝要因の解明が一層進むことが期待できます。
■ 用語解説
(1) エンハンサー
特定の DNA 配列を認識して結合する転写調節因子と相互作用するゲノム上の配列。様々な転写調節因子と結合することで遺伝子の発現のオンオフを組織特異的にコントロールすることができる。
(2) 前脳
脊椎動物の発生過程で生じる脳領域の最も前側の部分。最終的に、大脳・嗅球・視床下部などを構成する。
(3) 脊索前板
発生期につくられる中軸中胚葉性組織。神経上皮の分化誘導に重要なシグナル分子を産生し、中枢神経系分化の起点となる。
(4) X 線マイクロトモグラフィー
X 線を利用して対象物をスキャンし、内部構造の画像化を可能にするコンピュータ断層撮影技術。適切な造影剤を用いることで、生体試料の微細構造を三次元的に再構築することができる。
■ 研究体制と支援
本研究は、情報・システム研究機構国立遺伝学研究所 哺乳動物遺伝研究室博士研究員 嵯峨井知子、技術専門職員 前野哲輝、名誉教授 城石俊彦(現理化学研究所バイオリソース研究センター センター長)、発生工学研究室(ゲノム変異マウス開発支援部門)助教 安島理恵子、理化学研究所 バイオリソース研究センター ヒト疾患モデル研究開発チームチームリーダー 天野孝紀の共同研究グループの成果です。
本研究は、文部科学省の JSPS 科研費 JP24247002 ならびに JP15H02412 の助成を受けたものです。また、組織構造解析には、国立遺伝学研究所の X 線マイクロ CT 技術が研究成果の基盤の一つになっています。
 国立遺伝学研究所 3D Imaging Room ウェブサイト(https://www.facebook.com/3DimagingRoomNIG/)
国立遺伝学研究所 3D Imaging Room ウェブサイト(https://www.facebook.com/3DimagingRoomNIG/)
■ 問い合わせ先
<研究に関すること>
●理化学研究所 バイオリソース研究センター
センター長 城石 俊彦 (しろいし としひこ)
<報道担当>
● 国立遺伝学研究所 リサーチ・アドミニストレーター室 広報チーム