2020-01-22 京都大学
浅田秀基 医学研究科特定講師、岩田想 同教授、井上飛鳥 東北大学准教授らの研究グループは、血圧の調節に重要な生理活性ペプチドホルモンであるアンジオテンシンII(AngII)が結合した2型アンジオテンシンII受容体の立体構造を明らかにしました。
AngIIは血圧を調節する作用を持つ生理活性ペプチドホルモンであり、アンジオテンシンII受容体(ATR)と結合することで血圧を調節することが知られています。そのため、AngII、およびATRは高血圧症の治療薬の重要な標的となっています。これまで、本研究グループはAngIIの類似体が結合した2型アンジオテンシンII受容体の構造を決定しましたが、AngIIが結合した構造は未知のままでした。
今回、このAngIIが結合した構造を明らかにし、AngIIの類似体が結合した構造との比較から、細胞外の情報が細胞内へ伝わるメカニズムの一端を明らかにすることに成功しました。本研究成果は、血圧が調節されるメカニズムの一端を立体構造から明らかにするもので、高血圧症に対する理解をより深めることが期待されます。
本研究成果は、2019年12月30日に、国際学術誌「Structure」に掲載されました。

図:本研究で解明した2型アンジオテンシンII受容体(膜タンパク質)のX線結晶構造
詳しい研究内容について
分子の立体構造から血圧の調節メカニズムの一端を解明 -少しの違いで大違い-
書誌情報
【DOI】 https://doi.org/10.1016/j.str.2019.12.003
Hidetsugu Asada, Asuka Inoue, Francois Marie Ngako Kadji, Kunio Hirata, Yuki Shiimura, Dohyun Im, Tatsuro Shimamura, Norimichi Nomura, Hiroko Iwanari, Takao Hamakubo, Osamu Kusano-Arai, Hiromi Hisano, Tomoko Uemura, Chiyo Suno, Junken Aoki, So Iwata (2019). The Crystal Structure of Angiotensin II Type 2 Receptor with Endogenous Peptide Hormone. Structure.
分子の立体構造から血圧の調節メカニズムの一端を解明
―少しの違いで大違い―
概要
京都大学大学院医学研究科 浅田秀基 特定講師、岩田想 教授、東北大学大学院薬学研究科 井上飛鳥 准教授らは、血圧の調節に重要な生理活性ペプチドホルモンであるアンジオテンシン II AngII)が結合した 2 型アンジオテンシン II 受容体の立体構造を世界に先駆けて明らかにしました。AngII は血圧を調節する作用を持つ生理活性ペプチドホルモンであり、アンジオテンシン II 受容体 ATR)と結合することで血圧を調節することが知られています。そのため、AngII、および ATR は高血圧症の治療薬の重要な標的となっています。これまで、私たちは AngII の類似体が結合した 2 型アンジオテンシン II 受容体の構造を決定しましたが、AngII が結合した構造は未知のままでした。今回、この AngII が結合した構造を明らかにし、AngII の類似体が結合した構造との比較から、細胞外の情報が細胞内へ伝わるメカニズムの一端を明らかにすることに成功しました。今回の結果は、血圧が調節されるメカニズムの一端を立体構造から明らかにするもので、高血圧症に対する理解をより深めることが期待されます。
本研究成果は、2019 年 12 月 30 日に米国の国際学術誌「Structure」に掲載されました。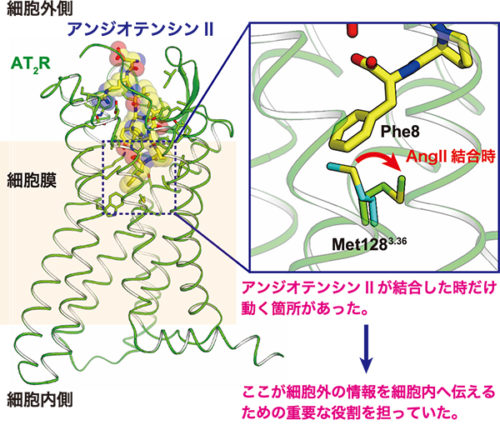
図. 私たちは、生理活性ペプチドホルモンであるアンジオテンシン II が結合した 2 型アンジオテンシン II 受容体 膜タンパク質)の X 線結晶構造を明らかにしました。膜タンパク質の構造解析は、そのタンパク質の結晶を作製し、得られた結晶に X 線を照射しデータを取得・解析することでおこないます。明らかになった立体構造からその膜タンパク質の働きや仕組みを読み解きます。
1.背景
アンジオテンシンII 受容体 ATR)は、血圧の調節において重要な役割を担う Gタンパク質共役受容体 GPCR)です。ATR には、血圧を上げる 1 型受容体 AT1R)と血圧を下げる 2 型受容体 AT2R)の二つの受容体が存在しています。血圧は、これらの二つの受容体が協力し合うことで調節されると考えられています 図1)。この協調を制御しているのが生理活性ペプチドホルモンであるアンジオテンシン II AngII)であり、AngII がどちらの受容体に結合するかによって血圧が上昇するか下降するかが決まると考えられています。そのため ATR や AngII は高血圧症の治療に対する重要な標的とされており、AngII と ATR の結合を阻害するアンジオテンシン受容体拮抗薬 ARB)や AngII の合成を阻害するアンジオテンシン II 変換酵素 ACE)阻害薬が高血圧症の治療薬として広く使用されています。生活習慣病として知られる高血圧症は、塩分の摂り過ぎ、肥満、飲酒や運動不足などによって発症しますが、脳梗塞、心筋梗塞や動脈硬化など命に直結する疾患の重大な危険因子でもあります。血圧がどのように調節されているかを知ることは、上記の疾患を予防する観点からも重要であると考えられます。私たちの研究は、高血圧が起こるメカニズムを分子の立体構造から解明するものです。
このような視点の研究として、AT1R に阻害剤が結合した構造 Zhang et al. 2015, Cell. 161(4), 833-844)、 AT1R に AngII 誘導体が結合した構造 Wingler et al., 2019, Cell. 176(3), 479-490)などが報告されています。これまでに、私たちは AT2R に AngII の類似体が結合した活性型の構造 Asada et al., 2018, Nat. Struc. Mol. Biol. 25(7), 570-576)を決定しました。今回、私たちは新たに生理活性ペプチドホルモン AngII が結合した AT2R の構造を決定することに成功しました。高血圧症は重要な疾患であることから、血圧を調節する仕組みについては様々な視点での研究が世界中で行われています。そのような中で今回、アンジオテンシン II が血圧をどのように調節しているのか、その一端を 形』から明らかにしたことは、本研究の重要な結果と考えられます。
2.研究手法・成果
本研究において私たちは、AngII が結合した AT2R の構造を、抗体フラグメントとの複合体を形成させることで結晶化に成功し、その立体構造を原子レベルで解明しました。そのために受容体の立体構造を特異的に認識する抗体を使用しましたが、これは、JST 戦略的創造研究推進事業 ERATO「 岩田ヒト膜受容体プロジェクト」 平成 17~22 年度)から開発・ 改良し続けてきた、膜タンパク質の立体構造を認識する抗体作製法を利用したものです。この抗体を用いることで AngII およびその類似体が結合した AT2R の構造決定が可能となりました。また X 線回折データは、播磨理研の大型放射光施設 SPring-8 の BL32XU で開発された自動データ測定システム ZOO system)により収集しました。この自動化されたシステムを用いることでこれまでより早く構造解析が行えるようになりました。
得られた立体構造から、AngII の8番目のアミノ酸であるフェニルアラニンが受容体の活性化に重要であることが明らかとなりました。AngII 類似体の8番目のアミノ酸はイソロイシンであり、このアミノ酸の違いが受容体と細胞内へ情報を伝える G タンパク質の結合に関与していることが示唆されました 図 2)。これは私たちの研究から初めて明らかとなった重要な結果の一つです。これまでに私たちは、現在上市されている ARB は、AngII リガンド結合部位のうち下部領域のみを使用しているためその他の領域を用いることで新たな ARB 開発が可能であることを示しました。今回の結果からは、既存の ARB が結合している領域は細胞内への情報伝達に重要な領域、つまり血圧を調節する部位に近いことが分かりました。従って、このような箇所を積極的に狙ったり外したりすることで容易に血圧を調節できる可能性が拓けました。
このような視点で薬を開発するためには受容体や生理活性物質の実際の 形』を知ることが重要です。私たちの技術基盤は膜タンパク質の立体構造を明らかにするために必要な技術開発にも貢献すると考えられ、重要な膜タンパク質の構造決定の一助になることが期待できます。
3.波及効果、今後の予定
これまでの研究から明らかになった構造と私たちの内因性ペプチドホルモンAngIIが結合した活性型の構造に関する情報を比較することで、原子レベルでの血圧調節機構の解明、および高選択性・ 低副作用の新規高付加価値薬の開発や合併症による危険性の回避 予防)にも繋がる情報が得られたと考えられます。さらに AT2R は、血圧調節だけではなく、虚血性心疾患における心血管保護、脳梗塞時における脳血管保護や帯状疱疹後疼痛に重要な役割を担っており、本研究の結果は、AT2R を標的とした疾患に対してその構造情報を基にリード化合物の探索、いわゆる、構造に基づく創薬 Structure Based Drug design; SBDD)も可能にするものと期待できます。今後は、さらに AT1R と AngII の構造から血圧調節機構の全体像を原子レベルで明らかにしていきたいと考えています。
4.研究プロジェクトについて
本研究は、国立研究開発法人日本医療研究開発機構 AMED)の創薬等ライフサイエンス研究支援基盤事業
BINDS)、日本学術振興会 JSPS)の科学研究費助成事業など多くの支援を受けて行いました。
<用語解説>
G タンパク質共役受容体(GPCR)
細胞膜に存在する受容体の一つであり、細胞膜を 7 回貫通する特徴的な構造をもつ。神経伝達物質やホルモンなどの生理活性物質を介して細胞外の情報を細胞内へ伝える。生理活性物質が結合すると構造が変化し、細胞内の G タンパク質と共役する。様々な種類の GPCR が存在しており、その多くが疾患に関与しているため創薬の標的分子となる。実際、市販薬の約3~4割が G タンパク質共役受容体のうちのいずれかを標的としている。
拮抗薬
受容体への結合能を有するが生理活性物質と異なり生体反応を起こすことはできない薬物。拮抗薬が受容体に結合すると、生理活性物質が受容体に結合することができなくなり、生体応答反応を起こすことができなくなる。医薬品として重要なものが多い。
抗体フラグメント
抗体 IgG)をタンパク分解酵素で断片化したもの。パパイン消化により 2 つの Fab と 1 つの Fc と呼ばれる断片に分かれる。Fab は抗原認識部位を含むため様々な研究に用いられる。
リード化合物
医薬品開発において出発点となる化合物。開発の最初に見出される化合物であるため、安定性、安全性などの点で医薬品として課題があることが多い。この化合物が化学的に改良され、実用的になると医薬品として上市されることとなる。
<研究者のコメント>
血圧がどのような分子メカニズムで調節されているのかを分子レベルで解明する目的で研究を行ってきました。血圧は2つの G タンパク質共役受容体という膜タンパク質によって調節されていると考えられていますが、そのうちの1つである AT2R という膜タンパク質の結晶構造を生理活性ペプチドが結合した状態で決定しました。この構造を決定するためには、結晶化を促進する抗体を作製する技術や X 線回折実験を行うための大型放射光施設の利用など、様々な技術を取り入れる必要がありました。そして何よりも、本研究に携わった方々の尽力なくしてこの結果は得られなかったと思います。
今後はこの結果をさらに掘り下げ、血圧調節の分子メカニズムの詳細を明らかにしたいと考えています。
<論文タイトルと著者>
タイトル:The crystal structure of angiotensin II type 2 receptor with endogenous peptide hormone 内因
性ペプチドホルモンが結合した 2 型アンジオテンシン II 受容体の結晶構造)
著 者:Hidetsugu Asada, Asuka Inoue, Francois Marie Ngako Kadji, Kunio Hirata, Yuki Shiimura, Dohyun Im, Tatsuro Shimamura, Norimichi Nomura, Hiroko Iwanari, Takao Hamakubo,
Osamu Kusano-Arai, Hiromi Hisano, Tomoko Uemura, Chiyo Suno, Junken Aoki and So Iwata
掲 載 誌:Structure
DOI:https://doi.org/10.1016/j.str.2019.12.003
<参考図表>
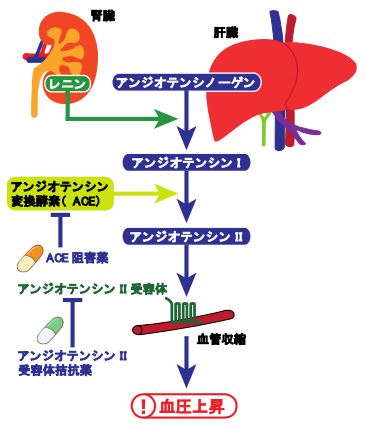
図1 アンジオテンシンによる血圧調節の仕組み
1)血圧の低下や血液量の減少などの刺激を受けると腎臓でレニンと呼ばれるタンパク質分解酵素が分泌されます。 2)同じく肝臓から分泌されたタンパク質であるアンジオテンシノーゲンの一部をレニンが分解することでアンジオテンシン I AngI)を生じさせます。 3)AngI は肺に存在するアンジオテンシン変換酵素 ACE)と呼ばれるタンパク質分解酵素により C 末端の2アミノ酸が切断されることでアンジオテンシン II AngII)が生じます。 4)AngII が ATR に結合することで血管の緊張が調節され、血圧が調節されます。血圧の調節に中心的な役割を担う生理活性ペプチドである AngII は高血圧症の標的となっており、アンジオテンシン受容体拮抗薬 ARB)として広く高血圧症の治療薬として使用されています。また、AngI から AngII への変換を抑えるアンジオテンシン変換酵素 ACE)の阻害薬も高血圧症の治療薬として用いられています。
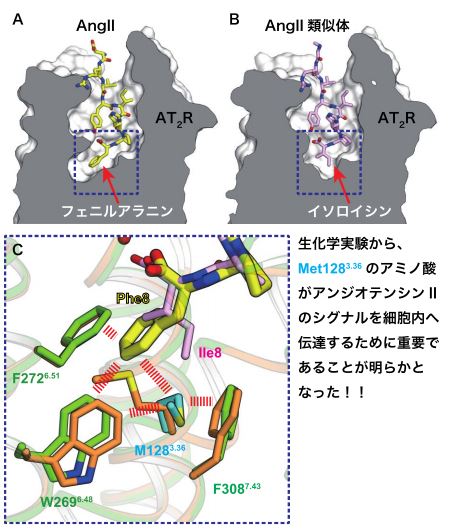
図 2 アンジオテンシン II とその類似体の受容体との結合の仕方の違い
AT2R に生理活性ペプチドである AngII A)とその類似体 B)が結合した時のリガンド結合ポケットの形を比べると、その最下部の形が顕著に異なっていました。その違いを原子レベルで詳しく観察すると、メチオニン M1283.36)の側鎖の向きが異なりました C)。この向きの違いにより AngII 類似体では見られなかった、AngII のフェニルアラニン Phe
8)と受容体の周りのアミノ酸の側鎖の相互作用 赤い破線)が形成されることが分かりました。生化学実験で確認した
ところ、メチオニン M1283.36)の側鎖の向きがシグナルを伝えるために重要であることが確認できました。