分子を自在に並べる技術により生体分子モーターの協働性を計測
2020-01-23 京都大学
横川隆司 工学研究科教授、金子泰洸ポール 同教務補佐員らの研究グループは、大岩和弘 情報通信研究機構(NICT)主管研究員、古田健也 同主任研究員と共同で、モータータンパク質(以下、モーター)であるキネシン分子を自在に配置する手法を開発しました。
モーターは微小管の上をチームとして協働して移動することで、細胞内の物質輸送や細胞分裂を行うなど、生体内で重要な役割を果たしています。これまでは、チームを構成するモーターの数と間隔を制御できる実験手法がないために、これらの要素がモーターの協働性にどのように影響するのかは分かっていませんでした。
そこで本研究グループは、ナノ加工技術で作製した金製の柱(ナノピラー)にモーター(キネシン)を1分子ずつ選択的に固定することで、キネシン分子を任意の間隔で並べることができる手法(1分子パターニング法)を開発しました。この手法により、1つの荷物(微小管)を運ぶキネシン分子の数と間隔を正確に決めることができるようになり、それらがモーター同士の協働性を決める重要な要素であることを明らかにしました。さらに、キネシン-1とキネシン-14といったモーターの種類によって協働性が異なり、キネシン-14は数と間隔によって集団での輸送速度を調節する能力をもつことが分かりました。
今回開発した1分子パターニング法は、様々な種類のモーターの協働性の研究に使用することができます。モーターの協働性の理解が進むことで、細胞内の物質輸送や細胞分裂などの様々な生命現象の仕組みについて新たな知見を得ることが期待できます。
本研究成果は、2020年1月23日に、国際学術誌「Science Advances」のオンライン版に掲載されました。

図:1分子パターニング法により並べられたキネシン分子と、その上で運ばれる微小管の模式図
詳しい研究内容について
モータータンパク質は種類により協働性が異なることを発見 -分子を自在に並べる技術により生体分子モーターの協働性を計測-
モータータンパク質は種類により協働性が異なることを発見
―分子を自在に並べる技術により生体分子モーターの協働性を計測―
概要
京都大学大学院工学研究科 マイクロエンジニアリング専攻の横川隆司 教授、金子泰洸ポール 同教務補佐員らの研究グループは、国立研究開発法人情報通信研究機構(NICT) 未来 ICT 研究所の大岩和弘 主管研究員、古田健也 同主任研究員と共同し、モータータンパク質(以下、モーター)であるキネシン分子を自在に配置する手法を開発しました。
モーターは微小管の上をチームとして協働して移動することで、細胞内の物質輸送や細胞分裂を行うなど、生体内で重要な役割を果たしています。これまでは、チームを構成するモーターの数と間隔を制御できる実験手法がないために、これらの要素がモーターの協働性にどのように影響するのかは分かっていませんでした。
そこで本研究グループは、ナノ加工技術で作製した金製の柱( ナノピラー)にモーター( キネシン)を 1 分子ずつ選択的に固定することで、キネシン分子を任意の間隔で並べることができる手法( 1 分子パターニング法)を開発しました。この手法により、1つの荷物( 微小管)を運ぶキネシン分子の数と間隔を正確に決めることができるようになり、それらがモーター同士の協働性を決める重要な要素であることを明らかにしました。
さらに、キネシン-1 とキネシン-14 といったモーターの種類によって協働性が異なり、キネシン-14 は数と間隔によって集団での輸送速度を調節する能力をもつことが分かりました。
今回開発した 1 分子パターニング法は、様々な種類のモータータンパク質の協働性の研究に使用することができます。モータータンパク質の協働性の理解が進むことで、細胞内の物質輸送や細胞分裂などの様々な生命現象の仕組みについて新たな知見を得ることが期待できます。
本研究成果は、2020 年 1 月 23 日に国際学術誌「Science Advances」にオンライン掲載されました。

1.背景
キネシンなどのモータータンパク質( 以下、モーター)は微小管の上を動くことができ、細胞内での物質輸送や細胞分裂、鞭毛の波打ち運動など様々な生命現象で重要な役割を担っています。これまでに 1 分子計測技術の発達により、モーター1 分子の運動機構については理解が進んできました。一方で、体の中では複数のモーターがチームとして働いており、協働することで 1 分子のモーターよりも大きな速度や力を発揮しています。例えば、細胞分裂や鞭毛の波打ち運動は、1012分子ものモーターが協働することによって生み出されています。しかし、このような協働現象が現れる仕組みについては、未だ十分に理解されていません。
モーターがどのように協働するかは、様々な要素によって決まることが明らかにされています。特に、チームとして働くモーターの数と分子間の距離は、協働性に影響を与える重要な要素だと考えられています。しかし、実験においてモーターの数と間隔を制御する手法がないために、これらの要素が具体的にどのようにして協働性に影響するかは分かっていませんでした。
2.研究手法・成果
そこで本研究グループは、1 つの荷物を運ぶキネシン分子の数と間隔を制御するために、分子を任意の間隔で並べることができる手法( 1 分子パターニング法)を開発しました。ナノ加工技術で直径 50 nm( ナノメートル:ナノは 10 億分の 1)、高さ 23 nm の金のナノピラーを作製して、そこにキネシンを 1 分子ずつ選択的に固定しました( 図 1)。この金ナノピラーに固定したキネシンの上に微小管をのせると、微小管はキネシンに運ばれて表面を動きだし、1 本の微小管( 荷物)を運んでいるキネシンの数は、微小管の長さを金ナノピラーの間隔で割ることで正確に見積もることができます。

図1 :1 分子パターニング法により並べられたキネシン分子と、その上で運ばれる微小管の模式図。1 本の微小管を運んでいるキネシンの数は、微小管の長さをピラーの間隔で割ることで正確に推定できる。
まず研究グループは、キネシンを固定したピラー上での微小管の運動を観察しました。その結果、微小管の運動方向は特定の向きにそろっており、またその向きはピラーが列をなしている方向と一致することが分かりました( 図 2a)。この結果は、キネシン分子がピラーの上にのみ存在していることを示しています。また、ピラーの間隔よりも短い微小管の運動を観察したところ、1 点を中心としてくるくると回転する様子が観察されました。もしピラーに 2 分子以上のキネシンが付着していたとすると、微小管はキネシンにより 2 点以上で固定されるために、このような回転運動は見られません。したがってこの結果は、1 つのピラーにキネシンが 1 分子のみ固定されていることを示しています。以上の結果より、キネシンをピラーに選択的に固定し、基板表面に任意の間隔で並べることができたことを示しました。
続いて、複数のキネシンが 1 本の微小管を運ぶ場合に、速度がキネシンの種類、数および間隔によってどのように変わるかを調べました。その結果、細胞内での物質輸送に関わっているキネシン-1 では、数と間隔のどちらにも依存しないことが分かりました(図 2b)。一方で、細胞分裂に関わっているキネシン-14 では、速度は 3–10 分子の範囲において分子数の増加とともに速度が顕著に減少することが分かりました( 図 2c)。また、速度はキネシン-14 の間隔にも依存して増加し、600 nm の間隔で最大値となりました。これらの結果は、キネシン-1 は複数分子で働いても、各モーターは互いの動きに干渉せずに独立して動くために、輸送速度は数と間隔に依らず一定となることを示しています。一方でキネシン-14 は、各モーターが結合している微小管を介して力や変位を伝達し、これに応答する形で互いの動きに影響することで、集団での輸送速度を数と間隔によって調節していることを示しています。このように、キネシンは種類によって協働性が異なることが明らかになりました。
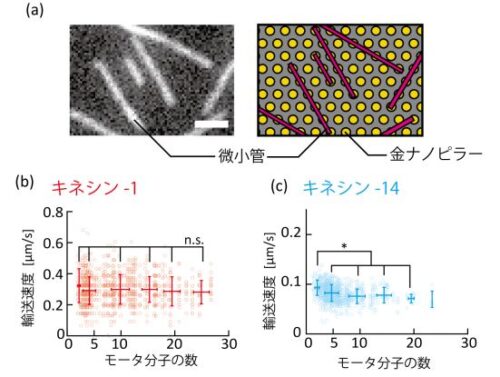
図2 :等間隔に並べたキネシン分子による、キネシンの協調性の評価( a)パターニングしたキネシン上で運動する微小管の蛍光観察像( 左)、および模式図( 右)。微小管はピラーの列に沿って直線上に運動している。( b,c)複数のキネシンにより運ばれる微小管の速度とキネシンの数の関係。(b)キネシン-1 の場合。(c)キネシン-14 の場合。( *P <
0.05, n.s., 有意差なし(Steel-Dwass’s test))。
3.波及効果、今後の予定
今回開発した分子を並べる手法は、様々な種類のモータータンパク質の協働性の研究に使用することが出来ます。モータータンパク質の協働性の理解が進むことで、細胞内の物質輸送や細胞分裂などの様々な生命現象の仕組みについて新たな知見を得ることが期待できます。モーター分子を適切に並べることで大きな力や速度を人工的に引き出せば、モータータンパク質をマイクロマシンや分子ロボットの動力源として応用することも期待できます。
4.資料提供
1/23 以降であれば、以下の URL より資料をご利用いただけます。報道で使用される場合、提供元は「 横川隆司 京都大学工学研究科教授」でお願いいたします。
https://advances.sciencemag.org/content/6/4/eaax7413
5. 研究プロジェクトについて
JSPS 科学研究費補助金( JP17H03206)、立石科学技術振興財団研究助成、競輪とオートレースの補助事業の支援を受けました。金ナノピラーデバイスの作製については、京都大学ナノテクノロジーハブ拠点( ナノハブ)を利用しました。
京都大学の研究者がナノ加工、モータータンパク質の固定と微小管の運動評価を実施し、NICT がキネシン-14 の提供と固定方法の最適化について助言しました。
<研究者のコメント>
我々は、機械工学に立脚したマイクロ・ナノ加工技術を専門として、生命科学分野におけるブレイクスルーにつながるような学際融合研究を推進しています。マイクロ・ナノスケールに微細化することで新たに現れる物理現象や生命科学現象に興味を持っています。本学の物理工学科、機械系三専攻の学生に限らず、チャレンジ
精神のある学生・研究員を募集しています。興味のある方は、是非、横川までご連絡ください。
<論文タイトルと著者>
タイトル: Different motilities of microtubules driven by kinesin-1 and kinesin-14 motors patterned on nanopillars(ナノピラーにパターニングされたキネシン-1 とキネシン-14 によって駆動される微小管の異なる運動特性)著 者:金子泰洸ポール、古田健也、大岩和弘、新宅博文、小寺秀俊、横川隆司掲 載 誌:Science Advances(アメリカ科学振興協会(AAAS)刊行の科学雑誌)
DOI:10.1126/sciadv.aax7413