液体のりの主成分でホウ素中性子捕捉療法の効果を劇的に向上
2020-01-23 東京工業大学,京都大学,ナノ医療イノベーションセンター,ステラファーマ株式会社,日本医療研究開発機構
要点
- 液体のりの主成分であるポリビニルアルコールを中性子捕捉療法用のホウ素化合物に加え、治療効果を大幅に向上。
- マウスの皮下腫瘍に対する治療効果はほぼ根治に近いレベルを実現。
- 臨床応用を目指し、ステラファーマ株式会社の協力を得て研究を推進。
概要
東京工業大学 科学技術創成研究院 化学生命科学研究所の野本貴大助教と西山伸宏教授(川崎市産業振興財団ナノ医療イノベーションセンター主幹研究員兼任)の研究グループは、液体のりの主成分であるポリビニルアルコール(用語1)を中性子捕捉療法用のホウ素化合物(ボロノフェニルアラニン=BPA、用語2)に加えるだけで、その治療効果を大幅に向上できることを発見し、マウスの皮下腫瘍をほぼ消失させることに成功しました。
BPAはがんに選択的に集積することができる優れたホウ素化合物ですが、がんに長期的に留まることができず、その滞留性を向上させることが強く望まれていました。野本助教と西山教授は、スライムの化学(用語3)を利用してポリビニルアルコールにBPAを結合することにより、結合させた物質ががん細胞に選択的かつ積極的に取り込まれ、その滞留性を大きく向上できることを発見しました。更に、京都大学研究用原子炉にて、マウスの皮下腫瘍に対するその治療効果を検討した結果、ほぼ根治することを確認しました。本研究成果は、従来の方法では治療困難ながんに対する革新的治療法として応用が期待されます。
本研究成果は2020年1月22日(米国東部時間)に米国のオープンアクセスオンライン科学誌「Science Advances」に掲載されます。また本研究の臨床応用を目指し、ステラファーマ株式会社(用語4)の協力を得て研究を進める予定です。
背景
ホウ素中性子捕捉療法(BNCT、用語5)は、ホウ素(10B)に対して熱中性子(用語6)を照射することにより核反応を起こし、細胞傷害性の高いアルファ粒子(用語7)とリチウム反跳核(用語8)を発生させて、それによりがんを治療する方法です(図1)。従来の方法では治療することが困難な再発性のがん、多発性のがんに対しても有効であるため、第4のがん治療法と呼ばれる免疫療法に続く、第5のがん治療法として大きな期待を集めています。
BNCTではいかにホウ素をがんに選択的に集積させることができるかが重要です。現在、臨床で主に使用されているホウ素化合物はボロノフェニルアラニン(BPA)という物質です。BPAは、LAT1(用語9)というがん細胞上に多く発現しているアミノ酸トランスポーターを介して細胞に取り込まれる性質があるため、選択的にがんに集積することができる化合物です。
現在、BPAの臨床試験はステラファーマ株式会社が行っており、臨床試験第II相において、再発頭頸部がんに対しBNCT施行90日後の奏効率71.4%という治療効果が得られています。このように使用されているBPAですが、がん細胞に選択的に集積することができるものの、長期的にはがん細胞に滞留することができないケースもあり、BPAのがんにおける滞留性を長期化できれば、BNCTの治療効果を更に向上できると考えられていました。
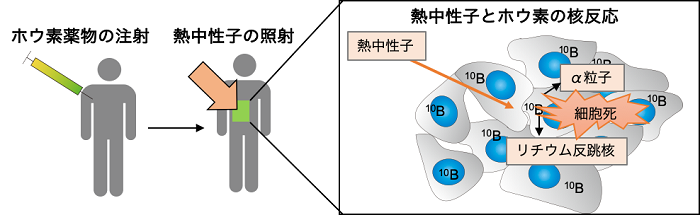
図1. BNCTの原理ホウ素と熱中性子が核反応を起こし、細胞傷害性の高いα粒子とリチウム反跳核を産生する。これらの粒子ががん細胞に致命的な傷害を与える。これらの粒子の移動距離は細胞1個の大きさ程度に相当するので、ホウ素をがん細胞だけに集めることが重要である。
研究成果
BPAががん細胞に長期的に留まることができない原因の一つとして、LAT1の交換輸送メカニズムが関連していると考えられています。LAT1は細胞外のBPAを取り込む際に細胞内のアミノ酸を排出しますが、細胞外のアミノ酸を取り込む際に細胞内のBPAを排出することもあります。その結果、細胞外のBPA濃度が低下すると細胞内のBPAが流出してしまう現象が起きます(図2)。このような細胞外へのBPAの流出を抑えるために、東京工業大学の野本助教と西山教授の研究グループは、液体のりとホウ砂から作られるスライムと同様の化学反応を利用した方法を開発しました。
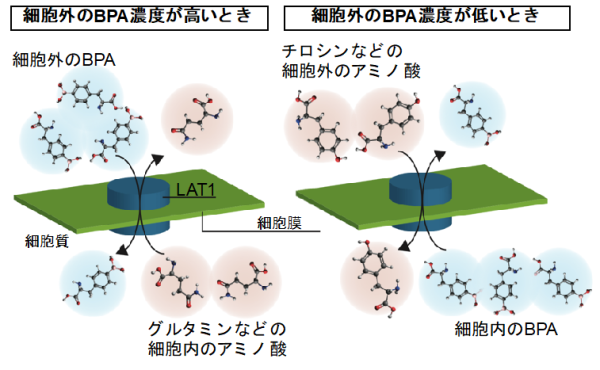
図2. BPAの細胞内取込み・細胞外流出のメカニズム細胞外のBPA濃度が高いときはLAT1を介してBPAが細胞内に取り込まれ、細胞内のアミノ酸が細胞外に排出される。一方、細胞外のBPA濃度が低いときは細胞外のアミノ酸が取り込まれ、細胞内のBPAが細胞外に排出される。
液体のりの主成分であるポリビニルアルコール(PVA)は、生体適合性の高い材料として古くから研究されてきた物質であり、さまざまな医薬品の添加物としても使用されています。PVAは多くのジオール基(用語10)を持っており、このジオール基はホウ酸やボロン酸と呼ばれる構造と水中でボロン酸エステル結合を形成することができます。野本助教と西山教授らはこの化学を利用してBPAをPVAに結合させたところ、PVAに結合したBPA(PVA-BPA)はLAT1介在型エンドサイトーシス(用語11)という経路で細胞に取り込まれるようになり、従来のBPAが細胞質に蓄積するのに対し、PVA-BPAはエンドソーム・リソソーム(用語12)に局在するようになりました(図3(A))。その結果、がん細胞に取り込まれるホウ素量が約3倍に向上し、細胞内で高いホウ素濃度を長期的に維持することが可能となりました。
更に、マウスの皮下腫瘍モデルを用いて、がんへの集積性を評価したところ、従来のBPAと同等以上の集積性を示しました(図3(B))。従来のBPAは徐々に腫瘍内の集積量を低下させた一方で、PVA-BPAはその高いホウ素濃度を長期的に維持することができました。そして、熱中性子を照射すると、PVA-BPAは強力な抗腫瘍効果を示し、ほぼ根治に近い結果を得ることができました(図3(C))。
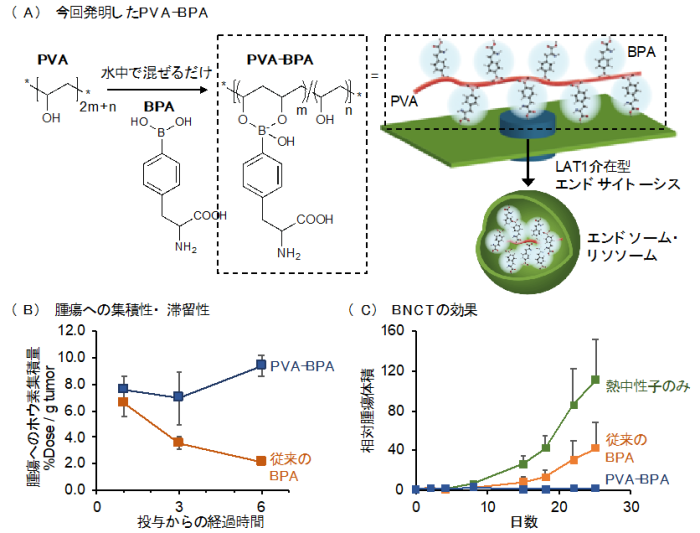
図3. 研究成果の概要(A)今回発明したPVA-BPA:スライムの化学を利用してBPAをPVAに結合した。PVA-BPAはLAT1介在型エンドサイトーシスにより細胞に取り込まれエンドソーム・リソソームに局在するようになる。
(B)腫瘍への集積性・滞留性:PVA-BPAは、従来のBPAと比較して優れた腫瘍集積性と滞留性を示した。
(C)BNCTの効果:PVA-BPAを用いたBNCTではほぼ根治に近い治療効果が得られた。
今後の展開
BNCTの開発において、我が国は最先端の研究をリードしている状況です。このBNCTの最先端研究を支えてきたのは、我が国の学術界で唯一、BNCTに必要な中性子を産生することができる京都大学複合原子力科学研究所の研究炉(KUR)の役割が極めて大きいといえます。今後もPVA-BPAの効果をより詳細に明らかにすべく、KURを中心にした基礎研究を推進する予定です。
一方、最近の臨床研究においては、BNCTの普及を目指した加速器型中性子線源が主流になっています。しかし、現状の加速器型中性子線源による熱中性子の産生量では、浅い部位のがんに適応が限定されると考えられています。治療の適応を深部まで拡げるためには、がん組織内のホウ素濃度を長期的に高く維持することが求められており、この点において本研究成果のPVA-BPAは大きく貢献できるものと期待されます。
また、PVA-BPAはスライムを作るように、水中でPVAとBPAを混ぜるだけで簡単に合成することが可能です。製造が容易である上に治療効果も非常に優れていることから、本研究成果は極めて実用性が高いと考えられます。今後、ステラファーマ株式会社の協力を得て更なる研究を行うことになり、安全性を精査しながら臨床応用への可能性を検討していく予定です。
追記(研究の経緯)
本研究成果は精力的に活動する多様な研究者が集まる東京工業大学という土壌があってこそ生まれたといえます。野本助教と西山教授は精密設計高分子を基盤にした薬物送達システムの開発に従事し、特に光などの物理エネルギーに応答して治療効果を出す化合物をがんに選択的に送達する技術の開発を継続的に行ってきました。
2013~14年に野本助教と西山教授が着任した科学技術創成研究院 化学生命科学研究所(当時、資源化学研究所)には、中村浩之教授(2015~19年、中性子捕捉療法学会会長)がおり、3人でBNCTに使用する薬物をがんに届ける方法について研究の議論を重ねてきました。その途中の2016年、大隅良典栄誉教授がノーベル生理学・医学賞を受賞し、主流となる研究を追いかけるのではなく、誰も注目しないような側面に焦点を当てて研究をすることが面白いということを学内の講演会で強調されました。
大隅栄誉教授のこのメッセージに鼓舞され、野本助教と西山教授は薬物の代謝という今までに焦点が当てられなかった側面に着目し、今回のBPAのがん細胞における滞留性の向上についてアイディアを着想しました。野本助教と当時、修士課程学生の井上透矢氏が中心になって実験を重ね、BNCTの評価に必要とされる研究手法については中村教授から助言を受けて進め、本研究成果につながりました。
本研究のコンセプトはまさに教職員と学生が一丸になった“Team東工大”により創出されたものです。そして、我が国の学術界で唯一BNCTに必要な中性子を産生することができる京都大学複合原子力科学研究所と、最先端の分析機器を備える川崎市産業振興財団ナノ医療イノベーションセンター(iCONM)の助力を得て、BNCTに有用な研究成果であることが明らかになりました。
用語説明
- (用語1)ポリビニルアルコール:
- 水溶性の高分子で洗濯のりや液体のりの主成分として日常に幅広く浸透している材料。生体適合性の高い材料としても知られており、医用材料として既にさまざまな形で利用されている。最近では東京大学のグループがポリビニルアルコールを用いることで造血幹細胞を増幅することに成功したとして広く報道された。
- (用語2)中性子捕捉療法用のホウ素化合物(ボロノフェニルアラニン=BPA):
- 必須アミノ酸のフェニルアラニンと類似した構造を持ちながら、ホウ素原子を含有した化合物。がん細胞に選択的かつ効率的に取り込まれることが知られている。熱中性子を当てると化合物中のホウ素原子が核反応を起こしてがん細胞を殺傷する。
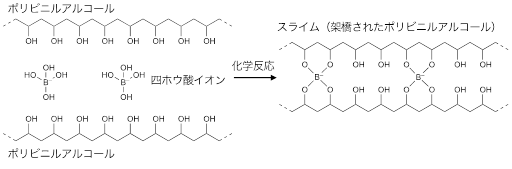
- (用語3)スライムの化学:
- 洗濯のりとホウ砂を混ぜるとスライムができる。これはホウ砂から生じるホウ酸イオンが化学反応により複数のポリビニルアルコールをつなぐからである。本研究ではこの化学反応を応用している。
- (用語4)ステラファーマ株式会社:
- BNCT用のホウ素化合物の開発を行っている国内企業。10Bの濃縮技術を有しているステラケミファ株式会社の子会社であり、SPM-011(BPAのsorbitol製剤 一般名:ボロファラン(10B))の臨床試験を行い、BNCTの実用化に取り組んでいる。最近、SPM-011の薬機法での承認申請を行った。
- (用語5)ホウ素中性子捕捉療法(boron neutron capture therapy: BNCT ):
- ホウ素原子(10B)と熱中性子の核反応により生じるアルファ粒子とリチウム反跳核を利用してがんを治療する放射線療法の一種。従来の放射線療法では治療することが困難な再発性のがんや多発性のがんに対しても有効な治療法であるとされている。楽天メディカルが開発している光免疫療法と並び、BNCTは第5のがん治療法としても注目を集めている。BNCTの研究は50年以上前から日本を中心に進められてきた歴史があり、現在でも日本が最先端の研究をリードしている。最近、熱中性子源として、加速器型中性子線源の開発が活発に進められ、新たなホウ素薬剤の開発が求められていた。
- (用語6)熱中性子:
- エネルギーの低い中性子。熱中性子単独では細胞傷害性がほぼ無い。
- (用語7)アルファ粒子:
- 高いエネルギーを持つヘリウムの原子核。細胞傷害性が高いが、細胞1つ分の距離しか移動しない。
- (用語8)リチウム反跳核:
- ホウ素原子と熱中性子の核反応により生じるリチウムの原子核。アルファ粒子と同様に、高いエネルギーを持つが細胞1つ分の距離しか移動しない。
- (用語9)LAT1:
- 細胞がアミノ酸を取り込むためのタンパク質の一つ。正常な細胞にはほとんど発現していないが、がん細胞では細胞膜上に多く発現していることが知られている。
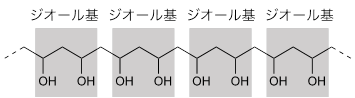
- (用語10)ジオール基:
- 化学構造の中で、2つのヒドロキシ基(-OH)から構成される部分。ポリビニルアルコールでは下図の灰色部分が相当する。
- (用語11)LAT1介在型エンドサイトーシス:
- エンドサイトーシスとは、細胞が細胞外の物質を細胞内へ取り込む方法の一つである。今回開発した物質は、最初に細胞膜上のLAT1にくっつき、その後にエンドサイトーシスで細胞に取り込まれる。この過程をLAT1介在型エンドサイトーシスと呼んでいる。
- (用語12)エンドソーム・リソソーム:
- エンドサイトーシスによって取り込まれた物質が局在する細胞内小器官。
論文情報
- 掲載誌:
- Science Advances
- 論文タイトル:
- Poly(vinyl alcohol) Boosting Therapeutic Potential of p-Boronophenylalanine in Neutron Capture Therapy by Modulating Metabolism
- 著者:
- Takahiro Nomoto, Yukiya Inoue, Ying Yao, Minoru Suzuki, Kaito Kanamori, Hiroyasu Takemoto, Makoto Matsui, Keishiro Tomoda, Nobuhiro Nishiyama
- DOI:
- 10.1126/sciadv.aaz1722
本研究は下記からの支援を受けて遂行された。
国立研究開発法人 科学技術振興機構(JST)
-
- センターオブイノベーション(COI)プログラム
国立研究開発法人 日本医療研究開発機構(AMED)
-
- 橋渡し研究戦略的推進プログラム補助事業(拠点名:筑波大学、研究開発代表者: 東京工業大学 野本貴大)「シーズA17-89超低侵襲中性子捕捉療法を実現する代謝制御型ホウ素送達システム」
- 革新的バイオ医薬品創出基盤技術開発事業(研究開発代表者: 東京工業大学 西山伸宏)「高分子ナノテクノロジーを基盤とした革新的核酸医薬シーズ送達システムの創出」
- 次世代がん医療創生研究事業(研究開発代表者: 東京工業大学 西山伸宏)「DDS技術を基盤とした革新的がん治療法の開発」
筑波大学つくば臨床医学研究開発機構(T-CReDO)
文部科学省
ダイナミック・アライアンス
お問い合わせ先
研究内容について
東京工業大学 科学技術創成研究院 化学生命科学研究所 助教
野本 貴大
東京工業大学 科学技術創成研究院 化学生命科学研究所 教授
西山伸宏
京都大学 複合原子力科学研究所 附属粒子線腫瘍学研究センター 教授
鈴木実
BNCTについて
京都大学 複合原子力科学研究所
取材申し込み先
東京工業大学 広報・社会連携本部 広報・地域連携部門
京都大学総務部広報課 国際広報室
川崎市産業振興財団ナノ医療イノベーションセンター
COINS事務局 担当:島﨑
ステラファーマ株式会社 総務部
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 がん研究課


