2021-04-16東邦大学医学部,日本医療研究開発機構
東邦大学医学部生化学講座の仁科 隆史助教と中野 裕康教授の研究グループは、大腸がんの形成に関わることが報告されているインターロイキン11(IL-11)と呼ばれるサイトカインの産生を、生体内で可視化できるマウスを新たに作製しました。このマウスを使って大腸がんモデルならびに大腸炎モデルを作製して解析し、IL-11陽性細胞の大腸炎や大腸がんにおける出現パターンや発現している遺伝子の網羅的な解析を行った結果、IL-11陽性細胞は大部分が線維芽細胞であり通常の組織には存在しないものの、大腸炎や大腸がんの進展に伴い局所に出現することが分かりました。また、IL-11陽性細胞で高発現している一群の遺伝子発現は、ヒト大腸がんの再発率と関係していることを明らかにしました。本成果は大腸がんを制御する治療法を開発する上で、IL-11陽性細胞が新たな治療標的となる可能性を示したものです。
この研究成果は2021年4月16日に英国の科学誌「Nature Communications」に掲載されます。本研究は順天堂大学 多田 昇弘先任准教授、八木田 秀雄先任准教授、東海大学 大塚 正人教授、東京理科大学 松島 綱治教授、西山 千春教授、金沢大学がん進展制御研究所 大島 正伸教授、ミシガン大学 猪原 直弘准教授らとの共同研究によるものです。
発表者名
仁科 隆史(東邦大学医学部生化学講座 助教)
中野 裕康(東邦大学医学部生化学講座 教授)
発表のポイント
- IL-11を産生する細胞(IL-11陽性細胞)を生体内で可視化できるマウスを作製しました。
- IL-11陽性細胞は通常ではほとんど存在せず、大腸炎や大腸がんの進展に伴い大腸間質に出現し、大多数は線維芽細胞であることが明らかになりました。
- IL-11を産生する線維芽細胞は、IL-11を産生しない線維芽細胞と比較して、約350個の遺伝子が高発現していることが示されました。
- IL-11陽性細胞から分泌されたIL-11は、周囲の腫瘍細胞だけでなく、IL-11陽性細胞自身も活性化している可能性が示唆されました。
- ヒト大腸がんのデータベースの解析から、IL-11陽性細胞で発現が亢進している遺伝子群を高発現している患者群では、大腸がんの再発のリスクが高まっていることがわかりました。
発表概要
大腸がんや胃がんへの関与が示唆されるIL-11と呼ばれるサイトカインを産生する細胞(IL-11陽性細胞)を、蛍光タンパク質の発現により生体内で標識することのできる遺伝子改変マウスを作製し、マウス大腸がんにおけるIL-11陽性細胞を可視化することができました。
またIL-11陽性細胞は大部分が線維芽細胞であることを明らかにし、IL-11陽性細胞で発現の亢進している遺伝子群を同定しました。さらにヒト大腸がんデータベースを用いた解析から、IL-11陽性細胞で高発現している遺伝子群と大腸がんの再発とが正に相関することを明らかにしました。以上より、IL-11陽性細胞を標的とする大腸がんの新たな治療法の開発が期待されます。
発表内容
本研究の背景
日本における大腸がんは食事の欧米化に伴って増加し、現在大腸がんによる死亡数は男性では3番目、女性では1番目となっています。このような状況で大腸がんの早期発見や有効な治療法の開発は喫緊の課題であると考えられます。一般的に正常に存在する上皮細胞に遺伝子変異が生じてがん化するわけですが、がん細胞の増殖・進展はがん細胞の力だけでは不十分で、その周囲に存在する細胞(がん間質細胞)との相互作用が重要であることがわかっています。それらの細胞の中には免疫系の細胞である貪食細胞(腫瘍随伴マクロファージ)(注1)や、がんに対する免疫を阻害するような制御性T細胞(注2)が存在します。さらにがんの促進に線維芽細胞も関与することが知られており、それらは腫瘍随伴線維芽細胞(Cancer-associated fibroblast [CAF])(注3)と総称されています。しかしながら、免疫細胞と比較してCAFで特異的に発現している分子の情報が不足していることから、生体において、それらがどのような特性をもった集団なのかについては不明な点が多くありました。
一方で、本研究グループは、今回注目したIL-11(注4)と呼ばれるサイトカインは活性酸素により発現が誘導され、肝細胞の増殖を誘導することを以前の論文で報告しました(Nishina et al., Sci. Signal., 2012)。また他の研究グループからは、ヒトおよびマウスの胃がんや大腸がんでIL-11の発現が亢進していることが報告されています。さらに興味深いことに、IL-11の機能を阻害することでマウスの大腸がんや胃がんが縮小することも報告され、IL-11を標的とした大腸がんの治療の可能性が示唆されています。しかしこれまでの報告ではIL-11を産生する細胞がどのような細胞なのかは明らかにされておらず、大腸がんの予後とIL-11の発現との関係についても不明でした。
本研究の成果
研究グループは、まずどのような細胞がIL-11を産生するかを明らかにするために、IL-11の発現を蛍光タンパク質EGFP(注5)でモニタリングできるIL-11レポーターマウス(注6)を作製しました。IL-11の発現量は通常環境下では精巣などの一部の臓器を除き非常に少なく、今回注目した大腸においてもEGFP陽性細胞は検出できませんでした。一方で、IL-11レポーターマウスを用いて炎症誘発大腸がんモデル(注7)やヒト家族性大腸腺腫症(注8)のモデルマウスを作製し腫瘍部を解析したところ、大腸がんの間質を埋めるような形でIL-11陽性細胞が出現してくることが組織学的な解析から示されました(図1)。また、フローサイトメーター(注9)を用いた解析により、大多数のIL-11陽性細胞は線維芽細胞であることが明らかになりました。さらにIL-11陽性細胞の特徴を明らかにするために、IL-11陽性の線維芽細胞とIL-11陰性の線維芽細胞で発現している遺伝子をRNA-seq解析(注10)合わせて、ヒト大腸がんのデータベースを用いた解析から、腫瘍におけるIL-11の発現は大腸がんの再発とは無関係なものの、IL-11陽性細胞で発現の高い一群の遺伝子と大腸がんの再発には有意な正の相関があることが明らかとなりました(図3)。
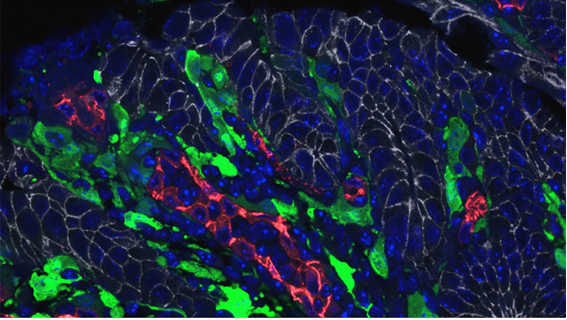
図1. ヒト家族性大腸腺腫症モデルマウスの大腸がん部で見出されたIL-11陽性細胞大腸がん(正確には大腸腺腫)部位における免疫染色像。大腸がんの間質にIL-11陽性細胞が認められる。これらの陽性細胞は正常部では認められない。白色、E-cadherin陽性大腸がん上皮細胞; 緑色、IL-11陽性細胞; 赤色、CD31陽性血管内皮細胞;青、DAPI陽性の細胞の核をそれぞれ示す。
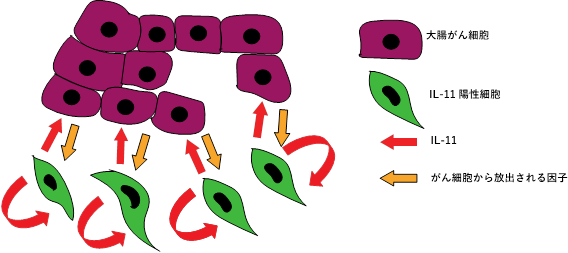
図2. IL-11陽性細胞とがんとの相互作用大腸がん細胞の作用よりIL-11陽性細胞が出現する。出現したIL-11陽性細胞はIL-11を分泌し、自分自身および腫瘍細胞に活性化シグナルを導入する。これらの増殖シグナルが相互に細胞を活性化して、がんの進展を促進する。簡略化のために他の免疫細胞やIL-11陰性線維芽細胞を省略してある。
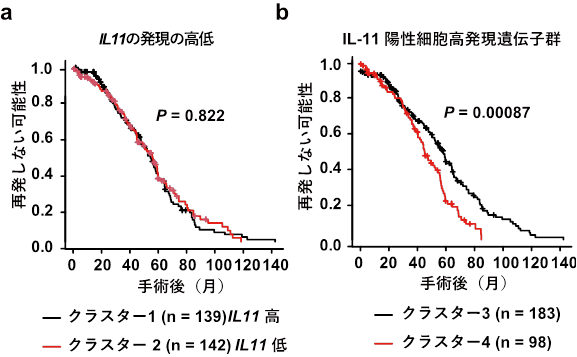
図3. IL-11陽性細胞で高発現している遺伝子群の発現パターンと大腸がんの予後は相関するヒト大腸がん患者データベースを用いたクラスタリング解析。(a)IL11遺伝子発現の高低は、大腸がんの再発有無には無関係。(b)IL-11陽性細胞で高発現している遺伝子群の発現パターンにより予後の悪い群と良い群の2群にクラスタリング法により分類することができる。nはそれぞれの大腸がん患者の症例数。PはLog-rank検定のP値。
今後の展望
ヒト大腸がんや胃がんではIL-11が高発現し、発がんモデルマウスではIL-11受容体に対する阻害剤処置やIL-11受容体遺伝子の欠損により、がんが縮小することが報告されています。今回の解析から、IL-11は腫瘍形成を促進するものの、大腸がんの予後不良因子ではない可能性が示唆されました。また、IL-11陽性細胞はIL-11だけでなく他の増殖因子を産生することや、IL-11陽性細胞で発現の亢進している一群の遺伝子と大腸がんの再発が正に相関したことから、IL-11ではなく、IL-11陽性細胞を標的としたがん治療が有用となる可能性が示唆されました。今後は、IL-11陽性細胞で高発現しているどのような遺伝子が大腸がんの再発に関与しているかを解析していく必要があると考えられます。
発表雑誌
雑誌名
「Nature Communications 」(2021年4月16日)
論文タイトル
Interleukin-11-expressing fibroblasts have a unique gene signature correlated with poor prognosis of colorectal cancer
著者
Nishina T, Deguchi Y, Ohshima D, Takeda W, Ohtsuka M, Shichino S, Ueha S, Yamazaki S, Kawauchi M, Nakamura E, Nishiyama C, Kojima Y, Adachi-Akahane S, Hasegawa M, Nakayama M, Oshima M, Yagita H, Shibuya K, Mikami T, Inohara N, Matsushima K, Tada N, Nakano H.
DOI番号
10.1038/s41467-021-22450-3
用語解説
(注1)腫瘍随伴マクロファージ
腫瘍組織に浸潤・集積しているマクロファージで、その多くは免疫を抑制するようなサイトカインを分泌し、免疫抑制的に働くことが知られている。
(注2)制御性T細胞
自己に対する免疫応答を抑制している細胞で、自己免疫病の発症を防ぐ役割を持っている。その一方で腫瘍組織にこの細胞が多く浸潤している場合には、腫瘍を攻撃するCD8陽性T細胞の働きを抑制する結果、効率的な腫瘍免疫を抑制することになる。
(注3)腫瘍随伴線維芽細胞(CAF)
腫瘍随伴マクロファージとともにがん組織の中で目立つ細胞集団であり、正常上皮細胞ががん化するのを助けたり、がん細胞の浸潤遠隔転移を促進するような働きを持っているものもある。この細胞集団は単一ではなく、様々な機能を有するヘテロな細胞集団と考えられている。
(注4)インターロイキン11 (IL-11)
細胞から放出されるタンパク質(サイトカイン)の1種類であり、IL-6ファミリーに属する。IL-6と受容体を一部共有しており、IL-6と類似した信号を細胞の中に導入するが、発現する細胞や受容体の発現する細胞はIL-6とIL-11とでは異なる。
(注5)EGFP
Enhanced green fluorescent proteinの略であり、GFPの蛍光の強度を、遺伝子を改変することによりさらに増加させたもの。様々な実験系に利用されている。
(注6)レポーターマウス
ある遺伝子の発現を可視化するために発現を可視化したい遺伝子の発現制御領域下に蛍光タンパク質をコードしたDNAを挿入することにより,その遺伝子の発現と同調して、蛍光タンパク質により細胞が蛍光を発するように遺伝子を改変したマウス。
(注7)炎症誘発大腸がんモデル
マウスにおいては、化学発がん性物質であるアゾキシメタンを腹腔内に投与した後に、大腸炎誘導剤となるデキストラン硫酸を複数回、飲水にて投与すると直腸大腸がんが誘導される。一方で潰瘍性大腸炎の患者では、大腸がんのリスクが高くなることが知られており、マウスを用いた炎症誘発大腸がんモデルはこの病態に類似していると考えられる。
(注8)ヒト家族性大腸腺腫症
10歳前後から大腸に多数の腺腫性ポリープが発生し、最終的には100%大腸がんを発症する常染色体性優性遺伝疾患である。APC (Adenomatous Polyposis Coli) と呼ばれるがん抑制遺伝子の機能欠損変異により生じる。APCタンパク質はWnt/b-カテニンシグナル伝達経路に対して、抑制的に働く分子である。
(注9)フローサイトメーター
複数のレーザーとそのレーザーにより励起された蛍光波長を検出する機器を持ち、蛍光標識した抗体を用いることにより細胞表面にどのような分子が発現しているかを解析することのできる装置である。
(注10)RNA-seq
RNA-seq解析は、次世代シークエンサーを用いて取得したリードの情報をもとに、RNA配列を解析する手法であり、得られた情報をもとにデータ解析することで、サンプル内の遺伝子の発現量が解析できる。
本研究への支援
本研究は国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「NASHにおける肝リモデリングを制御する細胞間相互作用の解明と革新的診断・治療法創出への応用」(研究開発代表者:田中 稔)、文部科学省 私立大学研究ブランディング事業「上皮バリア機構の不全により生じる疾患の克服を目指したブランディング事業」および日本学術振興会科学研究費補助金により支援を受けて行われたものです。
お問い合わせ先
本発表資料のお問い合わせ先
東邦大学医学部生化学講座生化学分野
教授 中野 裕康
本ニュースリリースの発信元
学校法人東邦大学 法人本部経営企画部
AMEDに関するお問い合わせ先
国立研究開発法人日本医療研究開発機構 (AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課