2021-04-16 がん研究会,京都大学,日本医療研究開発機構
ポイント
- これまで肺がんの臨床検体を利用して抗がん剤に対する薬剤感受性および抵抗性の分子基盤の研究が進められてきました。また、多くのがんで、EEGFR (Epidermal growth factor receptor: 上皮成長因子受容体) の突然変異が認められ、EGFR遺伝子ががん原遺伝子として働いていることが示されています。本研究グループは、多剤耐性EGFR変異(注1)肺がんにおける薬剤抵抗性についての新たな克服法の開発に取り組んできました。今回、EGFR-L747P変異体を詳細に解析し、新たな創薬につながる成果を発表しました。
- EGFR変異肺がんの9割はEGFR-L858RまたはEGFR-exon19 (del19)欠損変異ですが、低頻度で様々な変異体(マイナー変異体)があり、その1つにEGFR-L747P変異があります。この変異について、EGFRチロシンキナーゼの活性化機構や薬剤感受性を高精度コンピュータ・シミュレーションにより明らかにしました。
- EGFR-L747P変異体は第1世代EGFR阻害薬(ゲフィチニブ、エルロチニブ:注2)や、最近報告されたEGFRアロステリック阻害薬(注3)に耐性を示す一方で第2世代EGFR阻害薬アファチニブには感受性を示しましたが、これらの薬剤感受性について、変異体の共結晶構造がなくてもスーパーコンピュータを用いた分子動力学(Molecular Dynamics:MD)シミュレーション解析(注4)から説明可能となりました。
- 主要なEGFR変異体(L858Rまたはdel19)では、抗EGFR抗体によりEGFR阻害薬(アファチニブなど)への感受性が増しますが、EGFR-L747P変異体では、抗EGFR抗体により感受性が変化しないことが判明しました。この理由について、マイクロ秒(100万分の1秒)タイムスケールの長時間MDシミュレーションにより構造面から推定可能になりました。
- マイクロ秒タイムスケールの長時間分子動力学シミュレーションにより、EGFR-L747Pが常に活性化構造をとっていることが明らかとなり、不活性化構造に結合するタイプの阻害薬に抵抗性を示す理由を説明することができるようになりました。
- 実験的検討からEGFR-L747P変異選択的に阻害活性を示す化合物を発見しました。
研究の概要
我が国のがんによる死因の第1位は肺がんであり、その約85%が非小細胞肺がんに分類(注5)されます。この非小細胞肺がんの半数近くの患者さんではEGFRの活性化変異が、がんの原因遺伝子として見つかり、EGFR阻害薬(EGFRチロシンキナーゼ阻害薬)は、がん細胞を増殖させる酵素(EGFR)を抑制する作用(治療効果)があります。EGFR変異肺がんの約90%の患者さんでは、EGFR-exon19 部分欠損変異(EGFR-del19)またはEGFR-L858R変異があり、これらの変異によりEGFRの活性が上昇することにより、がん化が促進されます。これらの肺がんは、EGFRチロシンキナーゼ阻害剤(TKI)に高い感受性を示します(治療効果があります)。一方で残りの10%では、様々な種類のEGFR変異が同定されていますが、それらの特性、EGFR活性化機構、およびアロステリック阻害剤を含むさまざまなEGFR阻害薬に対する感受性については十分明らかになっていません。本研究において、我々は診断用のEGFR変異検査により、EGFR-del19変異と診断されたものの、次世代シーケンサーを用いた遺伝子変異解析からEGFR-L747P変異であることが判明した症例を経験しました。診断用のEGFR変異検査2種類を用いて患者検体由来DNAを再度試験した結果、いずれの検査方法でもEGFR-L747P変異はEGFR-del19と判定されてしまうことが確認されました。このEGFR-L747P変異について薬剤感受性並びに活性化機構等を、京都大学の奥野博士、荒木博士らとの共同研究により、スパコンを用いた高精度コンピュータシミュレーションにより解析しました。結合自由エネルギー計算とマイクロ秒タイムスケールの長時間分子動力学(MD:Molecular Dynamic)シミュレーションを実行し、L747P変異体ではEGFR活性化構造に重要なK745番目のリジン(K)と762番目のグルタミン酸(E)残基の間の塩橋が形成された安定な結合を常に維持していることが推定されました。さらにMDシミュレーションと結合自由エネルギー計算により、EGFR-L747P変異体はアロステリック阻害剤を含むいくつかのEGFR阻害剤に耐性であった理由を構造の面から明らかにすることができました。また、薬剤ライブラリーを用いたスクリーニングから、EGFR-L747P選択的に阻害活性を示す化合物を発見することにも成功しました。本研究で使用した高精度MDシミュレーションは、結晶構造解析がなされていない変異体の構造予測に強力なツールとなり、新たな創薬に活用できる可能性が示されました。
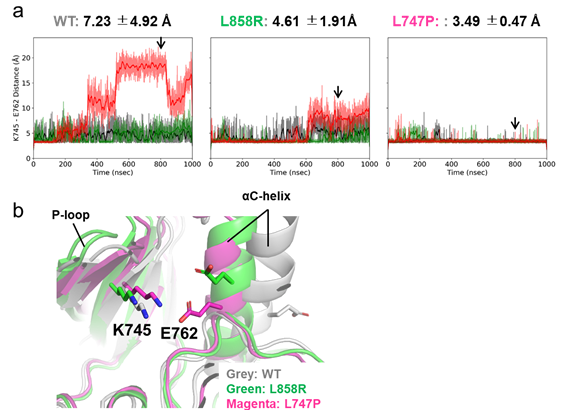
図:EGFRキナーゼ領域(野生型並びに変異体)の長時間MDシミュレーションから、野生型EGFRでは、構造が時折ダイナミックに変化する様子がとらえられ(a左)、EGFR-L747P変異ではK745とE762の間の塩橋(b)が形成され安定な構造を長時間とっている可能性が明らかにされました(a右)。aにおける矢印(赤線)はbで示した各構造状態の時点を示します。aの赤、緑、グレーの線はそれぞれ異なる試行回の長時間MDシミュレーション結果を示し、長時間MDシミュレーションによりはじめて大きな構造変化がとらえられることが判ります。
本研究は、がん研究会の片山量平(がん研究会 がん化学療法センター 基礎研究部)、西尾誠人(がん研究会 有明病院呼吸器内科)、奥野恭史(京都大学大学院 医学研究科)らの研究グループを中心としたメンバーによる共同研究にて行われました。
本研究の成果は、Nature Publishing Groupのパートナー誌であるNPJ Precision Oncologyに、2021年4月16日に公開されます。
論文名、著者およびその所属
論文名
Microsecond-timescale MD simulation of EGFR minor mutation predicts the structural flexibility of EGFR kinase core that reflects EGFR inhibitor sensitivity
ジャーナル名
NPJ Precision Oncology(Nature Publishing Groupのパートナー誌)
著者
Takahiro Yoshizawa1,2,3,4, Ken Uchibori1,2, Mitsugu Araki5, Shigeyuki Matsumoto6, Biao Ma7, Ryo Kanada6, Yosuke Seto1, Tomoko Oh-hara1, Sumie Koike1, Ryo Ariyasu2, Satoru Kitazono2, Hironori Ninomiya8, Kengo Takeuchi8, Noriko Yanagitani2, Satoshi Takagi1, Kazuma Kishi3,4, Naoya Fujita9, Yasushi Okuno5, Makoto Nishio2*, Ryohei Katayama1*
(* 責任著者)
著者の所属機関
- 公益財団法人がん研究会 がん化学療法センター 基礎研究部
- 公益財団法人がん研究会 がん研有明病院 呼吸器内科
- 学校法人東邦大学医療センター 大森病院 呼吸器内科
- 学校法人東邦大学大学院 臨床腫瘍学講座
- 国立大学法人京都大学大学院 医学研究科
- 国立研究開発法人理化学研究所 医科学イノベーションハブ推進プログラム
- 公益財団法人神戸医療産業都市推進機構 クラスター推進センター
- 公益財団法人がん研究会 がん研究所 病理部
本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED) 次世代がん医療創生研究事業(P-CREATE)「異分野先端技術融合による薬剤抵抗性を標的とした革新的複合治療戦略の開発」ほか
- 独立行政法人日本学術振興会 科学研究費補助金
- 日本財団
- 公益財団法人 上原記念生命科学財団
- 文部科学省 スーパーコンピュータ「富岳」成果創出加速プログラム「プレシジョンメディスンを加速する創薬ビッグデータ統合システムの推進」(課題責任者 奥野恭史 教授)
- 本論文の一部は、HPCIシステムを通じて東京大学情報基盤センター Reedbushスーパーコンピュータを利用して得られたものです。(課題番号:hp200129)
用語解説
(注1)EGFR遺伝子変異
EGFR(上皮成長因子受容体)は細胞膜上に発現するチロシンキナーゼ受容体であり、上皮成長因子 (EGF) が結合すると受容体は活性化し、細胞増殖シグナルを活性化することで、細胞を生存・増殖させます。しかし、EGFRの細胞内チロシンキナーゼ領域に特定のアミノ酸の欠失変異(EGFR-exon19 (del19)の約5アミノ酸の欠損)または1アミノ酸変異を起こす遺伝子変異(EGFR-L858R:EGFRの858番目のアミノ酸L(ロイシン)がR(アルギニン)に代わった変異体)があると、EGFRが恒常的に異常活性化します。それにより細胞増殖シグナルが常時活性化をし、がん化が引き起こされています。EGFR遺伝子変異陽性の肺がん細胞はEGFRチロシンキナーゼ活性に依存して生存・増殖しているため、EGFRチロシンキナーゼ阻害薬により、EGFRからの細胞増殖シグナルを遮断すると、がん細胞の生存・増殖は抑制されます。
(注2) EGFR阻害薬
現在、我が国においては、ゲフィチニブ、エルロチニブ、アファチニブ、ダコミチニブ、オシメルチニブが承認されており、1次治療やそれ以降の治療において使用されています。基質をリン酸化する際に必須となるATPとEGFRとの結合を阻害することでEGFRの活性化を抑制しています。
(注3)アロステリック阻害薬
キナーゼや受容体など、薬の阻害標的タンパク質の活性部位を狙った薬剤が広く用いられてきたが、この活性部位とは異なる部位に結合し、活性の度合いを調節するような薬剤をアロステリック阻害薬と呼びます。
(注4) 分子動力学(MD:Molecular Dynamic)シミュレーション
コンピュータを用いて原子・分子やこれらが構成する化学物質やタンパク質などの静的・動的な構造,およびその変化の過程などを、シミュレーションする方法であり、基本的に多数の原子の運動を、運動方程式を用いて再現する方法です。タンパク質などの高分子では、計算量が膨大であり、大規模並列計算が可能なスーパーコンピュータが必要です。
(注5)肺がんについて
国立がん研究センターのがん情報サービス(https://ganjoho.jp/public/cancer/lung/index.html)の説明によると、肺がんは、組織型によって、非小細胞肺がんと小細胞肺がんの2つに大きく分けられます。発生頻度が高いのは非小細胞肺がんで、腺がん、扁平上皮がん、大細胞がんに分類されます。中でももっとも多いのが腺がんで、一般には「肺腺がん」ともいいます。小細胞肺がんは、非小細胞肺がんと比べて増殖速度が速く、転移や再発をしやすい腫瘍です。
非小細胞肺がんと小細胞肺がんでは、治療方針が大きく異なるため、検査によって組織型を確認してから治療を開始することになっています。
お問い合わせ先
本研究に関すること
公益財団法人がん研究会 がん化学療法センター 基礎研究部
片山量平
取材等に関すること
公益財団法人がん研究会 広報部
がん対策全般についてのお問い合わせ
厚生労働省健康局 がん・疾病対策課
次世代がん医療創生研究事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED) 創薬事業部 医薬品研究開発課