乳がんタモキシフェン療法の遺伝子型に基づく個別化治療は必要か?世界初の前向き臨床試験で長年の論争に決着
2020-03-10 国立がん研究センター,慶應義塾大学
本研究のポイント
- 世界初の前向き無作為化比較試験によって、乳がんタモキシフェン療法における遺伝子型に基づく個別化治療の有効性を研究しました。
- 低代謝活性の遺伝子型を有する患者に対して、タモキシフェン増量による治療効果の向上は認めず、遺伝子型に基づく用量個別化は不要との結論に到達しました。
- 本研究により15年間の国際論争に決着をつけるハイレベルのエビデンスを得ることができました。
- 対象としたCYP2D6低代謝活性の遺伝子型を有する患者は、日本人では約7割にものぼりますが、本研究成果により低活性遺伝子型は治療上の不利益とはならないことを確認しました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院の藤原康弘副院長(当時)[現 医薬品医療機器総合機構 理事長]、田村研二 乳腺・腫瘍内科長、慶應義塾大学医学部 谷川原祐介 臨床薬剤学教室教授、今村知世 同講師(当時)[現 昭和大学先端がん治療研究所准教授]、国立研究開発法人理化学研究所 莚田泰誠 ファーマコゲノミクス研究チームリーダーらの研究グループは、全国54施設との共同で、乳がんタモキシフェン療法における遺伝子型に基づく個別化治療の有効性について世界初の前向き注1無作為化比較試験を実施しました。その結果、タモキシフェンを体内で活性化する酵素CYP2D6の低活性遺伝子型を有する患者に対して、タモキシフェン増量による治療効果の向上は認めず、遺伝子型に基づく用量個別化は不要との結論に達しました。
CYP2D6低活性遺伝子保有者割合には民族差があり、日本人では約7割に及びます。低活性の場合、現状のタモキシフェン内服量で十分、または不十分など、相反する研究結果がこれまで多数の後ろ向研究注2で示されるものの結論は出ていませんでした。日本人への影響が大きいこの議論について、本研究チームはより高いエビデンスを得られる前向き研究で調査し、世界に向けて発信することができました。
本研究成果は、米国臨床腫瘍学会機関誌「Journal of Clinical Oncology」に2月20日付で発表され、さらに同誌「Editorials」でも前向き臨床試験によるよりハイレベルのエビデンスとして取り上げられました。
背景
ホルモン受容体陽性乳がんは、がん細胞の増殖にエストロゲン(女性ホルモン)を必要とすることが知られています。このため、この女性ホルモンの分泌を抑えたり、働きを妨げる治療薬(ホルモン療法薬)が、この乳がんの治療薬として用いられています。
タモキシフェンはホルモン療法薬の1種で、ホルモン受容体乳がんの手術後の再発を抑える治療や転移のある方の病勢を抑える治療として用いられます。ただし、患者さんがこのタモキシフェンを内服しても、タモキシフェンはそのままではほとんど乳がんに対して働かず、体内の肝臓にあるCYP2D6という酵素により、タモキシフェンがより有効な形(代謝産物であるエンドキシフェンと4-OH-タモキシフェン)に変換されることでがんに対する効果を発揮します。このCYP2D6の活性には民族差や個人差があり、特に日本人においては約7割で遺伝的に活性が低く、欧米白人の5割に比べて頻度が高いことが知られています。
タモキシフェン療法とCYP2D6の活性との関連については、2005年に米国の研究チームが後ろ向き研究によってCYP2D6活性が遺伝的に低い人はタモキシフェンによる治療効果が劣るという仮説を発表して以来、これまで70報以上の研究論文が発表されたものの肯定する結果と否定する結果の相反する報告が併存し、タモキシフェンの内服量を多くする方が良いのではないかという仮説も提唱されるなど、乳がん領域における長年の課題となっていました。
低代謝活性という遺伝素因を有する患者にとってタモキシフェン療法の標準的な治療(内服量)が不利益であるならば、特に日本人において大きな問題となります。このような背景から、研究チームはCYP2D6低代謝活性の遺伝子を有する乳がん患者を対象として、増量治療の治療効果の方が高いのではないかという仮説に基づき、従来の標準的なタモキシフェン治療と2倍量の増量治療とを前向きに比較することで、個別化治療の必要性について研究しました。
研究方法
ホルモン受容体陽性転移・再発乳がん(一次治療)患者を対象とし、CYP2D6遺伝子検査に基づいて、低代謝活性の遺伝素因を有する患者を無作為に2群に分け、一方は標準用量20mgタモキシフェンで治療し、他方は40mgに増量して治療を行いました。2012年12月から2016年7月までの間に186名の患者が登録されました。主要評価項目は試験治療開始後6か月時点での増悪の有無とし、副次的評価項目として活性代謝物の血中濃度と有効性の関連性や無増悪生存期間を評価しました。
研究結果
登録された186名において、代謝活性が低い遺伝子型を保有していた136例のうち70例が40mg投与群、66例が20mg投与群に割り付けられました。また、代謝活性が高い遺伝子型を保有していた48例は標準用量20mgにて治療を行うものの主要評価項目では比較対象外とされました。残り2例は割り付け前の有害事象発現のため試験を継続できませんでした。研究の結果は以下の通りです。
- 試験治療開始後6か月時点での無増悪の割合はタモキシフェン20mg群と40mg群で差はなく(図に示すように66.7%と67.6%)、増量による治療効果向上は認めませんでした。
- 血清中の活性代謝物エンドキシフェン濃度は、20mg群に比して40mg群で有意に高かったものの、治療効果とは関連しませんでした。
- 6か月時点での無増悪患者と増悪患者で血清中の活性代謝物エンドキシフェン濃度には違いは見られませんでした。
結論
CYP2D6低活性型の遺伝子を有する乳がん患者において、タモキシフェンの用量を増やしても治療効果の向上には至りませんでした。すなわち、CYP2D6遺伝子多型だけでタモキシフェン治療効果の個人差を説明することはできず、よってCYP2D6遺伝子型に基づく用量個別化は不要との結論に到達しました。
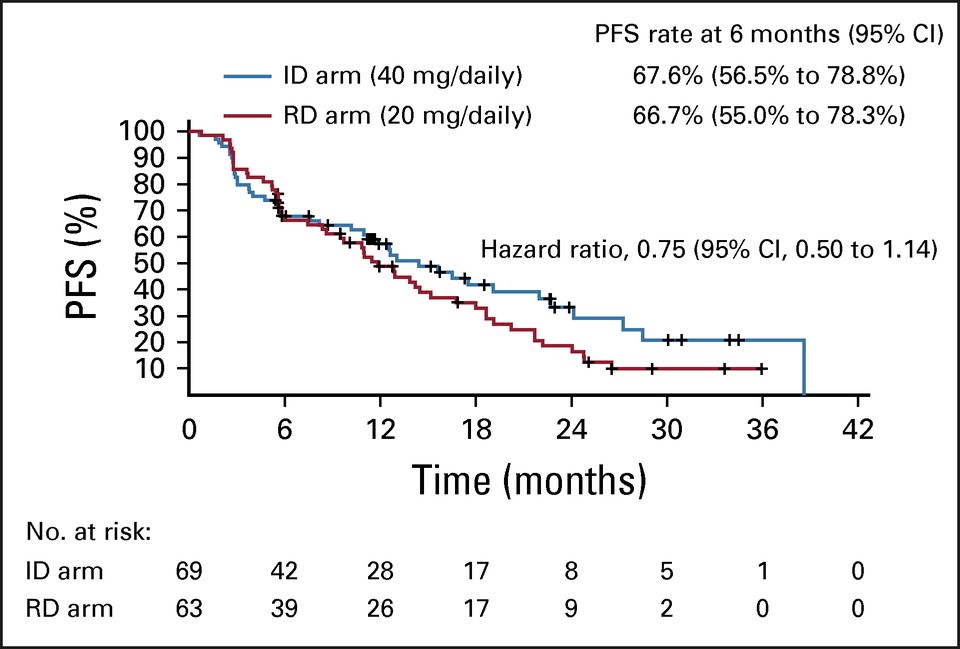
図: CYP2D6低活性型遺伝子を有する乳がん患者に対して、標準用量20mg(RD arm)と増量 40mg(ID arm)の2群について、無増悪生存期間を比較。主要評価項目である治療開始後6か月における無増悪生存率に差は認めなかった。
発表論文
雑誌名
Journal of Clinical Oncology
タイトル
CYP2D6 Genotype–Guided Tamoxifen Dosing in Hormone Receptor–Positive Metastatic Breast Cancer (TARGET-1): A Randomized, Open-Label, Phase II Study.
著者
Kenji Tamura, Chiyo K. Imamura, Toshimi Takano, Shigehira Saji, Takeharu Yamanaka, Kan Yonemori, Masato Takahashi, Junji Tsurutani, Reiki Nishimura, Kazuhiko Sato, Akira Kitani, Naoto T. Ueno, Taisei Mushiroda, Michiaki Kubo, Yasuhiro Fujiwara, Yusuke Tanigawara(責任著者).
DOI
10.1200/JCO.19.01412
URL
研究費
日本医療研究開発機構
革新的がん医療実用化研究事業
新規抗がん剤のPK/PD/PGxに基づく適正使用と安全性確保に関する研究
主任研究者 藤原康弘
用語解説
注1 前向き研究
患者さん協力のもと、新たにデータやサンプルを集め、実際に検証する研究。
注2 後ろ向き研究
診療情報や臨床検体など、カルテ記載事項、検査結果のデータ、組織サンプルを用いてさまざまな事柄を調査する。臨床研究の出発点として、診療上の問題や医学上の問題に対する答えの糸口を見つける役割を果たす。
お問い合わせ先
報道関係のお問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
慶應義塾大学
信濃町キャンパス総務課
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部医薬品研究課

