2018-04-23 理化学研究所
理化学研究所(理研)開拓研究本部伊藤細胞制御化学研究室の山口芳樹研究員、グローバル研究クラスタ疾患糖鎖研究チームの木塚康彦研究員(研究当時)、太田芙美テクニカルスタッフ(研究当時)、谷口直之チームリーダー(研究当時)らの国際共同研究グループ※は、炎症や慢性閉塞性肺疾患(COPD)[1]を抑える効果を持つ糖鎖「L4」に着目し、その作用の仕組みを解明しました。さらに、その作用を強めた新しい化合物を開発しました。
今後、本研究成果により、感染症やCOPDに対する糖鎖を標的とした新しい治療薬の開発が期待できます。
谷口チームリーダーらはこれまで、L4と呼ばれる二糖[2]がCOPDのモデルマウスで炎症を抑え、治療効果を持つことを明らかにしてきました。今回、L4を認識する受容体[3]としてランジェリン[4]を同定しました。ランジェリンは皮膚や組織の樹状細胞[5]に存在し、ウイルスや真菌(カビ)などが持つ外来糖鎖を認識して、免疫機能に重要な役割を果たすことが知られています。今回、①ランジェリンがL4と特異的に結合すること、②L4を化学合成で多量体[6]にしたところ、ランジェリンへの結合が1,000倍以上に強まること、③多量体のL4がCOPDモデルマウスで炎症を抑えることを明らかにしました。本成果は、L4がランジェリンを受容体として抗炎症作用を発揮する仕組みの発見に加え、L4やその多量体が、ウイルスや微生物による皮膚や肺の炎症を抑える可能性を示すものです。
本研究は、欧州の科学雑誌『Biochimica et Biophysica Acta – General Subjects』オンライン版(4月7日付)に掲載されました。
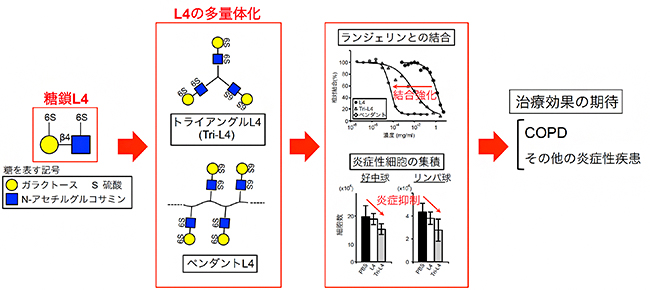
図 糖鎖L4の多量体化による期待される炎症性疾患の治療効果
※国際共同研究グループ
理化学研究所
開拓研究本部 伊藤細胞制御化学研究室
研究員 山口 芳樹(やまぐち よしき)
(グローバル研究クラスタ 糖鎖構造生物学研究チーム チームリーダー(研究当時))
グローバル研究クラスタ 疾患糖鎖研究チーム(研究当時)
研究員 木塚 康彦(きづか やすひこ)
(現 岐阜大学 生命の鎖統合研究センター 准教授)
テクニカルスタッフ 太田 芙美(おおた ふみ)
チームリーダー 谷口 直之(たにぐち なおゆき)
(現 大阪国際がんセンター研究所 プロジェクトリーダー)
生化学工業株式会社 中央研究所
研究員 平山 哲也(ひらやま てつや)
日本医科大学 呼吸ケアクリニック
所長 木田 厚瑞(きだ こうずい)
大阪大学 微生物病研究所
教授 山崎 晶(やまさき しょう)
マックスプランク研究所ColloidsandInterfaces
Director ピーター・ジーバーガー(PeterSeeberger)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 基盤研究B「糖鎖の分子機作に基づくがん・COPD・アルツハイマー病の創薬開発(研究代表者:谷口直之)」、挑戦的萌芽研究「糖鎖とレドックスの融合による新規病態メカニズムの解明(研究代表者:谷口直之)」、医薬基盤研究所(NIBIO)先駆的医薬品・医療機器研究発掘支援事業「慢性閉塞性肺疾患(COPD)の増悪に対するグリコサミノグリカンを用いた新規治療法(研究代表者:谷口直之)」による支援を受けて行われました。
背景
慢性閉塞性肺疾患(COPD)は、気管支の炎症と肺気腫(肺胞の破壊)を伴う肺疾患です。COPDにかかると呼吸が苦しくなるとともに、ウイルスや細菌感染によって症状が急激に悪化(増悪)し、死亡率が上昇します。世界では死亡原因の4位を占めており注1)、その克服が重要な社会課題となっています。現在まで根本的な治療薬がなく、気管支の拡張剤などを使う対症療法が中心です。また、増悪時の強い炎症を抑えるためのステロイド薬は、その強い副作用が問題になっています。以上のことから新たな治療薬の開発が望まれています。
これまで谷口チームリーダーらは、糖鎖とCOPDに関する研究を行ってきました。糖鎖とは、グルコース(ブドウ糖)などの糖が鎖状につながった物質で、体内で遊離の状態で存在するものや、タンパク質や脂質に結合した状態のものがあります。糖鎖はさまざまな役割を果たしており、その構造や量の変化が、がん、糖尿病、アルツハイマー病などの疾患の原因の一つとなることが分かっています。
谷口チームリーダーらは、エラスターゼ[7]と呼ばれる酵素をマウスの肺に投与するとCOPD様の症状を呈すること、そこにさらにリポ多糖[8]を投与して炎症を誘発するとCOPD増悪様の症状を呈することなどを、CTによる解析などから明らかにしてきました注2)。さらに、肺に存在する糖鎖であるケラタン硫酸[9]が喫煙によって減少すること、ケラタン硫酸の一部である「L4」と呼ばれる二糖がCOPDやその増悪を抑えることをモデルマウスの解析から明らかにしました注3)。また、L4をCOPDモデルマウスに投与すると肺での炎症が抑えられたことから、L4は炎症を抑えることでCOPDの抑制効果を持つことが分かりました。これらのことから、糖鎖、特にケラタン硫酸やその一部であるL4が、COPDやその他の炎症性疾患の治療薬の候補となることが分かりました(図1)。
一方で、L4がなぜそのような炎症を抑える効果を発揮するのか、その仕組みはほとんど明らかになっていませんでした。さらに、糖や糖鎖は一般に受容体との親和性が低いことや、体内での代謝が早いことが知られており、その影響で体内での効果が低くなっている可能性が考えられました。
そこで、国際共同研究グループは、L4が体内でどのようなタンパク質に認識されて抗炎症作用を発揮しているのかを明らかにするため、L4の受容体の探索を試みました。
注1)WHO Health Statistics 2012
注2)Kobayashi et al., Am. J. Respir. Cell Mol. Biol., 49, 971-977 (2013).
注3)2017年1月5日プレスリリース「慢性閉塞性肺疾患を抑える糖鎖を発見」
研究手法と成果
免疫細胞[10]には、さまざまな糖鎖と結合して異物排除や炎症などの免疫反応に関わるC型レクチン[11]と呼ばれる一群のタンパク質が発現することが知られています。そこで国際共同研究グループは、L4に結合して抗炎症作用に関わるタンパク質を探索するため、免疫細胞上のC型レクチンに着目しました。その結果、樹状細胞という免疫細胞に存在する「ランジェリン」と呼ばれるC型レクチンが、L4と特異的に結合することが分かりました。また、ランジェリンはL4と似た構造を持つ二糖であるL1やL2(図1)とは結合しなかったことから、ガラクトースに硫酸が結合した構造を厳密に認識していることも分かりました。
L4がランジェリンと結合して作用を発揮すると考えられる一方で、一般的な糖鎖とタンパク質の間の結合と同様に、両者の結合の親和性は高くないことが分かりました。そこで、L4を複数個持つ分子(多量体)を新たに作製し、L4の作用を高めてみました。化学合成によって、分子内にL4を3個持つトライアングルL4(Tri-L4)と、約30個持つペンダントL4を作りました(図2A)。合成したTri-L4とペンダントL4を用いてランジェリンとの結合の強さ(親和性)を調べたところ、L4単独の1,000倍以上になっていることが分かりました(図2B)。
次に、ランジェリンを発現する樹状細胞とL4およびL4多量体との結合を調べました。その結果、L4ではほとんど結合が確認できない条件においても(図3A左)、ペンダントL4はランジェリン発現細胞と結合することが確認されました(図3A右)。さらに、ランジェリンがリガンド[3]と結合すると蛍光を発するレポーター細胞を用いた場合でも、L4ではほとんど蛍光が観察されないのに対し、ペンダントL4はほとんどの細胞で蛍光が観察され、ペンダントL4とランジェリンが生きた細胞膜上で結合することが分かりました(図3B、C)。
最後に、COPDモデルマウスにL4多量体を投与し、炎症抑制効果を調べました。ペンダントは分子量が不均一で効果にばらつきがあったため、Tri-L4のみを試しました。エラスターゼを投与したモデルマウスの肺にL4もしくはTri-L4を投与したのち、肺に集まってくる炎症細胞の個数で炎症度合いを調べたところ、Tri-L4は、L4と同等もしくはそれ以上の抗炎症効果があることが分かりました(図4)。
今後の期待
本研究により、L4とランジェリンとの結合はL4を多量体化することで著しく強まること、またL4多量体はCOPDモデルマウスの肺で炎症を抑えることが分かりました。このことから、L4多量体はCOPDをはじめとする炎症性疾患に有効な薬剤候補となる可能性が示されました。
ランジェリンを発現する樹状細胞は、乾癬(かんせん)などの炎症性皮膚疾患との関連性も報告されており、L4およびその誘導体は、COPDだけでなく皮膚や粘膜の炎症、感染症などにも有効である可能性が考えられます。
原論文情報
Fumi Ota, Tetsuya Hirayama, Yasuhiko Kizuka, Yoshiki Yamaguchi, Reiko Fujinawa, Masahiro Nagata, Hendra S. Ismanto, Bernd Lepenies, Jonas Aretz, Christoph Rademacher, Peter H. Seeberger, Takashi Angata, Shinobu Kitazume, Keiichi Yoshida, Tomoko Betsuyaku, Kozui Kida, Sho Yamasaki, Naoyuki Taniguchi, “High affinity sugar ligands of C-type lectin receptor langerin”, Biochimica et Biophysica Acta – General Subjects, 10.1016/j.bbagen.2018.04.004
発表者
理化学研究所
開拓研究本部 主任研究員研究室 伊藤細胞制御化学研究室
研究員 山口 芳樹(やまぐち よしき)
(グローバル研究クラスタ 糖鎖構造生物学研究チーム チームリーダー(研究当時))
グローバル研究クラスタ 疾患糖鎖研究チーム(研究当時)
研究員 木塚 康彦(きづか やすひこ)
(現 岐阜大学 生命の鎖統合研究センター 准教授)
テクニカルスタッフ 太田 芙美(おおた ふみ)
チームリーダー 谷口 直之(たにぐち なおゆき)
(現 大阪国際がんセンター研究所 プロジェクトリーダー)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 慢性閉塞性肺疾患(COPD)
- 肺気腫や慢性気管支炎の総称。気道の閉塞による呼吸困難を引き起こす。世界保健機関(WHO)によれば、2030年までに世界の死亡原因の3位を占めるようになると推定されている。COPDはChronic Obstructive Pulmonary Diseaseの略。
-
- 二糖
- 二つの糖がつながった化合物。グルコース(ブドウ糖)とグルコースがつながったマルトース、グルコースとガラクトースがつながったラクトース(乳糖)、グルコースとフルクトースがつながったスクロース(ショ糖)などがある。L4も二糖の一種。
-
- 受容体、リガンド
- 細胞の表面や内部に存在し、細胞外からやってくる分子と特異的に結合してシグナルを伝えるタンパク質。レセプターとも呼ばれる。受容体と結合して情報を伝える分子をリガンドと呼ぶ。
-
- ランジェリン
- 樹状細胞に主に発現するC型レクチンで、糖鎖と結合する。HIVや真菌などの病原体と結合し、それらを排除する働きがあるといわれている。COPDだけでなく、乾癬などの炎症性皮膚疾患などとの関わりも報告されている。
-
- 樹状細胞
- 免疫細胞の一種。多数の突起を伸ばした形状をしており、皮膚をはじめさまざまな組織に存在する。異物を取り込み、その一部を抗原としてT細胞に提示することで、排除すべき異物に対する情報を伝える。
-
- 多量体
- 同種の分子(単量体)が複数連なったもの。
-
- エラスターゼ
- タンパク質を分解するプロテアーゼ(酵素)の一種。膵臓から多く分泌される。好中球にも含まれ、異物の分解や、組織の再生や合成の調節に使われる。本研究では、ブタ膵臓由来のエラスターゼを使用した。
-
- リポ多糖(LPS)
- リポポリサッカライドとも呼ばれる。グラム陰性細菌の細胞壁に含まれる成分。免疫系の細胞に作用して炎症を引き起こすなど、さまざまな生理作用がある。LPSはLipopolysaccharideの略。
-
- ケラタン硫酸
- タンパク質に結合した糖鎖の一つ。硫酸を持った二糖が繰り返し鎖状につながった構造を持つ。神経系では軸索の再生や、神経変性疾患などに関わることが知られている。L4はケラタン硫酸のもとになる硫酸化された二糖の一種である。
-
- 免疫細胞
- 免疫に関わる細胞。非自己を認識して排除する。マクロファージや樹状細胞など、異物を取り込んで抗原の情報を伝えるものや、抗体産生や細胞を攻撃するリンパ球がある。リンパ球はさらに、B細胞、T細胞、NK細胞など役割により細かく分類される。
-
- C型レクチン
- 糖もしくは糖鎖と結合する性質を持つタンパク質をレクチンと呼び、植物や動物の体内に存在している。C型レクチンは、糖鎖との結合にカルシウムを要するレクチンのことで、その多くは免疫細胞に発現し、異物の排除に関わっている。
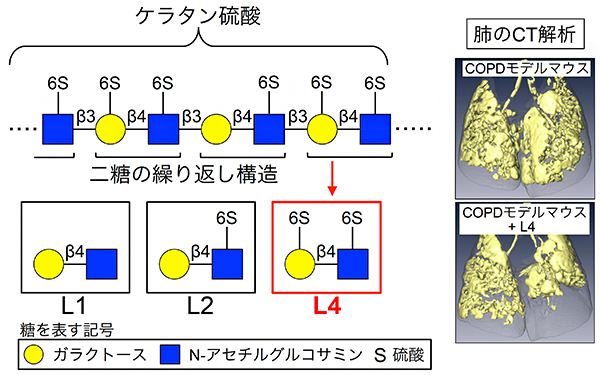
図1 L4の構造と肺気腫抑制作用
左: ケラタン硫酸は糖鎖の一種で、二糖が繰り返しつながった構造を持つ。二糖を構成するガラクトースとN-アセチルグルコサミンは、6位の水酸基に硫酸が付く場合(6S)と付かない場合がある。二つの糖が両方硫酸化された二糖を「L4」と呼ぶ。β3、β4は、糖と糖がどの位置の水酸基を介してつながるかという結合の仕方を表す。
右: COPDモデルマウスとL4を投与したCOPDモデルマウスの肺のCTスキャンの画像。黄色は肺胞が壊れて肺気腫が生じた領域。L4の投与により、肺胞の破壊が抑えられたことが分かる(下図)。
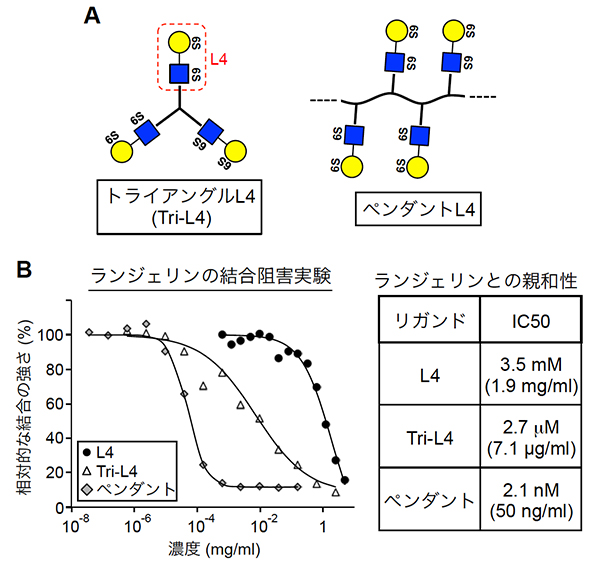
図2 L4の多量体化とランジェリンへの親和性増大
A:L4の多量体型の構造。トライアングルL4(Tri-L4)は、分子内に3個のL4を持つ。ペンダントL4はL4のポリマーで、分子内に約30個のL4を持つ。
B:L4、Tri-L4、ペンダントL4とランジェリンとの結合の強さを競合的ELISA法で調べた。左は、ランジェリンがL4などの存在によって他の糖鎖と結合できなくなる濃度を調べた実験。これによりランジェリンとの親和性が測定できる。右は、その実験によって測定したランジェリンとの結合親和性を表しており、Tri-L4はL4単独の1,000倍以上、ペンダントL4は10万倍以上であることが分かる。
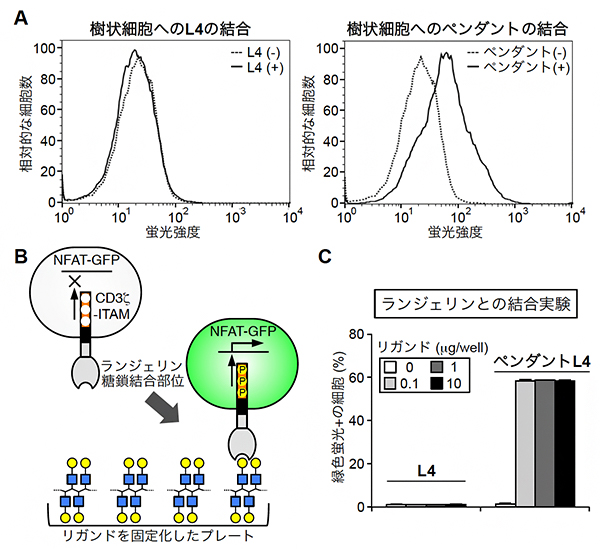
図3 ペンダントL4と細胞表面のランジェリンとの結合
A:ランジェリンを発現するマウス骨髄由来の樹状細胞をL4もしくはペンダントL4と混合し、結合するかをフローサイトメトリーによって調べた。横軸は結合の強さを表し、縦軸は細胞数を表す。破線はL4やペンダントを加えていない、陰性コントロール。実線が破線より右にシフトすれば、加えた化合物と細胞が結合していると分かる。
B:ランジェリンと糖鎖が結合すると緑に光る細胞の仕組み。ランジェリンの糖鎖結合部位に、CD3ζのITAMと呼ばれる領域を融合したタンパク質を細胞に発現させた。ランジェリンが糖鎖(リガンド)と結合すると、ITAMが活性化されて細胞内にシグナルが伝わり、GFP(緑色蛍光タンパク質)の遺伝子がオンになり蛍光を発する。
C:L4とペンダントL4でBの細胞を刺激したとき、蛍光を発した細胞の割合を表す。L4の刺激では、最も高濃度の10μgを用いても細胞は蛍光を発しないが、ペンダントL4の刺激では、0.1μg低濃度のリガンド刺激においても、ほとんどの細胞が蛍光を発していることが分かる。
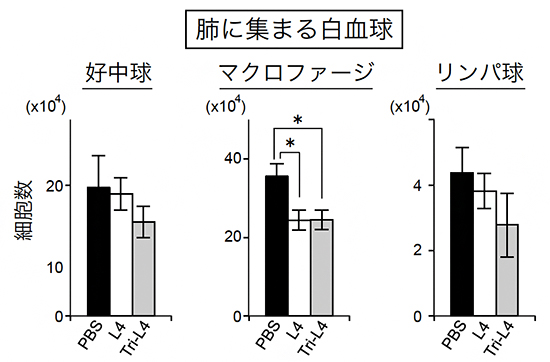
図4 Tri-L4によるCOPDモデルマウスの炎症抑制
気管支肺胞洗浄液の中に含まれる白血球の数。肺の炎症の指標となる。COPDモデルマウスでは、炎症が起きているため正常マウスより好中球やマクロファージなどの白血球が多い。しかしL4やTri-L4の投与により、これらの白血球の肺への集積が抑えられ、炎症が抑えられた。好中球やリンパ球では、Tri-L4の炎症抑制効果はL4より強い傾向にあることが分かる。PBSはリン酸緩衝生理食塩水でコントロールの役割を果たす。