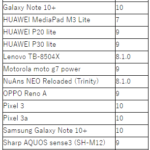
2020-06-19 熊本大学,東京大学,日本医療研究開発機構
ポイント
- 統合失調症患者および双極性障害患者において、神経伝達物質の伝達量を調節するセロトニントランスポーター遺伝子にDNAメチル化※1変化が起きていることを、末梢血の解析で確認しました。
- これらの疾患におけるDNAメチル化の変化は、性別および遺伝子のタイプ(遺伝子多型)と有意に関連し、高メチル化は脳の扁桃体体積と逆相関を示しました。
- セロトニントランスポーターのエピジェネティックな状態を標的とした精神疾患治療薬や診断マーカーの開発が期待されます。
概要説明
熊本大学大学院生命科学研究部分子脳科学講座・文東美紀准教授、岩本和也教授および東京大学医学部附属病院精神神経科・池亀天平助教、笠井清登教授らの研究グループは、国内多施設共同研究により、統合失調症や双極性障害患者の血液では、セロトニントランスポーター遺伝子の特定のゲノム領域が高いメチル化状態を示すことを明らかにしました。また、高いメチル化状態は男性およびセロトニントランスポーター遺伝子のプロモーター領域※2における低活性型の遺伝子多型を持つ患者で顕著に見られ、脳の扁桃体※3の体積と逆相関することを見出しました。さらに、人工的にメチル化した遺伝子のゲノム領域では、転写活性がほぼ完全に抑制されることを示しました。
セロトニントランスポーターは、脳神経細胞のシナプス間隙で神経伝達物資セロトニン濃度の調節を行っており、抗うつ薬の主要な標的分子であると考えられています。今回、研究グループは、セロトニントランスポーター遺伝子のプロモーター領域における遺伝子多型である5-HTTLPRが、エピジェネティックな状態であるDNAメチル化状態と関連し扁桃体の形態変化を通して精神疾患の病態に関係している可能性を明らかにしました。
本成果により、統合失調症や双極性障害の病態に関する理解が進み、エピジェネティックな状態を標的とした治療薬や診断・治療マーカーの開発など、多方面での応用が期待されます。
本研究成果は、令和2年6月19日付(日本時間)の国際科学誌「Schizophrenia Bulletin」において公開されます。
背景
統合失調症や双極性障害は、人口の約1%が罹患し長期間の治療が必要とされる重篤な精神疾患です。過去の疫学研究から、発症には遺伝要因と環境要因の複雑な相互作用が関係していると考えられていますが、確実な遺伝要因は同定されていません。
近年、「エピジェネティクス」という現象を通して、環境要因により遺伝子の働き(発現)が変化することが注目されています。エピジェネティクスは「遺伝子の塩基配列(設計図)の変化を伴わずに、子孫や娘細胞に伝達される遺伝子発現調節機構」と定義され、DNAメチル化などの化学修飾により遺伝子の発現が制御されています。
本研究グループは、過去に双極性障害患者でのDNAメチル化解析により、セロトニントランスポーター遺伝子内の2つの特定の部位(CpG3およびCpG4)(図1A)が高いメチル化状態を示すことを報告しました(菅原ら, Transl Psychiatry 2011)。本研究では、過去に同定したこのCpG部位について大規模な追試実験を行い、また、新たに統合失調症患者での検討も行い、セロトニントランスポーター遺伝子のDNAメチル化が病態に与える影響について、包括的な検討を行いました。
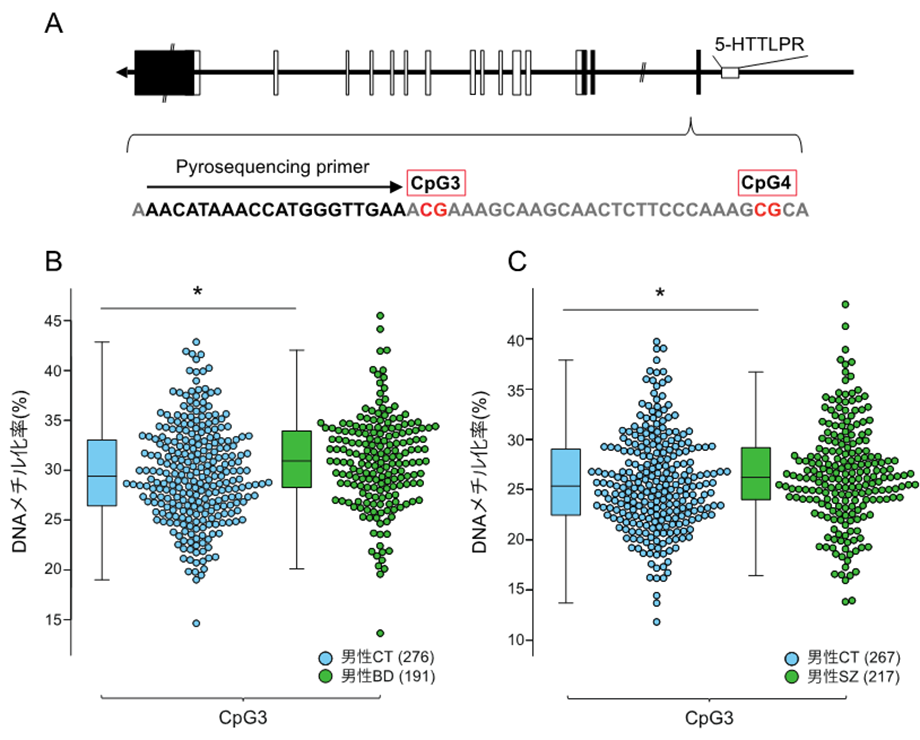 図1:セロトニントランスポーター遺伝子のDNAメチル化変化A)セロトニントランスポーター遺伝子の構造とメチル化解析を行ったCpG部位。図中、転写は右から左に行われプロモーター領域に5-HTTLPR多型が存在する。ボックスはエクソン領域を示し、黒は蛋白質をコードしていない部分、白は蛋白質をコードしているエクソン領域を示す。 B)男性双極性障害患者(男性BD)と男性健常者(男性CT)のCpG3におけるメチル化比較 C)男性統合失調症患者(男性SZ)と男性CTのCpG3におけるメチル化比較 *P<0.05(マン・ホイットニーのU検定)
図1:セロトニントランスポーター遺伝子のDNAメチル化変化A)セロトニントランスポーター遺伝子の構造とメチル化解析を行ったCpG部位。図中、転写は右から左に行われプロモーター領域に5-HTTLPR多型が存在する。ボックスはエクソン領域を示し、黒は蛋白質をコードしていない部分、白は蛋白質をコードしているエクソン領域を示す。 B)男性双極性障害患者(男性BD)と男性健常者(男性CT)のCpG3におけるメチル化比較 C)男性統合失調症患者(男性SZ)と男性CTのCpG3におけるメチル化比較 *P<0.05(マン・ホイットニーのU検定)
セロトニントランスポーターは、神経伝達物質をやりとりするシナプス間隙において神経伝達物質セロトニンの濃度調節を行っている蛋白質です。セロトニントランスポーターを標的とした薬剤は、抗うつ薬として広くうつ病や不安障害の治療に用いられており、精神疾患の病態に深く関わる分子の一つと考えられています。また、この遺伝子のプロモーター領域には、5-HTTLPRと呼ばれる遺伝子多型があり、うつ病をはじめとした精神疾患との関連解析が多数行われてきました。多型のタイプがL(long)型である場合、遺伝子の働きが強くなり多くのセロトニントランスポーターが産生され、S(short)型である場合は少なく産生されます。人は大まかにこの2種類の組み合わせであるL/L、S/L、S/Sのいずれかの型を持ちます。解析の結果、S型を持つと不安傾向が強く、よりうつ病に罹患しやすいとされ、大きな話題となりました(Capsiら、Science 2003)。しかし、近年の大規模な研究により精査され、5-HTTLPRの遺伝子多型と精神疾患の単純な関係は明確に否定されています。
研究の内容及び成果
双極性障害患者450例、統合失調症患者440例、健常者460例について、血液(末梢血)から抽出したゲノムDNAを用いて、セロトニントランスポーター遺伝子のDNAメチル化状態を測定しました。その結果、双極性障害患者および統合失調症患者のセロトニントランスポーターCpG3部位について、男性患者において高メチル化状態にあることを確認しました(図1B・C)。なお、小型の霊長類であるマーモセットに、抗精神病薬を長期投与し、そのセロトニントランスポーター遺伝子のDNAメチル化状態を測定したところ、メチル化変化は検出されなかったことから、双極性障害患者および統合失調症患者におけるメチル化変化は、投薬の影響を受けたものではないことが推定されます。
また、セロトニントランスポーター遺伝子のプロモーター領域における遺伝子多型5-HTTLPRの詳細な解析を行ったところ、双極性障害患者および統合失調症患者において5-HTTLPRが低活性型である場合、高メチル化を示すことを確認しました。なお、多型のタイプが日本人特有のL型であるL16-Cである場合、低活性型であることを確認しました。
次に、セロトニントランスポーター遺伝子のCpG3部位を人工的にメチル化し転写活性化能を測定したところ、メチル化したセロトニントランスポーター遺伝子では、転写活性化能が著しく抑制され、セロトニントランスポーター蛋白質の生成が抑制されることを見出しました(図2B)。
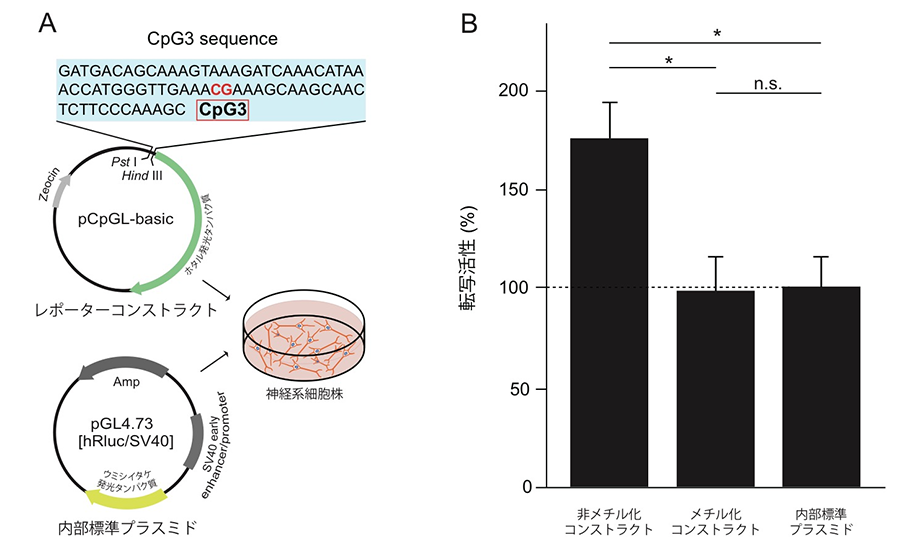 図2:レポーターアッセイによるCpG3メチル化の機能的解析A)CpG部位を人工的にメチル化させ蛍光標識したDNA鎖(レポーターコンストラクト)を神経系細胞株に導入して、発光蛋白質の活性を測定することにより転写活性化能を測定。 B)メチル化されると転写活性化能は失われる。
図2:レポーターアッセイによるCpG3メチル化の機能的解析A)CpG部位を人工的にメチル化させ蛍光標識したDNA鎖(レポーターコンストラクト)を神経系細胞株に導入して、発光蛋白質の活性を測定することにより転写活性化能を測定。 B)メチル化されると転写活性化能は失われる。
さらに、年齢・性別を適合させた健常者41例、統合失調症患者 57例について、セロトニントランスポーターの働きが強く、過去にDNAメチル化状態との関連が報告されている扁桃体についてMRI脳画像を用いた解析を行いました。その結果、低活性型5-HTTLPRを持つ男性患者の左扁桃体の体積と、CpG3のDNAメチル化率が逆相関を示すことを見出しました(図3)。
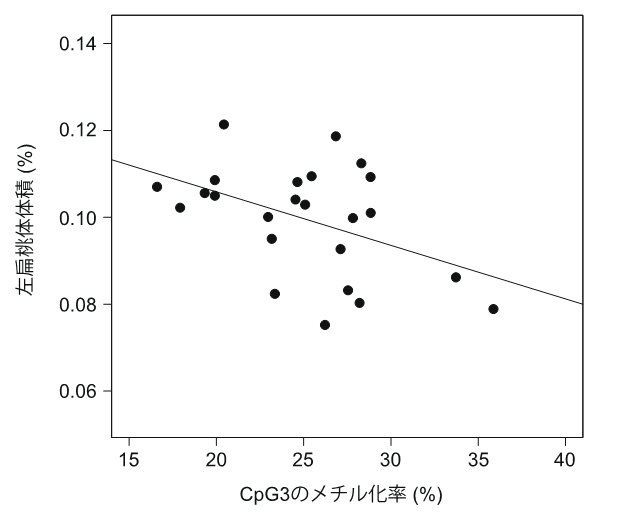
図3:CpG3のDNAメチル化率と左扁桃体体積の関連低活性型5-HTTLPRを持つ統合失調症患者では左扁桃体の体積とCpG3のメチル化率が有意に逆相関する。 縦軸:全脳に対する左扁桃体体積の割合(%) 横軸:CpG3のメチル化率(%)
以上のことから、低活性型5-HTTLPRを持つ男性統合失調症患者では、セロトニントランスポーターが高メチル化状態にあり、セロトニントランスポーター量の低下を通して扁桃体体積の減少が生じている可能性が示唆されました。
今後の展開
本研究によりセロトニントランスポーター遺伝子の特定の部位は、統合失調症や双極性障害の男性患者において高メチル化状態にあり、扁桃体の体積変化と関連していることが示されました。今後、発症予測や診断、治療効果判定などのバイオマーカーとしての応用が期待されるとともに、分子病態の解明の糸口になると考えられます。
用語解説
- ※1 DNA メチル化
- シトシン塩基とグアニン塩基が連続しているCpG 配列と呼ばれる部位のシトシン塩基の炭素にメチル基(-CH3)が付加されている状態。主に遺伝子の発現を抑制する方向に働く。
- ※2 プロモーター領域
- DNA上で、蛋白質生成に必要なRNAへの「転写」が開始される領域。
- ※3 扁桃体
- 両側側頭葉内側に存在する神経細胞の集合体。不安や恐怖といった情動反応において主要な役割を担う脳領域。
論文情報
- 論文名:
- Promoter activity-based case-control association study on SLC6A4 highlighting hypermethylation and altered amygdala volume in male patients with schizophrenia
- 著者:
- Tempei Ikegame†, Miki Bundo†, Naohiro Okada, Yui Murata, Shinsuke Koike, Hiroko Sugawara, Takeo Saito, Masashi Ikeda, Keiho Owada, Masaki Fukunaga, Fumio Yamashita, Daisuke Koshiyama, Tatsunobu Natsubori, Norichika Iwashiro, Tatsuro Asai, Akane Yoshikawa, Fumichika Nishimura, Yoshiya Kawamura, Jun Ishigooka, Chihiro Kakiuchi, Tsukasa Sasaki, Osamu Abe, Ryota Hashimoto, Nakao Iwata, Hidenori Yamasue, Tadafumi Kato, Kiyoto Kasai, Kazuya Iwamoto*
- (†同等貢献、*責任著者)
- 掲載誌:
- Schizophrenia Bulletin
共同研究グループ
池亀天平 (東京大学医学部附属病院精神神経科)
文東美紀 (熊本大学大学院生命科学研究部分子脳科学講座、JST さきがけ)
岡田直大 (東京大学ニューロインテリジェンス国際研究機構(IRCN))
村田唯 (熊本大学大学院生命科学研究部分子脳科学講座)
小池進介 (東京大学大学院総合文化研究科進化認知科学研究センター)
菅原裕子 (熊本大学大学院生命科学研究部神経精神医学講座)
齋藤竹生 (藤田医科大学医学部精神神経科学)
池田匡志 (藤田医科大学医学部精神神経科学)
大和田啓峰 (東京大学医学部附属病院小児科)
福永雅喜 (自然科学研究機構生理学研究所心理生理学研究部門)
山下典生 (岩手医科大学医歯薬総合研究所)
越山太輔 (東京大学医学部附属病院精神神経科)
夏堀龍暢 (東京大学医学部附属病院精神神経科)
岩白訓周 (東京大学医学部附属病院精神神経科)
浅井竜朗 (東京大学医学部附属病院精神神経科)
吉川茜 (東京都医学総合研究所統合失調症プロジェクト)
西村文親 (東京大学医学部附属病院精神神経科)
河村代志也 (医療法人社団ハートフル川崎病院)
石郷岡純 (CNS 薬理研究所)
垣内千尋 (東京大学医学部附属病院精神神経科)
佐々木司 (東京大学大学院教育学研究科健康教育学)
阿部修 (東京大学医学部附属病院放射線科)
橋本亮太 (国立精神・神経医療研究センター精神保健研究所精神疾患病態研究部)
岩田仲生 (藤田医科大学医学部精神神経科学)
山末英典 (浜松医科大学医学部精神医学講座)
加藤忠史 (理化学研究所脳神経科学研究所精神疾患動態研究チーム)
笠井清登 (東京大学医学部附属病院精神神経科、東京大学ニューロインテリジェンス国際研究機構(IRCN))
岩本和也 (熊本大学大学院生命科学研究部分子脳科学講座)
発表者
池亀天平 (東京大学医学部附属病院精神神経科助教)
文東美紀 (熊本大学大学院生命科学研究部分子脳科学講座准教授)
笠井清登 (東京大学医学部附属病院精神神経科教授)
岩本和也 (熊本大学大学院生命科学研究部分子脳科学講座教授)
研究支援
- 科学研究費補助金新学術領域研究
- 「マルチスケール精神病態の構成的理解」
「脳・生活・人生の統合的理解にもとづく思春期からの主体価値発展学」
- 国立研究開発法人日本医療研究開発機構 (AMED)
- 脳科学研究戦略推進プログラム(「臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」)、「革新的技術による脳機能ネットワークの全容解明プロジェクト(革新脳)」などの助成を受けて行われました。
お問い合わせ先
熊本大学大学院生命科学研究部
分子脳科学講座
担当:岩本和也(いわもと かずや)
東京大学医学部附属病院
精神神経科
担当:池亀天平(いけがめ てんぺい)
AMED事業について
日本医療研究開発機構
疾患基礎研究事業部・疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
脳科学研究戦略推進プログラム