2020-09-30 慶應義塾大学医学部,日本医療研究開発機構
慶應義塾大学医学部医化学教室の津川仁専任講師、加部泰明准教授、末松誠教授らのグループは、腸内細菌が産生する短鎖脂肪酸類の新規の受容体タンパク質ASCの同定に成功し、これを介した自然免疫賦活作用により、食中毒の原因となるサルモネラ菌感染に対する防御効果が示されることを発見しました。
短鎖脂肪酸類は食物繊維が腸内細菌で代謝されることにより大量に産生され、さまざまな免疫応答調節に関わることが知られていますが、その詳しい作用機構は分かっていませんでした。本研究では独自の薬剤受容体探索技術を用いて、短鎖脂肪酸に特異的に結合するヒト由来の受容体apoptosis-associated speck-like protein(ASC)の同定に成功しました。ASCはインフラマソーム複合体(注1)のアダプタータンパク質(注2)として働くことが知られています。今回、同グループは、短鎖脂肪酸類がASCのインフラマソーム形成能を活性化することにより免疫担当細胞であるマクロファージなどの自然免疫能を亢進することを解明しました。また、このような免疫賦活化効果は食中毒の要因となるサルモネラ菌の感染防御に寄与することを見出し、腸内で分解されて大量に短鎖脂肪酸類を産生する水溶性の食物繊維の摂取により、サルモネラ菌感染マウスの生存を大幅に延長することを解明しました。これらの知見は短鎖脂肪酸がインフラマソーム活性化を介してサルモネラ感染を抑制する新たな制御機構を明らかにしたものであり、食物繊維などの短鎖脂肪酸類を生成する成分の摂取による病原菌感染防御のための新たな治療・予防法の開発につながることが期待されます。
本研究成果は、2020年9月29日(太平洋夏時間)に科学誌『PLoS Biology』のオンライン速報版で公開されました。
研究の背景
炭素鎖が非常に短いプロピオン酸や酪酸は短鎖脂肪酸類と呼ばれ、食物繊維を腸内細菌が発酵させることにより、腸内で大量に産生されることが知られています。腸内で産生された短鎖脂肪酸類は、さまざまな免疫応答調節に寄与することが知られていますが、その分子メカニズムには不明な点が多く残されていました。本研究では、マクロファージ様細胞株から短鎖脂肪酸類の受容体タンパク質の探索を行い、これを介した免疫賦活化効果について実証しました。
研究の内容
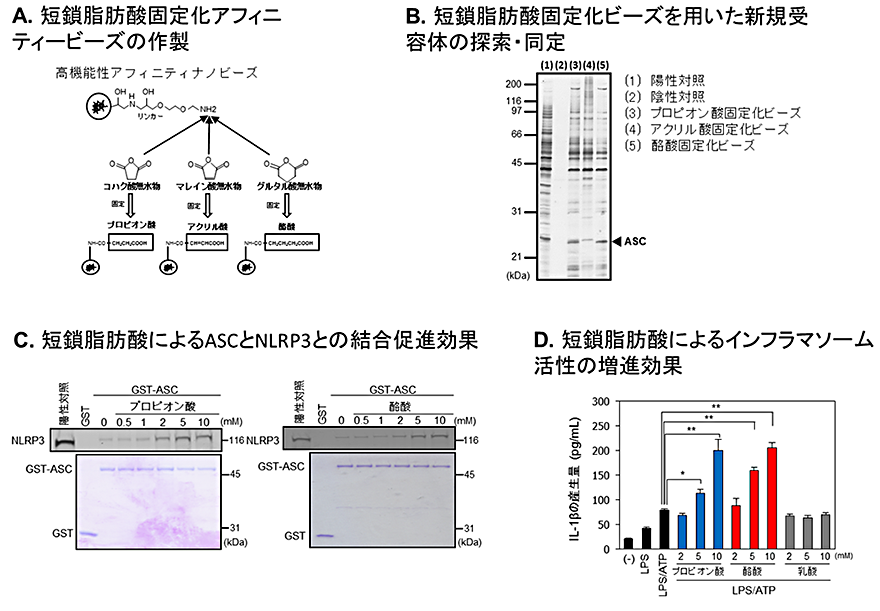
本研究グループはまず高機能性アフィニティナノビーズ(注3)を用いて、プロピオン酸および酪酸の構造を保持した固定化ビーズを作成し(図1A)、免疫担当細胞であるマクロファージ様細胞株U937細胞のタンパク質抽出液から短鎖脂肪酸類に特異的に結合するタンパク質群の精製を行いました(図1B)。この結果、25kDa付近にプロピオン酸および酪酸固定化ビーズ選択的に結合するタンパク質が見られ、これを質量分析法によって解析したところ、外部異物に対する免疫応答を活性化するインフラマソーム複合体のアダプタータンパク質apoptosis-associated speck-like protein(ASC)と同定されました。インフラマソーム複合体は免疫担当細胞内で異物などの外部刺激に応答して、アダプタータンパク質であるASCのPYRIN領域を介して複合体を形成し、caspase-1を活性化させることにより、インターロイキン1β(IL-1β)などの炎症性サイトカインの産生を亢進させ、細胞死を誘導することが知られています。そこで、ASCの働きに対する短鎖脂肪酸類の作用を解析した結果、インフラマソーム複合体の構成タンパク質であるNLRP3とASCの結合活性が、プロピオン酸または酪酸添加により顕著に増強することが明らかになりました(図1C)。また、エンドトキシン(LPS)刺激とATP刺激によりインフラマソームを活性化した際のIL-1β産生量を検証した結果、ASCと結合しない乳酸の添加では効果が見られませんでしたが、プロピオン酸および酪酸添加によりIL-1β産生が顕著に亢進することを見出しました(図1D)。これらの結果から、短鎖脂肪酸類がASCと結合することによりインフラマソーム複合体の形成を亢進してIL-1β産生増強などの自然免疫の賦活化に寄与することが明らかになりました。
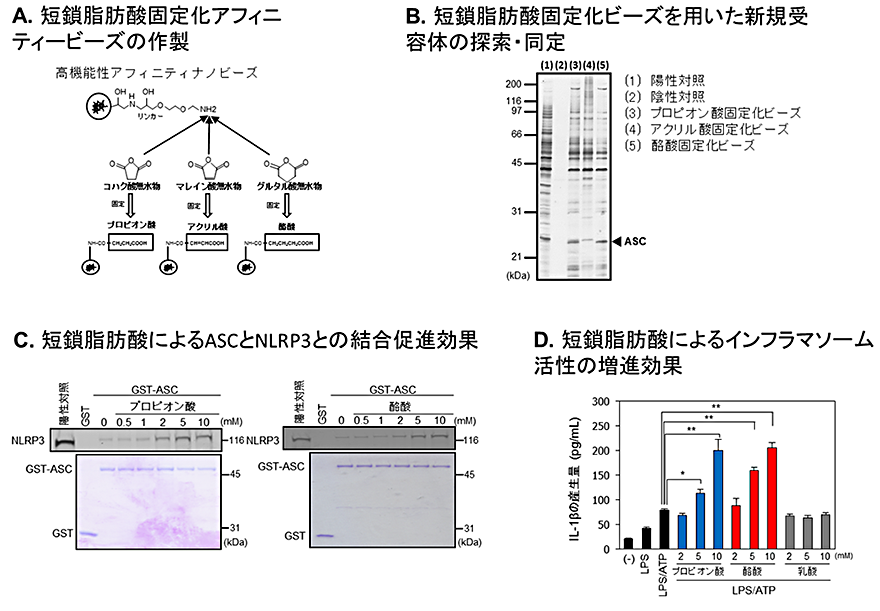
B.短鎖脂肪酸固定化ビーズを用いた新規受容体ASCの精製・同定
C.短鎖脂肪酸によるインフラマソーム複合体ASCとNLRP3の結合活性の増強効果
D.短鎖脂肪酸類によるIL-1β産生増加(インフラマソーム活性の増進)効果
食中毒の原因としてよく知られるサルモネラ菌は、腸内でマクロファージ内に感染して腸管バリアを突破して血流に入ることにより全身性のショックなど重篤な症状を引き起こすことが知られています。インフラマソーム経路の活性化はこのようなサルモネラ菌の感染を抑制することが知られているため、短鎖脂肪酸類による感染抑制の効果を検証しました。図2Aに示したように、マウスの初代培養系マクロファージにおけるサルモネラ菌の感染・生育は、乳酸添加では全く効果は見られませんでしたが、プロピオン酸または酪酸添加により顕著に抑制されることが明らかになりました。さらに、この抑制効果はASC欠損マクロファージでは見られなかったことから、短鎖脂肪酸類はASCを介したインフラマソーム活性化によりマクロファージ内のサルモネラ菌除去を亢進することが示唆されました。また、マウスのサルモネラ菌感染モデルにおいても、短鎖脂肪酸類投与によりサルモネラ菌による致死性が顕著に改善され、また、ASC欠損マウスではこのような効果は観察されませんでした(図2B)。水溶性食物繊維は、腸内で分解されて大量に短鎖脂肪酸類を産生することが知られています。そこで、サルモネラ菌感染モデルにおいて、グアガム(注4)由来の水溶性食物繊維(PHGG:太陽化学㈱供与)を投与したところ、サルモネラ菌による致死性が顕著に改善されることが明らかになりました(図2C)。
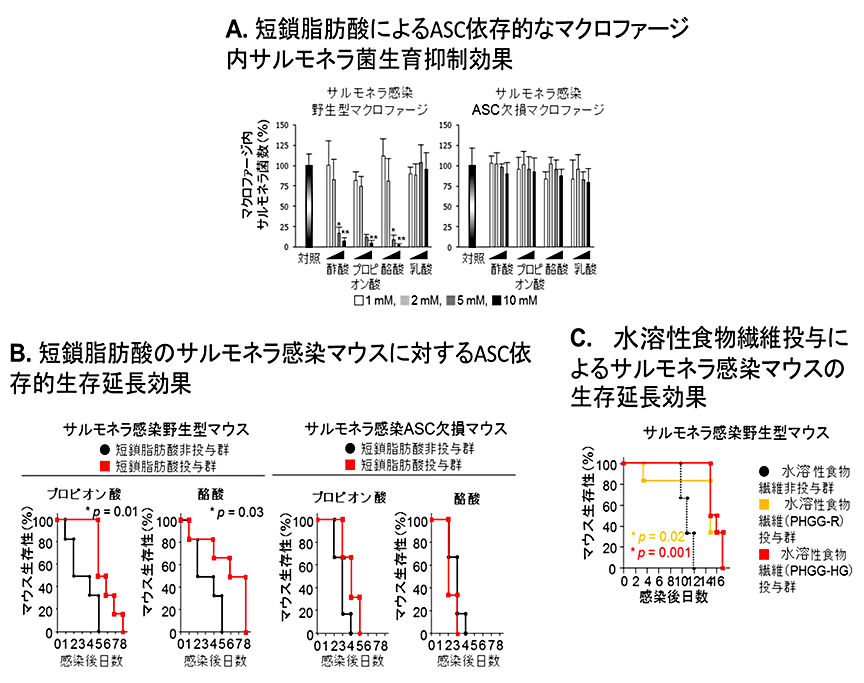
B.短鎖脂肪酸投与によるサルモネラ菌感染によるASC依存的なマウス生存延長効果
C.水溶性食物繊維投与によるサルモネラ菌感染によるマウス生存延長効果
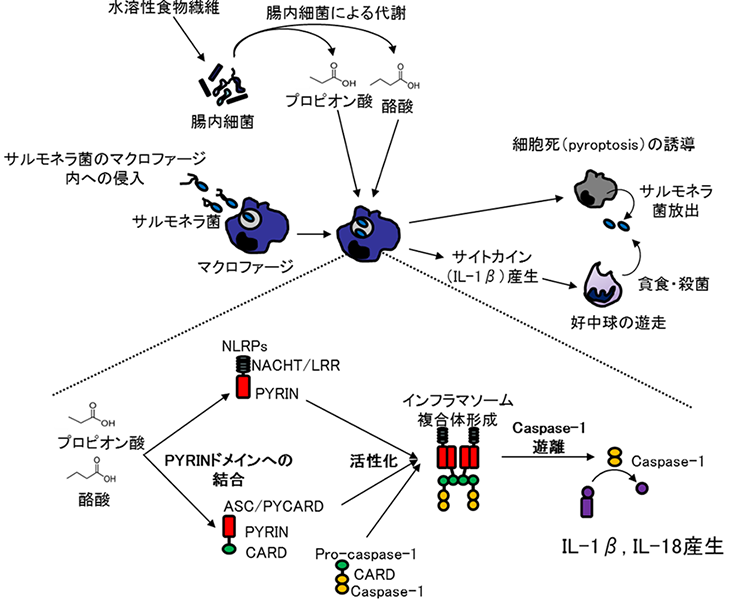
以上の結果から、短鎖脂肪酸類はASCと結合して活性化し、インフラマソーム複合体の形成を促進することにより自然免疫能を賦活化することが明らかになりました。また、インフラマソームの活性化はサルモネラ菌に感染したマクロファージのプログラム死(pyroptosis)(注5)を誘導して、マクロファージに侵入したサルモネラ菌を除去するとともに、IL-1βやIL-18などのサイトカイン産生を増強することにより好中球などを活性化してサルモネラ菌の殺菌効果を増強することが示唆されました(図3)。
研究の意義・今後の展開
本研究の知見は、これまで未知であった短鎖脂肪酸類の免疫賦活化作用の分子メカニズムを明らかにしたものであり、腸内で短鎖脂肪酸類を産生する水溶性食物繊維による食中毒感染の新たな治療・予防システムの構築につながる可能性が期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)「代謝システム制御分子の系統的探索による治療戦略創出と創薬展開」(研究開発代表者:加部泰明)(謝辞番号:JP19gm0710010)、農林水産省「医福食農連携推進環境整備事業」および国立研究開発法人科学技術振興機構戦略的創造研究推進事業(JST-ERATO、末松ガスバイオロジープロジェクト)の支援により行われました。末松教授は、本研究に関してAMEDの研究費を受給しておりません。
論文
- 英文タイトル
- Short-chain fatty acids bind to apoptosis-associated speck-like protein to activate inflammasome complex to prevent Salmonella infection
- タイトル和訳
- 短鎖脂肪酸類はASCと結合してインフラマソーム複合体を活性化することによりサルモネラ菌感染を防御する
- 著者名
- 津川仁、加部泰明、金井彩香、杉浦悠毅、津川仁、肥田重明、谷口俊一郎、高橋俊雄、松井英則、安川然太、伊藤裕之、田久保圭誉、鈴木秀和、本田賢也、半田宏、末松誠
- 掲載誌
- PLoS Biology(オンライン速報版)
- DOI
- 10.1371/journal.pbio.3000813
用語解説
- (注1)インフラマソーム
- 細胞内の病原菌などの異物をNOD-like receptors(NLRs)に分類されるNLRP1、NLRP3、NLRP6などを介して宿主細胞に対する異物刺激として認識し、シグナル伝達分子apoptosis-associated speck-like protein containing a CARD(ASC)を介して複合体を形成し、非活性型のprocaspase-1を活性型のcaspase-1に変換して、サイトカイン類IL-1βやIL-18の活性化により異物排除の応答に機能する。
- (注2)アダプタータンパク質
- シグナル伝達に関与するタンパク質の一種で、酵素活性などの機能は示さないが、他のタンパク質との結合を介して活性化に寄与する因子。
- (注3)アフィニティナノビーズ
- 100ナノメーターサイズの微小で均一な粒子で、タンパク質などへの非特異吸着が極めて低く、粒子表面上にケミカル(薬剤)などの目的のリガンドを固定化する事により、親和性(アフィニティ)を利用して薬剤に選択的に結合する受容体タンパク質の精製が可能である。
- (注4)グアガム
- グアー豆由来の多糖成分でマンノースを含む特異な多糖を含んでいる。
- (注5)pyroptosis
- プログラムされた細胞死の一種で、サルモネラ菌などに感染した細胞内で活性化されたカスパーゼ-1にIL-1βやIL-18等の炎症性サイトカインの誘発および細胞死が引き起こされる。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 医化学教室
准教授 加部泰明(かべやすあき)
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課:山崎・飯塚
AMEDに関すること
国立研究開発法人日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課