2020-10-10 精神・神経医療研究センター
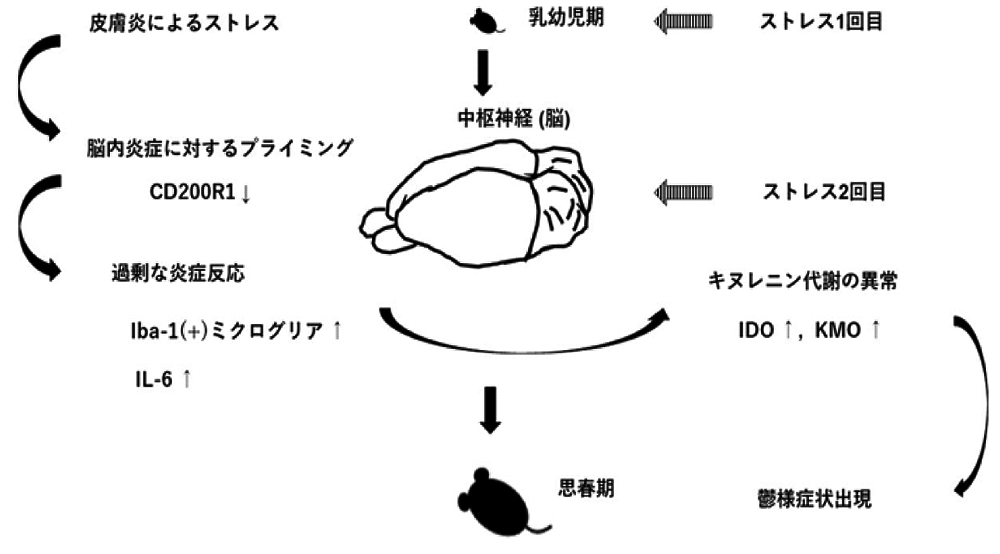
国立研究開発法人国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第4部の橋本興人研究員らは、幼少期のアトピー性皮膚炎によるストレスが脳内炎症反応の応答性増大持続を促し、これが思春期のうつ様症状誘導の原因となる可能性を示しました(図1)。
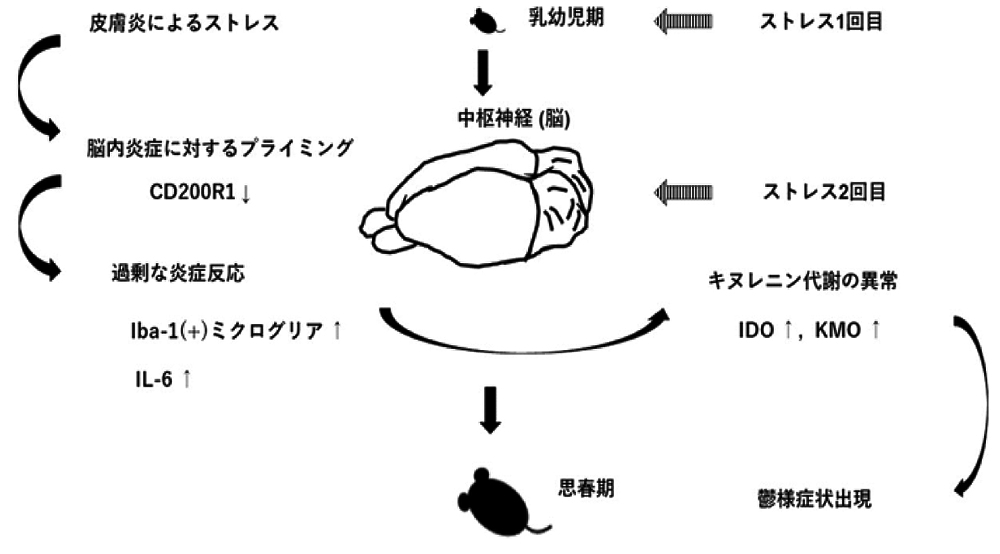
【図1】幼少期のアトピー性皮膚炎によるストレスにより脳内炎症に対する感受性が高まり思春期での追加のストレスにより鬱様症状が出現する機構を解明
幼少期のアトピー性皮膚炎は乳児期の代表的な皮膚疾患の一つであり強い掻痒感により生活の質(QOL)を著しく低下させるだけでなく、その後のアレルギー疾患である喘息やアレルギー性鼻炎への引き金になることが知られています。さらに注目すべきは近年の大規模コホート研究により、アトピー性皮膚炎罹患の有無は、自閉症や注意欠陥多動性障害(ADHD)の合併や、将来の不安症や鬱の発症に関係するとこれまでの研究で示唆されています。
今回の乳幼児期のマウスにアトピー性皮膚炎を人為的に発症させたところ思春期で鬱様症状を呈しやすい状態になっているという結果は、これまで疫学的に示されてきた幼少期のアトピー性皮膚炎と成長してからの精神疾患合併の関連性を動物実験・分子レベルで支持する成果として注目されます。なお、研究はNCNP精神保健研究所精神薬理研究部の協力のもと行われました。
研究成果は米国東部標準時2020年10月10日に米国神経科学誌『Brain, Behavior, and Immunity』オンライン版に発表されました。
研究の背景
近年、小児期から思春期においての精神疾患や発達障害の罹患者数増加が指摘されています。心身の発達において乳幼児期の成育環境が非常に重要であり、乳幼児期の慢性的ストレス負荷がその後の身体的・精神的発達において大きな影響を及ぼすことが知られています。アトピー性皮膚炎は強い掻痒感を伴う湿疹の増悪・改善を繰り返す慢性の皮膚疾患です。日本を含めた先進国において乳幼児の約15%がアトピー性皮膚炎に罹患しており、将来的に他のアレルギー性疾患を罹患するリスクだけでなく精神疾患や発達障害の罹患リスクが高まることが疫学的に報告されていますが詳細な因果関係や分子メカニズムに関してはほとんど何も分かっていません。
研究の内容
(1) 乳幼児期マウスを用いたアトピー性膚炎モデルマウスの作成
我々はまず初めに乳幼児期のマウスに化学物質であるオキサゾロンで反復刺激を行いアトピー性皮膚炎のモデルマウス作成を行いました。具体的には生後2日目の乳児期マウスにオキサゾロン塗布による感作を行い、生後9日目から2~3日おきに計10回、両耳へのオキサゾロン塗布によりアトピー性皮膚炎モデルマウス作成を行いました。生後30日目のアトピー性皮膚炎モデルマウスは著明な両耳の肥厚(図2A)を認めるとともに、血清のIgE上昇や耳組織内でのTh2細胞1)優勢のサイトカイン発現を認め、アトピー性皮膚炎様の皮膚炎が形成されていることが確認できました。また、生後30日目のアトピー性皮膚炎モデルマウスはコントロールマウスと比べてストレスの指標である血中のコルチコステロン2)上昇及び体重減少を認めており、ストレス環境下に暴露されている状態が示されました(図2B, C)。
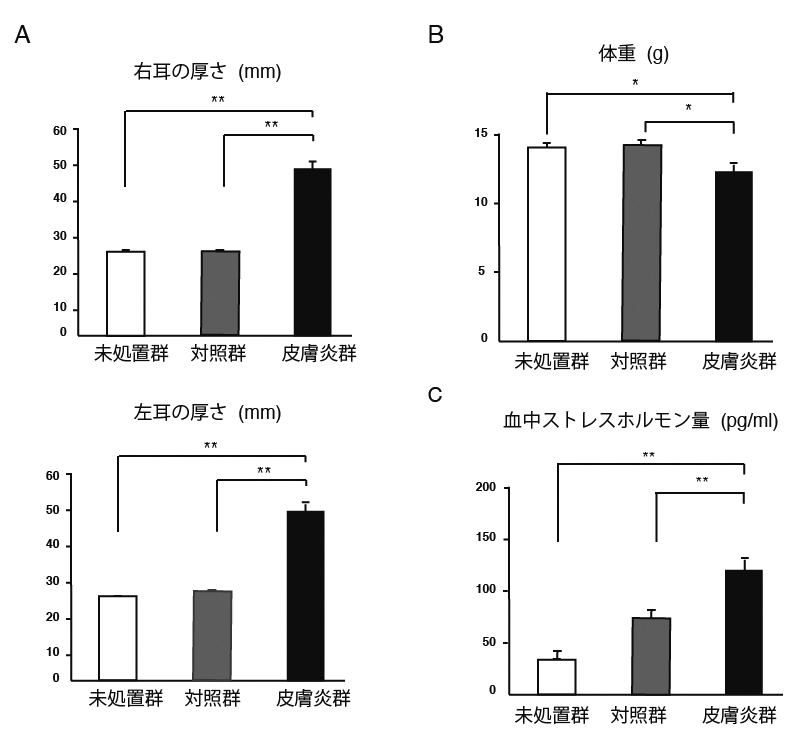
【図2】(A)生後30日目の皮膚炎群(黒)の左右の耳は著明な肥厚を示していた。(B)生後30日目の皮膚炎群(黒)で体重の増加不良が認められた。(C)生後30日目の皮膚炎群(黒)では血中のストレスホルモン量の増加を認めた。
(2)脳内炎症に対するプライミング状態4)の誘導
乳幼児期におけるアトピー性皮膚炎の思春期での影響を検証するため、生後40日目のアトピー性皮膚炎モデルマウスの行動解析を行ったところ、通常状態ではコントロールマウスと比べて明らかな異常は認めませんでした。しかしながら、アトピー性皮膚炎モデルマウスの扁桃体において脳内炎症に関わる主要な細胞であるミクログリア3)の機能抑制因子、CD200R1、の発現が抑制されていることが明らかとなりました(図3A)。さらに、アトピー性皮膚炎モデルマウスにリポポリサッカライド(LPS)全身投与による全身性炎症反応を誘導したところ、アトピー性皮膚炎モデルマウスの扁桃体や海馬ではIba-1陽性の活性型ミクログリアの数が有意に増加していることが明らかとなりました(図3B)。さらにはLPS全身投与4時間後のアトピー性皮膚炎モデルマウスの海馬でのIL-6の有意な発現上昇を認めました。以上の結果から、生後40日目のアトピー性皮膚炎モデルマウスの脳内では炎症反応に対するプライミング状態が誘導されていたことが明らかとなりました。
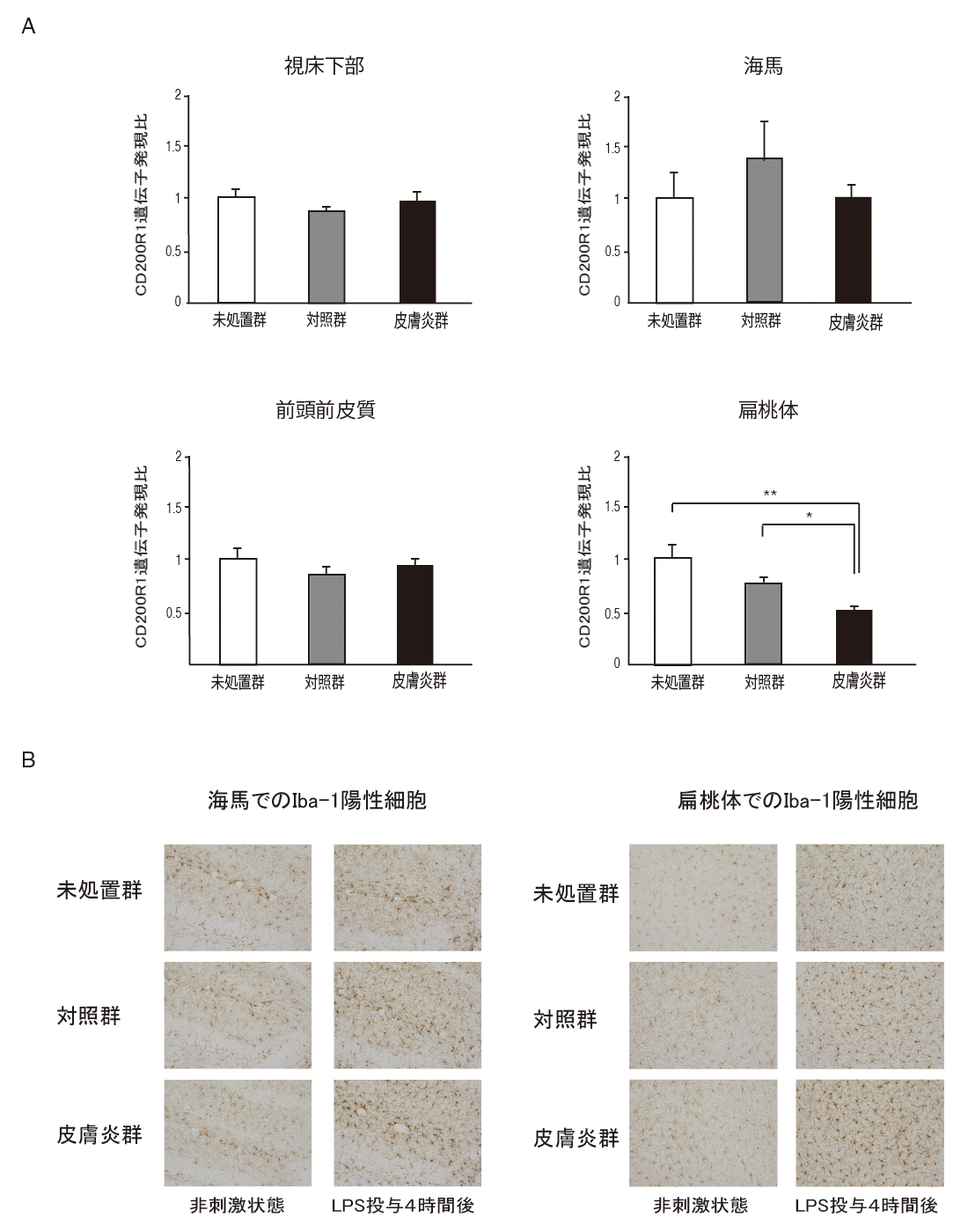
【図3】(A)生後40日目の皮膚炎群(黒)の扁桃体で炎症反応を抑制する因子(CD200R1)の遺伝子発現が低下していた。(B)生後40日目の皮膚炎群(黒)ではLPS全身投与4時間後に海馬や扁桃体で脳内の炎症反応に関わるミクログリア(Iba-1陽性細胞)の数が増えていた。
(3) 全身性炎症反応によるキヌレニン代謝5)異常を伴った鬱様症状の出現
生後40日目にLPS全身投与を行い24時間後の行動解析を行った結果、コントロールマウスでは生理食塩水投与群と比べていずれの行動解析においても明らかな変化は認めませんでしたが、アトピー性皮膚炎モデルマウスではLPS全身投与24時間後に糖嗜好試験におけるショ糖水飲水割合低下や尾懸垂試験における無動時間の増加といった鬱様症状を示しました(図4A, B)。また、鬱様症状出現の原因として、LPS全身投与4時間後のアトピー性皮膚炎モデルマウスの海馬、前頭前皮質や扁桃体において、キヌレニン代謝の律速酵素であるIDOやKMOの発現がLPS投与群で有意に上昇を認めていることからキヌレニン代謝異常による代謝産物の影響で鬱様症状が誘導されていることが示唆されました。
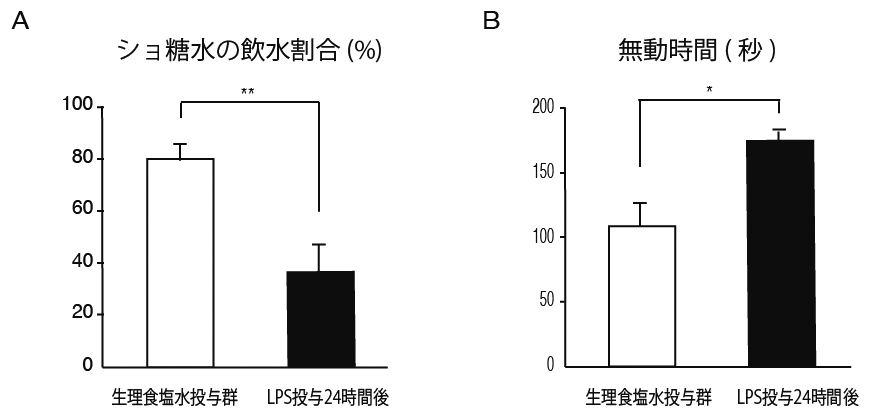
【図4】(A)生後40日目の皮膚炎群(黒)ではLPS全身投与24時間後のショ糖水飲水割合が低下していた。(B)生後40日目の皮膚炎群(黒)ではLPS全身投与24時間後の尾懸垂試験での無動時間が増加した。
今後の展望・意義
これまで乳幼児期のアトピー性皮膚炎に対する予防や治療として皮膚症状や随伴するアレルギー症状に焦点をあてた予防・治療計画が主流でありましたが、今後は将来の精神・神経発達を含めた予防や治療の重要性を示すことが出来ました。また、乳幼児期のストレス全般においてその後の精神・神経発達への影響に脳内炎症に対するプライミング機構の関与が明らかとなってきています。本研究では乳幼児期の環境が将来の精神・神経発達へ及ぼす影響に対する分子機構の一部を明らかにすることが出来、今後新たな予防法や治療法開発につながることが期待されます。
用語解説
1) Th2細胞:体の中で免疫を担当する細胞のうち、免疫系の反応を制御する役割や体内に侵入してきた異物を攻撃する役割をもつT細胞と呼ばれる細胞があります。そのうち、免疫系の反応を制御するT細胞をヘルパーT細胞と言い、さらにヘルパーT細胞はTh1とTh2に分類されます。Th1細胞は異物を直接攻撃する役割の免疫を助ける役割を持ち、Th2細胞は異物に対する抗体を作る免疫を助ける役割を持ちます。自己免疫疾患ではTh1細胞が優勢であり、アレルギー性疾患ではTh2細胞が優勢な状態になっています。
2) コルチコステロン:体の副腎皮質と呼ばれる器官から産生されるホルモンの一つであり、代謝や免疫の働きを調整する作用をもち、体の恒常性維持を保つために重要なホルモンです。ストレスがかかると分泌が亢進し、ストレスの応答制御にも大きく関わっています。
3)ミクログリア:脳を含む中枢神経系に存在する免疫担当細胞であり、脳内の環境を監視しています。ミクログリアは周囲の環境に応じて、神経細胞同士のつながりを調整する役割や神経の修復を促す役割、さらには感染やストレスに反応し炎症反応を惹起する役割を持っています。
4)プライミング状態:あらかじめ受けた刺激により、追加の刺激に対する反応が促進されている状態のことを言います。例えば、幼少期のころに強いストレスを受けた際は症状としては何も発症しない状態であっても、その後の思春期や成人で再度ストレスを受けた際に症状が発症するような状態のことを言います。
5)キヌレニン代謝:必須アミノ酸であるトリプトファンの代謝経路の一部であり、インドールアミン2,3-ジオキシゲナーゼ(IDO)によって開始されます。更にその下流ではキヌレニン3-モノオキシゲナーゼ(KMO)の働きにより神経毒性がある3-ヒドロキシキヌレニンやキノリン酸などの代謝産物が産生され鬱病の状態を惹起することが報告されています。
原著論文情報
・論文名:. Early life stress from allergic dermatitis causes depressive-like behaviors in adolescent male mice through neuroinflammatory priming
・タイトル和訳: 幼少期のアレルギー性皮膚炎によるストレスは思春期の脳内炎症に対するプライミング効果を介して鬱様症状を誘導する。
・著者名:Okito Hashimoto , Hiroshi Kuniishi, Yuko Nakatake, Mitsuhiko Yamada, Keiji Wada, and Masayuki Sekiguchi
・掲載誌:Brain, Behavior, and Immunity
・DOI:10.1016/j.bbi.2020.09.013
助成金
本研究は、JSPS科研費(15K067301, 19K17349)並びに精神・神経疾患研究開発費(30-1, 30-3)の支援によって行われました。
お問い合わせ先
【研究に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 疾病研究第4部
橋本 興人 科研費研究員
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター 総務課 広報係