副作用の少ない口腔がんの新規治療法の開発に期待
2020-11-20 東京医科歯科大学,日本医療研究開発機構
ポイント
- β2アドレナリン受容体作動薬※1であるイソクスプリン※2が、口腔がんの悪性化要因である上皮間葉移行(epithelial-mesenchymal transition, EMT)※3を抑制することを明らかにしました。
- イソクスプリンは、これまでEMTを誘導することが知られていたトランスフォーミング増殖因子β(TGF-β)※4シグナルを抑制せずにEMTを抑制し、口腔がん細胞による腫瘍形成を阻害しました。
- TGF-βシグナルを抑制することによる正常細胞のがん化という副作用なしに、EMTを抑制することで、口腔がんを治療する新規治療薬開発への応用が期待できます。
概要
東京医科歯科大学大学院医歯学総合研究科硬組織病態生化学分野の渡部徹郎教授と井上カタジナアンナ助教と榊谷振太郎大学院生(顎口腔外科学分野)の研究グループは、東京医科歯科大学大学院医歯学総合研究科顎口腔外科分野の原田浩之教授と生体材料工学研究所薬化学分野影近弘之教授との共同研究で、β2アドレナリン受容体作動薬であるイソクスプリンが口腔がん細胞の悪性化と腫瘍形成を抑制することを見出しました。この研究は国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「口腔がんの微小環境ネットワークを標的とした新規治療法の開発」(研究開発代表者:渡部徹郎)、文部科学省科学研究費補助金等の支援のもとでおこなわれたもので、その研究成果は国際科学誌Cancer Scienceに、2020年11月19日午前3時(米国東部時間)にオンライン版で発表されました。
研究の背景
口腔がんでは早期から頸部リンパ節に転移して急速に進行する悪性度の高いものがあり、遠隔臓器への転移が主な死亡の原因となっています。口腔がんの9割を占める口腔扁平上皮がん細胞はトランスフォーミング増殖因子β(transforming growth factor-β:TGF-β)シグナルにより上皮間葉移行(EMT)を起こし、転移を起こします(図1)。EMTは上皮系形質を有するがん細胞がその細胞間結合性を失い、高い運動能などの間葉系形質を獲得するという、がんの悪性化を誘導するプロセスで、近年では完全に間葉系形質を獲得する以前の部分的なEMT(partial EMT)の状態が腫瘍形成能や薬剤耐性を誘導するということが報告されています。
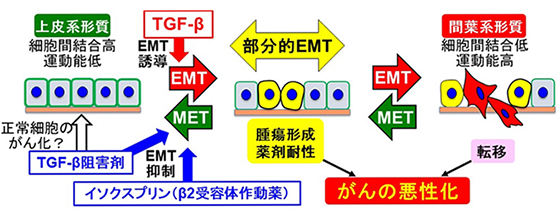
図1:がんの悪性化因子である上皮間葉移行(EMT)を抑制する因子の同定上皮がん細胞はTGF-βによりEMTが誘導され、腫瘍形成能や薬剤耐性能が高い「部分的EMT」の状態を経て、転移能が高い間葉系形質を獲得し、がんの悪性化が進展する。TGF-β阻害剤はEMTを抑制する(間葉上皮移行(mesenchymal epithelial transition, MET)を誘導する)が、正常細胞のがん化というリスクがあるため、本研究ではEMTのみを抑制する因子としてβ2アドレナリン受容体を活性化するイソクスプリンを同定した。
したがって、TGF-βシグナルの阻害作用がある低分子化合物はがん治療効果を有することが期待されていますが、一方で正常細胞の増殖を抑制する作用を持つTGF-βシグナルを阻害することは正常細胞をがん化させるリスクを伴っています。このことから、TGF-βシグナルを阻害せずに、EMTだけを抑制する新規治療薬の開発が望まれていました。
研究成果の概要
ヒト口腔扁平上皮がん細胞株SASではTGF-βの添加によりEMTが起こる一方で、TGF-β阻害剤により間葉系細胞の性質が低下し、細胞の運動能が低下するという間葉上皮移行(MET)が起こることが報告されています。本研究グループはこのSAS口腔がん細胞株の特性を利用し、生体材料工学研究所が有するライブラリーを用いてMETを誘導する低分子化合物をスクリーニングした結果、イソクスプリン(イソクスプリン塩酸塩)を同定しました。イソクスプリンは末梢血管拡張作用や子宮鎮痙作用を示す薬剤として、一般に用いられています。SAS口腔がん細胞株を用いた解析により、イソクスプリンがTGF-β阻害剤と同様にEMTによって上昇する細胞運動能を低下させることが明らかになりました(図2)。また、このEMT抑制作用がTGF-βシグナルを阻害することによるものではないことも示されました(図2)。イソクスプリンはβ2アドレナリン受容体に結合することが知られていますが、イソクスプリンのEMT抑制作用がβ2アドレナリン受容体シグナルを介することが、薬理学的そして遺伝学的な解析を用いて明らかになりました(図3)。さらに個体レベルでの腫瘍形成に対するイソクスプリンの作用を検討するため、免疫不全マウスを用いたSAS口腔がん細胞による腫瘍形成試験を行った結果、イソクスプリンの投与は有意に腫瘍形成を抑制することが示されました(図4)。以上の結果からイソクスプリンが口腔がんの治療に有効であることが明らかになりました。
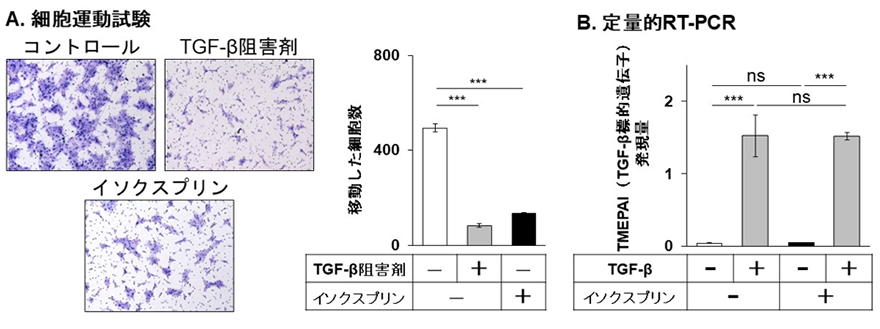 図2:A.SAS口腔扁平上皮がん細胞株を用いて細胞運動試験(チャンバー運動試験)を行ったところ、TGF-β阻害剤と同様にイソクスプリンはチャンバーを移動する細胞(青)の数を減少させた。B.また、TGF-βによるTMEPAI(TGF-β標的遺伝子)の発現誘導をイソクスプリンが抑制しなかったことから、イソクスプリンはTGF-βシグナルを阻害せずに細胞運動を亢進するEMTを抑制する(METを誘導する)ことが示唆された。***:有意差あり、ns:有意差なし
図2:A.SAS口腔扁平上皮がん細胞株を用いて細胞運動試験(チャンバー運動試験)を行ったところ、TGF-β阻害剤と同様にイソクスプリンはチャンバーを移動する細胞(青)の数を減少させた。B.また、TGF-βによるTMEPAI(TGF-β標的遺伝子)の発現誘導をイソクスプリンが抑制しなかったことから、イソクスプリンはTGF-βシグナルを阻害せずに細胞運動を亢進するEMTを抑制する(METを誘導する)ことが示唆された。***:有意差あり、ns:有意差なし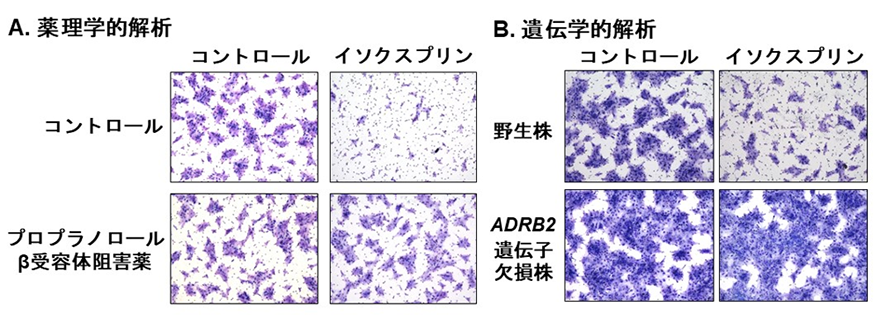 図3:イソクスプリンのEMT抑制作用におけるβ2アドレナリン受容体シグナルの役割A.SAS口腔扁平上皮がん細胞株を用いて細胞運動試験(チャンバー運動試験)を行うとイソクスプリンはチャンバーを移動する細胞(青)の数を減少させるが、βアドレナリン受容体の作用を薬理学的に阻害するプロプラノロール存在下ではその抑制作用は阻害された。B.また、β2アドレナリン受容体遺伝子(ADRB2)を欠損させることでもイソクスプリンのEMT抑制作用が消失することからも、イソクスプリンはβ2アドレナリン受容体を介してEMTを抑制する(METを誘導する)ことが示唆された。
図3:イソクスプリンのEMT抑制作用におけるβ2アドレナリン受容体シグナルの役割A.SAS口腔扁平上皮がん細胞株を用いて細胞運動試験(チャンバー運動試験)を行うとイソクスプリンはチャンバーを移動する細胞(青)の数を減少させるが、βアドレナリン受容体の作用を薬理学的に阻害するプロプラノロール存在下ではその抑制作用は阻害された。B.また、β2アドレナリン受容体遺伝子(ADRB2)を欠損させることでもイソクスプリンのEMT抑制作用が消失することからも、イソクスプリンはβ2アドレナリン受容体を介してEMTを抑制する(METを誘導する)ことが示唆された。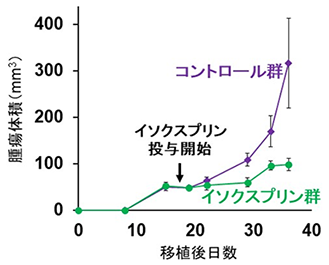
図4:口腔がん細胞による腫瘍形成に対するイソクスプリンの作用SAS口腔扁平上皮がん細胞株を免疫不全マウスの皮下に移植して腫瘍が形成された後(移植後19日目)にイソクスプリンの投与を開始し、腫瘍体積を計測した。イソクスプリンを投与したマウスにおける腫瘍形成はコントロール群と比較して顕著に低下した。
研究成果の意義
近年、舌がんを含む口腔がんによる死亡者は増加しており、有効な治療法の開発は急務です。口腔がんによる主要な死因である転移を抑制できる治療法にはまだ有効なものがなく、転移の原因となるEMTを標的とした治療薬の開発が望まれていました。これまでβ2アドレナリン受容体シグナルを活性化することで口腔扁平上皮がん細胞のEMTを抑制するという報告はなく、今回の研究成果はがん転移をはじめとした様々な疾患の要因となるEMTの分子機序解明に寄与するとともに、EMTを標的とした場合の正常組織のがん化という副作用のリスクが少ない新たながん治療法の開発へ応用されることが期待されます。
用語の説明
- ※1β2アドレナリン受容体作動薬
- アドレナリンを始めとするカテコールアミン類によって活性化されるアドレナリン受容体にはα1・2、β1~3の5つのサブタイプが存在するが、β2アドレナリン受容体に選択的に直接作動して活性化するものを指す。アドレナリンは強心、昇圧、気管支拡張などの作用を発揮し、臨床的には、心停止時に用いたり、気管支喘息発作時の気管支拡張薬などとして用いられる。
- ※2イソクスプリン
- β2アドレナリン受容体に作動する血管拡張薬である。血管拡張作用により脳・末梢の血液循環動態を改善し、子宮筋弛緩作用により子宮筋の収縮・痙攣を改善する。通常は切迫流・早産や月経困難症などの治療に用いられる。
- ※3上皮間葉移行(epithelial-mesenchymal transition:EMT)
- 上皮細胞が間葉系細胞へと分化する過程で、細胞は細胞間接着分子であるE-カドヘリン(E-cadherin)やクローディン-1(Claudin-1)などの発現を消失し、ビメンチン(Vimentin)や平滑筋α–アクチン(Smooth Muscle α–Actin, SMA)などの発現や高い運動・浸潤能などの間葉系細胞の形質を獲得する。EMTは発生過程で見られる生理的な現象だが、組織の線維化や、がん転移などの病態の進展にも関与する。また、間葉系細胞が上皮細胞へ移行する過程を間葉上皮移行(mesenchymal epithelial transition, MET)という。
- ※4トランスフォーミング増殖因子β(transforming growth factor-β:TGF-β)
- 線維芽細胞の形質転換を促進する因子として同定されたが、現在では多くの種類の細胞に対して増殖抑制作用を有することが明らかになっている。さらに、細胞の分化・運動などにも関与し、個体発生やがんの浸潤・転移など様々な病態生理学的現象において重要な役割を果たすことがわかっている。
論文情報
- 掲載誌
- Cancer Science
- 論文タイトル
- Activation of β2-adrenergic receptor signals suppresses mesenchymal phenotypes of oral squamous cell carcinoma cells
- 著者
- Shintaro Sakakitani1,2, Katarzyna Anna Podyma-Inoue2*, Rina Takayama2, Kazuki Takahashi2, Mari Ishigami-Yuasa3, Hiroyuki Kagechika3, Hiroyuki Harada1 and Tetsuro Watabe2*
- 所属
- 1Department of Oral and Maxillofacial Surgery, 2Department of Biochemistry, Graduate School of Medical and Dental Sciences and 3Chemical Biology Screening Center, Department of Organic and Medicinal Chemistry, Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University (TMDU), Tokyo, Japan
- DOI
- 10.1111/cas.14670
- 掲載日
- 2020年11月19日
- URL
- http://dx.doi.org/10.1111/cas.14670
研究者プロフィール
渡部徹郎(ワタベテツロウ) Watabe Tetsuro
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 教授
・研究領域 がん生物学、血管生物学、生化学
井上カタジナアンナ(イノウエカタジナアンナ) Inoue Katarzyna Anna
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 助教
・研究領域 がん生物学、生化学
榊谷振太郎(サカキタニシンタロウ) Sakakitani Shintaro
東京医科歯科大学大学院医歯学総合研究科
顎口腔外科学分野 大学院生
・研究領域 口腔外科学、がん生物学
お問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 渡部徹郎(ワタベテツロウ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMEDの事業に関する問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)