がん微小環境形成の新たな仕組みを示唆
2021-03-16 東海大学,日本医療研究開発機構
背景
エプスタイン・バー(Epstein-Barr, EB)ウイルス(注1)は1964年に発見された最初のがんウイルスです。このウイルスはリンパ球の一種であるB細胞に感染しますが、ほとんどの場合は無症状で生涯にわたって潜伏感染します。しかし、免疫低下や加齢などの要因により、まれにEBウイルス感染B細胞が活性化して悪性リンパ腫を主とする病気を発症します。このEBウイルス関連リンパ腫は強い炎症を伴い既存の治療法が効きにくいため予後不良であることが知られており、新たな治療法の開発が求められています。
ポイント
- EBウイルス感染リンパ腫細胞から放出される細胞外小胞には、がん細胞自身の生存や増殖を促進させる環境(がん微小環境)を形成するはたらきがあります。しかし、この機序については不明な点が残されていました。
- 細胞外小胞の主要構成分子であるタンパク質とリン脂質に着目し、がん微小環境形成能を持つ細胞外小胞にどのような分子が含まれているかを網羅的に解析しました。
- がん微小環境形成能を持つ細胞外小胞には、特定の炎症制御タンパク質や脂質分子が豊富に含まれていることが明らかとなりました。
- がん微小環境形成能を持つ細胞外小胞は粒子密度が低い特定の亜集団であることが示唆されました。
- 本研究成果は、EBウイルス関連リンパ腫の病態解明だけでなく、がん微小環境を標的とした効果的な新規治療法の開発につながることが期待されます。
発表の概要
東海大学生命科学統合支援センターの伊藤誠敏技術職員、同大医学部基盤診療学系先端医療科学の工藤海大学院生と幸谷愛教授らの研究グループは、EBウイルス関連リンパ腫細胞から放出される細胞外小胞(注2)に様々な炎症制御性タンパク質や脂質分子が多く存在することを明らかにし、EBウイルス関連リンパ腫の新たながん微小環境(注3)形成機序を提唱しました。
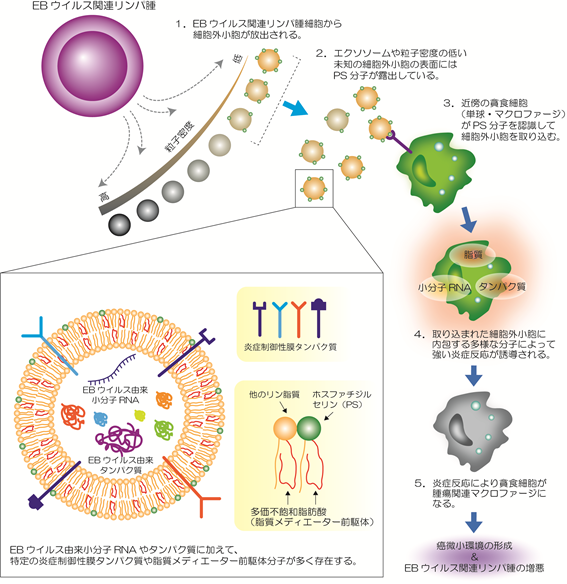
図1 本研究成果から想定されるEBウイルス関連リンパ腫でのがん微小環境形成機序
EBウイルス関連リンパ腫はEBウイルスに感染したリンパ球が活性化することによって発症します。強い炎症を伴い、既存の治療法が効きにくいため予後不良であることが知られています。本研究グループは以前に、EBウイルス感染リンパ腫細胞から放出される細胞外小胞ががん細胞の生存と増殖を促進させる癌微小環境を形成することを明らかにしました(引用文献)。しかし、そのがん微小環境形成の分子メカニズム及びその責任因子となる細胞外小胞については不明な点が残されていました。
本研究では、細胞外小胞に豊富に含まれるタンパク質とリン脂質(注4)を質量分析(注5)によって網羅的に解析し、がん微小環境の形成に関与し得る新たな分子の解明を試みました。その結果、EBウイルス感染リンパ腫細胞から放出された細胞外小胞には複数の炎症制御性タンパク質や脂質分子が多く含まれていることが明らかになりました。更に、がん微小環境形成能を持つ細胞外小胞は粒子密度の低い特定の亜集団であることが示唆されました。本研究結果は、EBウイルス関連リンパ腫におけるがん微小環境形成メカニズムの一端を明らかにしたものであり、EBウイルス関連リンパ腫に対する新たな治療法開発につながることが期待されます。
本研究成果は2021年3月16日午前0時米国東部時間(日本時間2021年3月16日午後2時)の米科学雑誌「The FASEB Journal」オンライン版に掲載されます。
研究の詳細
本研究グループは以前の研究で、EBウイルスAkata株感染リンパ腫細胞から放出される細胞外小胞(以後、Akata EVsと省略)のうち、表面にホスファチジルセリン(phosphatidylserine:PS、注6)分子を持つ細胞外小胞が周辺の貪食細胞(単球やマクロファージ)に取り込まれ、それら貪食細胞を腫瘍関連マクロファージ(注7)に変換することでがん微小環境を形成することを明らかにしました(引用文献:Blood, Vol.131, p.2552, 2018)。PS結合性タンパク質の固相化ビーズを用いてPS分子を表面に持つAkata EVs及びがん微小環境形成能を持たないEBウイルスB95-8株感染細胞由来細胞外小胞(以後、B95-8 EVsと省略)を精製し、これら細胞外小胞のタンパク質を網羅的に解析しました。その結果、PS分子を表面に持つAkata EVsとB95-8 EVsで数百種類のヒト由来タンパク質が検出されました(図2A)。同時に、複数のEBウイルス由来タンパク質も検出されました。また、比較定量解析から、複数の炎症制御性膜タンパク質がPS分子を表面に持つAkata EVsに多く含まれていることが明らかとなりました(図2B)。PS分子を表面に持つAkata EVsに多く含まれていたFGF2とインテグリンaLb2タンパク質を阻害すると、Akata EVsによる単球培養細胞の炎症応答が抑制されたため(図2C)、少なくともこれら2分子ががん微小環境形成に関与することが示唆されました。次に、これら細胞外小胞に含まれるリン脂質を網羅的に解析したところ、多価不飽和脂肪酸(注8)と呼ばれる脂肪酸鎖が結合したリン脂質がPS分子を表面に持つAkata EVsに、より多く含まれることが明らかとなりました。この多価不飽和脂肪酸は代謝によって様々な生理活性を有する分子(脂質メディエーター、注9)に変換されることが知られています。
- 引用文献
- Hiroshi Higuchi, Natsuko Yamakawa, Ken-Ichi Imadome, Takashi Yahata, Ryutaro Kotaki, Jun Ogata, Masatoshi Kakizaki, Koji Fujita, Jun Lu, Kazuaki Yokoyama, Kazuki Okuyama, Ai Sato, Masako Takamatsu, Natsumi Kurosaki, Syakira Mohamad Alba, Azran Azhim, Ryouichi Horie, Toshiki Watanabe, Toshio Kitamura, Kiyoshi Ando, Takao Kashiwagi, Toshimitsu Matsui, Akinao Okamoto, Hiroshi Handa, Masahiko Kuroda, Naoya Nakamura, Ai Kotani
Role of exosomes as a proinflammatory mediator in the development of EBV-associated lymphoma.
Blood 131, 2552-2567(2018).
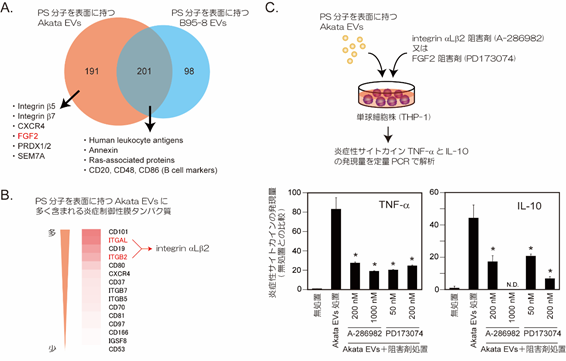
図2 がん微小環境形成能を持つAkata EVsとがん微小環境形成能を持たないB95-8 EVsの比較検討:細胞外小胞の網羅的タンパク質解析。
- PS分子を表面に持つAkata EVsとB95-8 EVsでそれぞれ検出されたタンパク質の数。重なっている部分は共通に存在するタンパク質を表します。
- PS分子を表面に持つAkata EVsに多く含まれる炎症制御性膜タンパク質。赤色が濃いほど多く含まれることを表します。
- 図2Bで同定された分子(インテグリンaLb2など)のがん微小環境形成能への関与について:細胞外小胞による単球の炎症応答におけるFGF2又はインテグリンaLb2阻害剤の効果。両阻害剤の処理によって、Cの下のグラフの結果より、炎症性サイトカインの発現量が減少していることから、単球の炎症反応が顕著に抑制されており、Akata EVs由来のFGF2、インテグリンaLb2両分子は細胞外小胞を介するがん微小環境形成に関与する可能性が示唆されました。
細胞外小胞は密度勾配遠心によって比重の異なる多様な亜集団に分離されることが知られています。EBウイルスAkata株感染リンパ腫細胞から放出された細胞外小胞を密度勾配遠心して10個の画分(F1~F10)に分離しました(図3A)。F1は最も比重が小さい画分で、F10は最も大きい画分になります。そのうち、F3とF4にはエクソソームのマーカータンパク質のCD63(cluster of differentiation:CD)が高発現しており、エクソソームが豊富に含まれていました。これら10個のAkata EV画分とPS分子を表面に持つAkata EVsについて、各々に存在するリン脂質分子組成の類似性を調べると、PS分子を表面に持つAkata EVsのリン脂質組成は比重の小さいAkata EV画分と高い類似性があることが明らかとなりました(図3B)。また、多価不飽和脂肪酸の一つであるドコサヘキサエン酸(Docosahexaenoic acid:DHA)結合型リン脂質の量も比重の小さいAkata EV画分で顕著に多く、PS分子を表面に持つAkata EVsと同程度でした(図3C)。従って、がん微小環境形成能を持つ細胞外小胞はエクソソームや粒子密度の低い未知の細胞外小胞から成る亜集団であることが示唆されました。
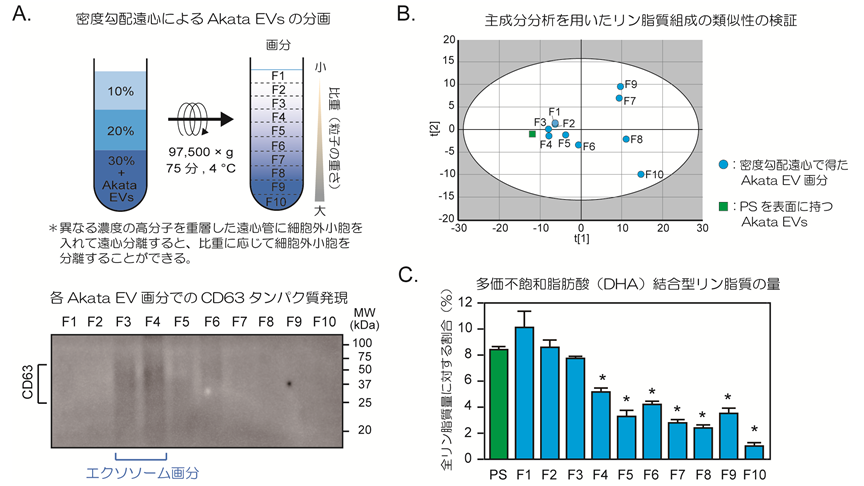 図3 密度勾配遠心による細胞外小胞の分離とリン脂質組成の類似性
図3 密度勾配遠心による細胞外小胞の分離とリン脂質組成の類似性
- EBウイルスAkata株感染リンパ腫細胞から放出された細胞外小胞を比重の異なる10個の画分に分離しました。F3とF4にはエクソソームと呼ばれる細胞外小胞が多く含まれていました。
- 比重分離した10個のAkata EV画分とPS分子を表面に持つAkata EVsにおけるリン脂質組成の主成分分析。PS分子を表面に持つAkata EVsは比重の小さい画分と高い類似性があることが明らかとなりました。
- DHA結合型リン脂質の量。比重の小さい画分(F1~F3)で多く、PS分子を表面に持つAkata EVsと同程度であることが明らかとなりました。
以上の結果をまとめると、EBウイルス関連リンパ腫細胞から放出される細胞外小胞の中でも、粒子密度の低い(軽い)細胞外小胞亜集団(エクソソームや未知の細胞外小胞を含む)には貪食細胞への取り込みの目印となるPS分子が表面に出ており、これら細胞外小胞には以前の研究で解明されたEBウイルス由来小分子RNA(引用文献:Blood, Vol.131, p.2552, 2018)に加えて多様な炎症制御性タンパク質や脂質メディエーター前駆体が蓄積していることが明らかとなりました。このことから、この細胞外小胞が周辺の貪食細胞に取り込まれると、細胞外小胞に内包される上記の分子群による多面的なはたらきによって炎症反応が強く誘導され、腫瘍関連マクロファージへの変換とそれに続くがん微小環境の形成という機序が想定されます。
今後の展開
本研究から、EBウイルス関連リンパ腫細胞から放出される細胞外小胞によるがん微小環境の形成はある特定の細胞外小胞に内包される多様な分子群による多面的なはたらきが寄与しているという機序が示唆されました。今後は、がん微小環境形成に寄与する細胞外小胞の解明とがん微小環境形成機序の検証を進め、EBウイルス関連リンパ腫におけるがん微小環境形成機序の全容解明と、がん微小環境を標的にした効果的な新規治療法の確立を目指します。
本研究への支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業「細胞外脂質代謝酵素によるエクソソームの脂質修飾を介したがん微小環境の制御(研究開発代表者:村上誠)」、革新的先端研究開発支援事業(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山信治)における研究開発課題「炎症がん由来エクソソームにおける脂質の役割」(研究開発代表者:幸谷愛)、肝炎等克服実用化研究事業「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定とその制御による病態制御法開発(研究開発代表者:大塚基之)」における分担研究開発課題「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定による肝炎・持続感染の制御法開発」(研究開発分担者:幸谷愛、課題番号:16fk0210114h0001)、及び文部科学省の先端研究基礎基盤事業「臨床質量分析共用プラットフォーム」(受入機関:横浜市立大学先端医科学研究センタープロテオーム解析センター)の支援により行われました。
用語解説
- (注1)EBウイルス(Epstein-Barr virus:EBV)
- 二本鎖DNAをゲノムとして持つヘルペスウイルスの一種。がんウイルスとしては、パピローマウイルス、肝炎ウイルスの次に罹患者が多い。EBV関連疾患の多くは悪性リンパ腫などの血液腫瘍であるが、稀に胃がんなどの上皮細胞がんや自己免疫疾患も引き起こすことが知られている。
- (注2)細胞外小胞(Extracellular vesicles:EVs)
- 細胞から放出される核を持たない脂質二重膜で囲まれた粒子。中でもエンドソームを起源とし直径50~200nmの小胞をエクソソームと呼ぶ。細胞外小胞はその産生機構や粒子径の違いにより、多種多様に存在する。
- (注3)がん微小環境
- がん組織には線維芽細胞や特殊な免疫細胞が集まり、がん細胞自身の生存や成長を助ける刺激や増殖因子が作られている。
- (注4)リン脂質
- リン酸エステル部位を持つ脂質であり、細胞膜の主要構成分子。細胞膜を形成するリン脂質はグリセロリン脂質と呼ばれ、2つの脂肪酸が結合している。
- (注5)質量分析
- 分子をイオン化してその質量や量を測定することにより、分子の同定や定量を行う方法。わずかな質量差の分子も区別できるため、生命科学研究において必須の分析法となっている。
- (注6)ホスファチジルセリン(Phosphatidylserine:PS)
- リン脂質の一種で、細胞では細胞膜の内側に存在するが細胞死の際には表面に露出する。貪食細胞の取り込みの目印となる。
- (注7)腫瘍関連マクロファージ
- がん組織に浸潤しているマクロファージでがん細胞の生存や成長を助けている。外来病原菌を貪食する通常のマクロファージとは異なる。
- (注8)多価不飽和脂肪酸
- 不飽和結合を複数持つ脂肪酸の総称。特にアラキドン酸やドコサヘキサエン酸は代謝により様々な脂質メディエーター分子に変換される。
- (注9)脂質メディエーター
- 生理活性を持つ脂質。プロスタグランジンやロイコトリエンのような脂肪酸由来のものを含め多種多様な分子が存在する。
論文タイトル、著者および所属
- 掲載誌名
- The FASEB Journal
- 論文タイトル
- Proteomic and phospholipidomic characterization of extracellular vesicles inducing tumor microenvironment in Epstein-Barr virus–associated lymphomas
- 著者および所属
- 伊藤誠敏1、工藤海2、3、樋口廣士2、大塚寛子2、田中政之1、福西菜穂子1、荒木琢磨1、高松昌子2、3、井野洋子4、木村弥生4、幸谷愛2,3
(1東海大学生命科学統合支援センター、2東海大学総合医学研究所血液・腫瘍学研究部門、3東海大学基盤診療学系先端医療科学、4横浜市立大学先端医科学研究センター) - DOI
- 10.1096/fj.202002730R
お問い合わせ先
本研究に関する問い合わせ先
東海大学 医学部基盤診療学系先端医療科学
幸谷愛
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
次世代がん医療創生研究事業