2021-04-30 東京医科歯科大学,日本医療研究開発機構
研究成果のポイント
- 本研究グループは、これまでに独自に開発した核酸医薬である「DNA/RNAヘテロ2本鎖核酸(HDO)」が、一本鎖アンチセンス核酸医薬であるASOと比較しても非常に高い遺伝子発現抑制効果を示すことを報告しています。しかしながら、多くの研究報告があるASOと比べて、HDOの細胞内の作用分子メカニズムは解明されていませんでした。今回研究グループは、HDOに特異的な結合タンパク質を複数同定することに成功しました。
- 同定したタンパク質は、塩基配列に関わらず13~16塩基対の短いDNA/RNAに選択的に結合できることを見出しました。
- 同定した結合タンパク質が、HDOの活性制御に重要な働きをしていることを明らかにしました。HDOの作用メカニズムの解明により、今後、効果が高く副作用の少ない核酸医薬の開発につながるものと期待されます。
概要
東京医科歯科大学大学院 医歯学総合研究科 脳神経病態学分野(脳神経内科)の横田隆徳教授、浅田健特任助教らは、HDO核酸に結合する複数のタンパク質を同定し、同定タンパク質がHDOの活性制御に関わっていることを明らかにしました。この研究は日本医療研究開発機構(AMED)の先端的バイオ創薬等基盤技術開発事業における研究課題「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的分子標的治療とブレインイメージング」(研究代表者:横田隆徳)と、日本学術振興会科学研究費助成事業基盤研究Cにおける研究課題名「DNA/RNAヘテロ2本鎖核酸を切断するヌクレアーゼの同定および作用機序解明」(研究代表者:浅田健)の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Nucleic Acids Researchに、2021年4月30日午前1時5分(英国夏時間)にオンライン版で発表されます。
研究の背景
核酸医薬は、従来の低分子化合物医薬や抗体医薬では困難な標的であるRNAに対して選択的な機能制御を可能とする先端的なバイオ医薬技術です。核酸医薬は大きく分けてRNAを基盤としたsiRNAおよびmiRNA mimic(いずれも2本鎖RNA)とDNAを基盤としたデコイ(2本鎖DNA)、アンチセンス核酸(antisense oligonucleotides, ASO; 1本鎖DNA)※1、および研究グループで開発したHDO(heteroduplex oligonucleotides, ヘテロ2本鎖核酸)※2に分類することができます(図1)。
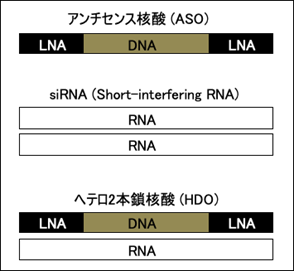
図1. 異なる構造の核酸医薬(LNA※3は人工核酸のひとつ)
DNAを基盤とした核酸医薬ではASOとして、家族性高コレステロール血症に対するミポメルセン、脊髄性筋萎縮症に対するヌシネルセンなどが承認されています。これら以外にも、多くの疾患で臨床試験が進行しています。Gapmer型※4のASO核酸医薬の作用メカニズムとしては、ASO鎖が標的RNAの配列依存的に結合し、続いてRNase H※5が2本鎖ASO/RNAを認識して標的RNAを切断することによって、遺伝子の発現を制御することが知られています。ASOに関しては受容体、結合タンパク質、細胞内輸送機構も含めて、多くの細胞内の分子機構が解明されて報告がなされています。一方でHDOに関しては、どのようなタンパク質と結合するのか、どのように2本鎖HDOから1本鎖ASOが分離されるのかも含めて、詳細には解明されていませんでした。そこで研究グループはHDOの作用メカニズムを解明するため、HDOに結合するタンパク質の同定を試みました。
研究の概要
HDO結合タンパク質を同定する為に、ASOとHDOをそれぞれマウスに投与し、3時間後に肝臓組織を単離しました。研究グループが独自に開発した解析手法として、まず超遠心を利用したスクロース分画法を用いて、肝臓抽出液を分画しました。続いて、それぞれの分画をタンパク質非変性条件下でゲル電気泳動を行い、核酸染色試薬を用いてASOとHDOを可視化しました。さらに同じゲル上でタンパク質染色試薬を用いてタンパク質を可視化し、コントロール(非投与)群、ASO投与群、HDO投与群の3群間で比較して、HDO群でのみ可視化された核酸バンド、かつ核酸バンドと泳動移動度が同じだったタンパク質バンド(核酸のバンドとオーバーラップしたバンド)をHDOに結合するタンパク質と推定し、ゲルから切り出し後、質量分析器を用いて解析しました。その結果、複数のHDO結合候補タンパク質が同定されました。次に、先にマウス肝臓組織抽出液を調製し、その抽出液にHDOを加える実験を検討したところ、同様に複数のHDO結合タンパク質を同定することができました。上記2つの異なる実験に共通して、 ANXA5タンパク質とCA8タンパク質がHDOに結合する候補タンパク質として見出されました。
さらなる結合タンパク質を同定する為に、既報論文の検討およびバイオインフォマティクス解析を行ったところ、HDO結合候補タンパク質として、APEX1とFEN1を見出しました。ANXA5, CA8, APEX1, FEN1の各精製タンパク質を用いた実験から、これら同定したタンパク質がいずれも異なる配列を有するHDOと結合することが明らかになりました。また配列長に関して検討した結果、13~16塩基対の長さのHDOに結合することが明らかとなりました。
これらタンパク質をノックダウンした細胞を用いた遺伝子発現解析から、ANXA5, CA8, APEX1, FEN1いずれのタンパク質も、HDOの活性に寄与し、標的RNAの発現制御に重要な役割を果たしていることが明らかとなりました(図2)。
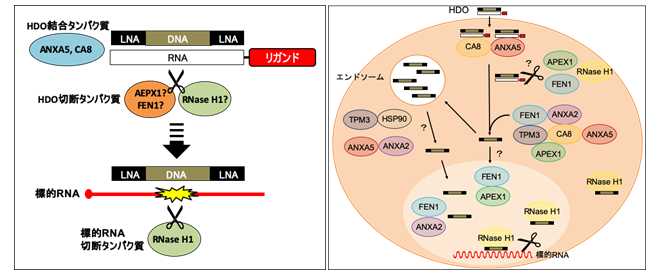
図2. HDOによる遺伝子発現制御機構と今回同定したタンパク質の関わり左図:HDOと今回同定したタンパク質による遺伝子発現制御機構の概略図 右図:これまでの知見および今回の報告をもとに推測されるHDOによる遺伝子発現制御機構の一例。HDOがANXA5およびCA8に結合し、続く未同定のエンドヌクレアーゼ(RNase H活性を有するタンパク質)による相補鎖RNAの切断により一本鎖ASOが生成する。生成したASOは直接もしくはendosomeを経由して核内に取り込まれ、標的RNAと配列特異的に結合後、RNase Hによって標的RNAが切断され、遺伝子の発現が制御される。
研究成果の意義
今回、研究グループはHDOの活性に寄与する複数のタンパク質を同定しました。今後、同定したタンパク質とHDOの結合能の比較検討から、より効果が高く、副作用の少ないHDOをデザインすることが可能になると考えられます。さらに、同定タンパク質の細胞質内発現量を加味した標的組織の選別への応用も期待できます。また同定したタンパク質は生体内に存在する小さな核酸と結合する可能性も示唆され、核酸医薬開発の研究分野のみならず、生体内でのDNAの新たな機能の研究にも貢献することが期待されます。
また、研究グループではアルツハイマー病などの神経難病や新型コロナウィルス(COVID-19)の治療薬開発を行っており、本成果は、その創薬研究に役立つことも期待されます。
用語解説
- ※1アンチセンス核酸(ASO:antisense oligonucleotideの略)
- 細胞内に存在するRNAを標的とする核酸医薬で、ASOは1本鎖DNAを基本構造とする。塩基配列の相補性を示す標的RNAに特異的に結合し、Gapmer型の場合は標的RNAを一過性に分解して機能を抑制したり、発現を上昇させたりすることが可能である。既存の低分子医薬や抗体医薬では標的にできなかった疾患に対する分子標的治療薬の主流となりつつある。
- ※2ヘテロ核酸(HDO:heteroduplex oligonucleotidesの略)
- DNAからなるアンチセンス核酸と、その配列に相補的なRNA相補鎖から成る二本鎖核酸医薬(図1参照)。RNA相補鎖に様々なリガンド(図2参照)を結合させることで、標的臓器との親和性を調節することが可能である。本研究グループが独自に開発し、一般的に核酸医薬の主流である siRNA (small interfering RNA)、アンチセンス核酸に続く、第3の核酸医薬技術として注目されている。
- ※3 LNA
- Locked nucleic acidsの略で、RNAの2’位の酸素原子と4’位の炭素原子を架橋した構造をもつ人工核酸である。核酸分解酵素に対する安定性に優れ、標的RNAに対して非常に強い親和性を示すことが知られている。
- ※4 Gapmer
- 両端にLNAなどの人工化学修飾核酸を配し、それらに挟まれた中央部分はDNAから成るアンチセンス核酸(図1参照)。標的RNAの分解を目的とする。
- ※5 RNase H
- 主に細胞の核内に存在し、DNA/RNA 2本鎖構造を認識してそのRNA鎖のみを切断する酵素。
論文情報
- 掲載誌
- Nucleic Acids Research
- 論文タイトル
- Short DNA/RNA heteroduplex oligonucleotide interacting proteins are key regulators of target gene silencing
研究者プロフィール
横田 隆徳 (ヨコタ タカノリ) Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 教授
浅田 健 (アサダ ケン) Ken Asada
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任助教
研究領域
核酸医薬、遺伝子発現制御
お問い合わせ先
研究に関すること
東京医科歯科大学大学院 医歯学総合研究科
脳神経病態学分野 横田 隆徳 (ヨコタ タカノリ)
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当