2021-05-18 理化学研究所
理化学研究所(理研)開拓研究本部平野染色体ダイナミクス研究室の新冨圭史専任研究員と平野達也主任研究員の研究チームは、独自に開発した試験管内解析法を駆使し、主要な染色体構成タンパク質であるトポイソメラーゼⅡα(トポⅡα)[1]の機能を明らかにすることに成功しました。
本研究成果は、細胞の分裂期におけるトポⅡαの役割を示したものであり、染色体の構造と機能の理解につながると期待できます。
今回、研究チームは、まず、精製タンパク質からなる染色体再構成系[2]を用いて、トポⅡαの染色体軸への集積にC末端ドメイン(CTD)が重要であることを示しました。次に、トポⅡαは初期段階では異なる染色体間のDNAの絡まりをほどく一方で、後期段階になると染色体軸周辺で同一染色体内に絡まりを作ることを見いだしました。さらに、カエル卵抽出液[3]を使った実験により、トポⅡαが異常なクロマチン[4]凝集体の形成を抑制しすることも明らかにしました。これらの新しく発見されたトポⅡαの機能はCTDに依存するものでした。以上の結果を総合し、トポⅡαが染色体内の「密」な環境に入り込んで酵素活性を発揮するという新しい染色体構築メカニズムを提唱しました。
本研究は、オンライン科学雑誌『Nature Communications』(5月18日付:日本時間5月18日)に掲載されます。

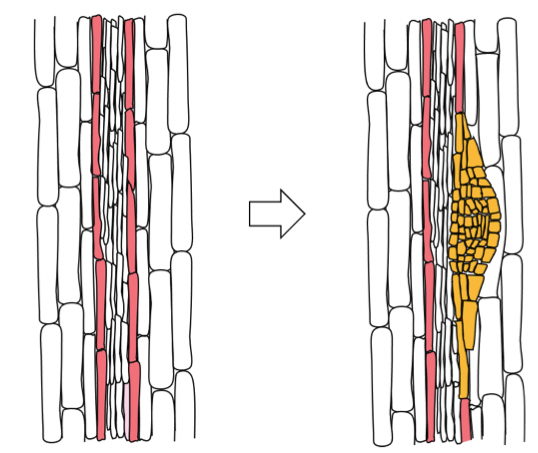
精製タンパク質を使って試験管内で再構成した染色体
背景
細胞が分裂する直前(分裂期)には、核膜が崩壊し、クロマチンから染色体が形作られます。このダイナミックかつ美しい現象が初めて顕微鏡下で観察されたのは、19世紀末、実に140年前にまでさかのぼります。20世紀半ばに、染色体の構成成分であるDNAが遺伝情報を担う物質であることが判明すると、分裂期における染色体構築は遺伝情報の正確な継承に不可欠なプロセスだと考えられるようになりました。
その後、染色体構築の分子メカニズムの研究が盛んになり、アフリカツメガエル卵抽出液を用いた生化学的解析によって染色体構築に不可欠なタンパク質としてコンデンシン[5]やトポイソメラーゼⅡα(トポⅡα)が同定されました。さらに、近年では、ゲノム科学から高分子物理学にわたる幅広い分野の協働によって、コンデンシンがDNAループ[6]を作り出すモータータンパク質であること、さらに、そうしたDNAループが、連続的、かつらせん階段状に配置されることによって染色体へと折り畳まれることなど、新しい知見が次々に報告されています。
しかし、コンデンシン以外の染色体構成タンパク質がどのように染色体構築に貢献しているかについては、いまだに不明な点が多く残されています。なかでも、トポⅡαは、転写やDNA複製など、DNAで起こるあらゆるプロセスに関与するといっても過言ではなく、染色体構築のみに焦点をしぼって解析することが困難だと考えられていました。
この技術的課題を克服するために、研究チームは2015年に、トポⅡαとコンデンシンⅠを含む6種類の精製タンパク質と精子核のDNAを使って、試験管内に染色体を再構成する方法を開発しました注1)。この再構成系は、染色体タンパク質の機能だけでなく、染色体周囲の物理化学的要素が及ぼす影響についても解析できる手法として注目されています。
注1)Shintomi, K., Takahashi, T. S., and Hirano, T.”Reconstitution of mitotic chromatids with a minimum set of purified factors.” Nat. Cell Biol. 17, 1014-1023 (2015).
研究手法と成果
染色体再構成系で出発材料として用いるアフリカツメガエルの精子核には、染色体の基となる18本の長いDNA(平均すると、1本当たり約1億6000万塩基対)が、互いに絡まりながら収納されています。再構成の過程では、このコンパクトな核から個別化された18本の染色体が現れます(図1)。
まず、研究チームは、トポⅡαの有無の異なる再構成反応を比較することにより、トポⅡαが染色体の個別化に中心的な役割を担っていることを確かめました。次に、再構成系に含まれる電解質の濃度を操作することによって、トポⅡαの詳細な機能解析を試みました。その結果、トポⅡαによる染色体の個別化は、ATPやマグネシウムイオンの濃度に依存することが示されました。さらに、カリウムイオンの濃度が細胞内濃度に近いときのみ、トポⅡαの染色体軸への集積が見られ、個別化した染色体が太くなり(幅広化)、細胞内で見られる正常な染色体の形状に近づくことを明らかにしました。一方、人為的に改変したトポⅡαを用いた再構成実験によって、トポⅡαのC末端ドメイン(CTD)は、染色体の個別化は必要でないものの、トポⅡαの軸集積と染色体の幅広化に不可欠であることを見いだしました。
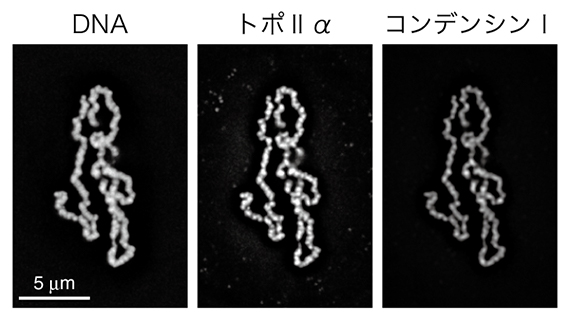
図1 再構成系した染色体
6種類の精製タンパク質とカエルの精子核を22℃で2時間インキュベーションすると、染色体が再構成される。DNA、トポⅡα、コンデンシンⅠ、それぞれを異なる蛍光色素を使って標識し、顕微鏡下で観察した。
続いて、染色体上でのトポⅡαの作用メカニズムを詳しく理解するために、より精密な実験操作が可能なトポⅡαの酵素活性検定を行いました。まず、あらかじめ絡まりあった環状DNAを基質として、DNAに対して少量のトポⅡαを加えました。この「疎」な条件では、CTDの有無に関係なく、トポⅡαは効率的にDNAの絡まりをほどけることが示されました。次に、絡まり合っていない環状DNAを基質として用い、それに対して過剰量のトポⅡαを加えました。興味深いことに、この「密」な条件では、CTDを持つトポⅡαのみがDNA同士に絡まりを作る活性を持つことが示されました(図2)。
ここまでに得られた結果を総合することにより、染色体構築におけるトポⅡαの作用モデルが提唱できます。まず、トポⅡαは、異なる染色体間の絡まりをほどくことにより個別化を促すという従来から予想されていた役割を果たします。次に、CTDを使って染色体軸に集積し、さらに同一染色体内に絡まりを作ることによって染色体の幅広化を促進するという第二の役割を果たしているようです。
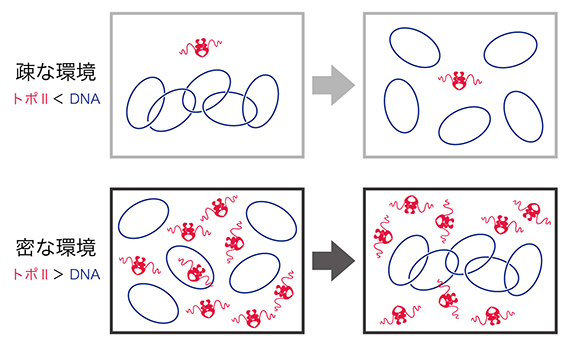
図2 環境に依存したトポⅡαの反応
精製トポⅡαと環状DNAをインキュベーションすると、環境依存的にDNAの絡まりをほどいたり、絡まりを作ったりできる。それぞれの反応で用いた環境は、染色体再構成における個別化と幅広化が起こるときの環境に対応していると考えられる。
最後に、アフリカツメガエル卵抽出液を用いて、トポⅡαCTDの役割を別の視点から検討しました。既に研究チームでは、カエル卵抽出液とマウスの精子核を組み合わせ、ヌクレオソーム[4]形成を抑制した特殊な条件下でも染色体様構造を構築できることを報告していました注2)。この特殊な条件下で、さらにトポⅡαを除いた時の影響を解析しました。すると、これまで報告されたことのない奇妙な形状のクロマチン凝集体が観察されました。研究チームは、このクロマチン凝集体を線香花火に似ていることからsparkler(スパークラー)と命名しました(図3)。
さらに、この後に野生型のトポⅡαを加えると、sparklerが崩壊し、ヌクレオソームを含まない(そのためコンパクトさに欠ける)染色体へと変換されました。一方、CTDを欠いたトポⅡαでは、そうした活性が著しく減弱していることが分かりました。これらの結果から、トポⅡαは、染色体構築のさまざまな局面において、CTDを活用してクロマチン内の混雑した「密」な環境に入り込み、そこで適切に酵素活性を発揮すると考えられます。
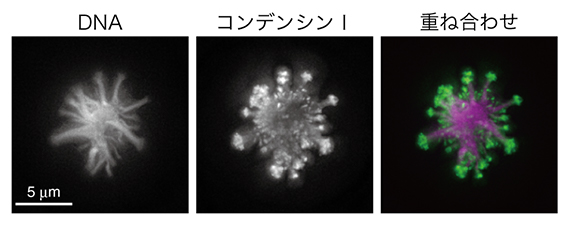
図3 奇妙な形状のクロマチン凝集体 Sparkler
カエル卵抽出液無細胞系において、ヌクレオソーム形成を抑制した条件でトポⅡαを除去すると線香花火のような形状のクロマチン凝集体(sparkler)が形成される。DNAとコンデンシンⅠを標識した蛍光顕微鏡観察像を示す、右はその重ね合わせ像(DNAをマゼンタ、コンデンシンⅠを緑で示す)。
注2)Shintomi K., Inoue F., Watanabe H., Ohsumi K., Ousugi M., and Hirano T. “Mitotic chromosome assembly despite nucleosome depletion in Xenopus egg extracts.” Science. 356, 1284-1287 (2017)
今後の期待
当該研究分野では、トポⅡαが染色体軸に集積して構造的要素して働くこと、あるいは、酵素として機能することのどちらが重要なのかという議論が続いていました。今回の研究成果は、こうした択一的な見方を一歩進めて、周囲の環境の混雑度に応じてトポⅡαがDNAへの絡まりの解消と導入という異なる酵素反応を触媒することの重要性を示したものです。コンデンシンも、「疎」な環境ではDNAループを作るのに対し、「密」な環境ではDNAに超らせんを導入するというように、周辺環境よって異なる振る舞いを示すことが知られています。今後は、染色体軸という密な環境において、トポⅡαとコンデンシンの両者が共存することでDNAやクロマチンの構造がどのように変換されるのかを理解することが重要な課題になると考えられます。
また、研究チームでは、今回の研究成果が生殖支援技術にもインパクトを与えると期待しています。核移植によるクローン個体を作出するときの重要な経験則として、移植された核が、いったん、移植先の卵の中で分裂期染色体へと変換される必要があることが知られています。1997年にクローン羊の作出が報告されて以来、その事実は「全能性とは何か?」という生物学における本質的な問題を投げかけ続けています。この複雑そうな問題を解く鍵は、実は、単純な染色体再構成系を用いた今後の研究から見つかるのかも知れません。
補足説明
1.トポイソメラーゼⅡ
ATPの加水分解依存的にDNAの2本鎖の切断と再結合を触媒する酵素。DNAが切断された間に、別のDNAを通過させることにより、DNAのトポロジー(ねじれや絡まり)を変化させる。細菌から、古細菌、真核生物(動物、植物など)にいたる、全ての生物界に存在しているタンパク質でもある。脊椎動物ではαとβの2種類のアイソタイプが存在し、トポⅡαのみが分裂期の構成因子として働く。
2.染色体再構成系
分裂期細胞内で起こる染色体構築過程を、現在考えられ得る最小の要素を用いて試験管内で再現できる実験系。具体的には、6種類の精製タンパク質(トポⅡ、コンデンシンⅠ、コアヒストン、3種類のヒストンシャペロン[Npm2、Nap1、FACT])、界面活性剤で除膜処理をしたアフリカツメガエルの精子核、ATPを試験管内で混和し、22℃でインキュベーションする。
3.カエル卵抽出液
カエル(アフリカツメガエル)の卵を遠心破砕して得られる抽出液。実質的にほとんど希釈されていない卵細胞質と核の成分が含まれており、受精、細胞分裂周期の進行にともなう細胞内の生化学反応を試験管内で再現できる。1983年にトロント大学の増井禎夫博士によって開発され、その後のDNA複製、染色体構築の研究の発展に大きく貢献した。
4.クロマチン、ヌクレオソーム
真核生物のゲノムDNAは、さまざまなタンパク質と相互作用したクロマチンと呼ばれる構造として細胞内に存在している。クロマチンの基本構造単位はヌクレオソームと呼ばれており、コアヒストン8量体にDNAが巻きついた構造をしている。
5.コンデンシン
染色体構築に中心的な役割を果たすタンパク質複合体。二つの触媒サブユニットは、カエル卵抽出液作った染色体を構成する主要なタンパク質成分として、1994年に平野達也主任研究員によって初めて発見された。その後1997年に、これらの触媒サブユニットと三つの制御サブユニットが結合して巨大な複合体を形成していることがわかった。多くの真核生物では、異なる制御サブユニットを持つコンデンシンⅠとコンデンシンⅡが存在している。
6.DNAループ
DNA上を動く活性を持つモータータンパク質が、DNAを押し出すことによって作られるループ上の構造。モータータンパク質はループの根本に位置する。およそ20年前に、DNAループによって染色体の構造や機能が制御されるモデルが提唱された。近年では、コンデンシンに代表されるSMCファミリーのタンパク質がモーターとして働くことが相次いで証明され、実際にループを作る様子を顕微鏡下で観察した例が報告されている。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「発展型再構成系を用いた分裂期染色体構築メカニズムの解析(研究代表者:新冨圭史)」、同新学術領域研究(研究領域提案型)「核の再プログラム化のin vitro再構成(研究代表者:新冨圭史)」、同学術変革研究(A)「分裂期染色体のモダリティ(研究代表者:平野達也)」、同基盤研究(S)「コンデンシンIとIIの分子メカニズムの解明(研究代表者:平野達也)」による支援を受けて行われました。
原論文情報
Keishi Shintomi and Tatsuya Hirano, “Guiding functions of the C-terminal domain of topoisomerase II advance mitotic chromosome assembly”, Nature Communications, 10.1038/s41467-021-23205-w
発表者
理化学研究所
開拓研究本部 平野染色体ダイナミクス研究室
専任研究員 新冨 圭史(しんとみ けいし)
主任研究員 平野 達也(ひらの たつや)
報道担当
理化学研究所 広報室 報道担当