「コンデンシン」が染色体の形成と分離に果たす役割
2018-06-19 理化学研究所
理化学研究所(理研)理論科学連携研究推進グループ階層縦断型理論生物学研究チームの境祐二特別研究員(研究当時)、開拓研究本部望月理論生物学研究室の立川正志専任研究員、望月敦史主任研究員らの研究グループ※は、細胞周期[1]の分裂期に見られる染色体[2]の形成と分離のダイナミクスについて数理モデル[3]を用いて解析し、染色体の形成と分離において「コンデンシン[4]」が果たす役割を理論的に解明しました。
本研究成果は、理論と実験のグループが協力することにより、長年の謎であった染色体の形成と分離のダイナミクスの完全解明に貢献すると期待できます。
今回、研究グループは、染色体凝縮に中心的な役割を果たすタンパク質複合体であるコンデンシンの機能を、クロマチン[2]との相互作用として表現する数理モデルを構築しました。そして分子動力学計算[5]を用いてシミュレーションすることで、染色体の形成や分離のダイナミクスにコンデンシンが果たす役割について解析しました。その結果、染色体の形態と分離速度の間に強い相関があることが明らかになりました。これは、コンデンシンが棒状の染色体の形成を通して、染色体分離のダイナミクスを制御している可能性を示しています。
本研究は、米国の科学雑誌『PLOS Computational Biology』オンライン版(6月18日付け:日本時間6月19日)に掲載されます。
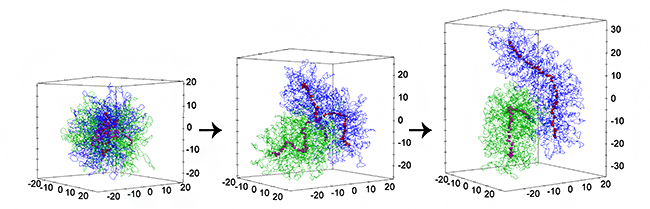
図 シミュレーションによる細胞分裂期における染色体の形成や分離のダイナミクス
※研究グループ
理化学研究所
理論科学研究推進グループ(iTHES) 階層縦断型理論生物学研究チーム
特別研究員(研究当時) 境 祐二(さかい ゆうじ)
(現東京大学大学院 医学研究科 助教、理化学研究所 開拓研究本部 望月理論生物学研究室 客員研究員)
開拓研究本部
望月理論生物学研究室
専任研究員 立川 正志(たちかわまさし)
主任研究員 望月 敦史(もちづき あつし)
平野染色体ダイナミクス研究室
専任研究員 木下 和久(きのした かずひさ)
主任研究員 平野 達也(ひらの たつや)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究C「組換えコンデンシン複合体を用いたM期染色体構築の分子解剖(研究代表者:木下和久)」、同新学術領域研究(研究領域提案型)「分裂期染色体の3D構築原理(研究代表者:平野達也)」、同新学術領域研究(研究領域提案型)「細胞内環境が内膜系の3D形態を生み出すロジック(研究代表者:立川正志)」による支援を受けて行われました。
背景
生命の設計図(遺伝情報)であるDNAは、細胞核内でヒストンなどのタンパク質と結合し、クロマチンという繊維状の構造を形成しています。クロマチンは、細胞周期の間期(分裂期ではない時期)には細胞核内に広がり、互いに絡まり合った状態になっています。そして分裂期に入ると、凝縮して特徴的な棒状形態の 染色体になることで、絡まりがほどけて互いに分離します(図1)。この染色体凝縮は細胞周期における最も劇的な現象の一つであり、100年以上前に発見されて以来、人々の関心を集めてきました。しかし、長年の研究にもかかわらず、どのようにして細長い糸状のクロマチンから棒状の染色体が形成されるのか、どのようにして染色体は絡まらずに分離されるのかという根本的な問題は解かれないままでした。
1997年に平野達也主任研究員により発見された「コンデンシン」は注1)、近年の研究により染色体凝縮に中心的な役割を果たすタンパク質複合体であることが確立し(図1)注2)、さらに詳しい分子機能が明らかにされつつあります。また、染色体の形成と分離のダイナミクスも、コンデンシンの機能との関連から調べられています。しかし、ミクロなコンデンシンとマクロな染色体との間にはサイズに大きな隔たりがあるため、コンデンシンがどのように染色体凝縮を制御しているかは難しい問題です。
クロマチンはDNA鎖高分子であることから、互いに密に絡み合った状態からほどけて分離した状態に変化するダイナミクスは、高分子物理学の観点から研究することができます。そこで研究グループは、実験から分かりつつあるコンデンシンの機能を数理モデル化し、高分子物理学の手法と組み合わせることで、染色体の凝縮と分離のダイナミクスの解明に挑みました。
注1)T. Hirano, R. Kobayashi, M. Hirano. Condensins, chromosome condensation protein complexes containing XCAP-C, XCAP-E and a Xenopus homolog of the Drosophila Barren protein. Cell, 89 (1997), pp. 511-521.
注2)T. Hirano. Condensin-based chromosome organization from bacteria to vertebrates. Cell, 164 (2016), pp. 847-857.
研究手法と成果
まず、研究グループは、コンデンシンの機能を数理モデルとして記述しました。これまでの研究からコンデンシン分子には、クロマチン繊維に連続的なループ構造を形成する機能(「ループ形成力」)と、近接したコンデンシン同士が互いに引き合う機能(「コンデンシン間引力」)があることが示されています。クロマチン繊維の高分子モデルに、このループ形成力とコンデンシン間引力を持つコンデンシンのモデルを組み込み(図2)、分子動力学計算を用いてシミュレーションを行うことで、これらのコンデンシンの分子機能が染色体の形成と分離のダイナミクスに与える影響について解析しました。
図3はシミュレーション結果の一例です。最初は、2本のクロマチン繊維が互いに絡まり合って球状に広がっていますが(図3A, B)、時間が経つにつれて徐々に分離するとともに染色体固有の棒状の凝集体を形成する様子を再現していることが分かります(図3A, C, D)。
また、コンデンシンの二つの分子機能の強さをさまざまに変えてシミュレーションを行ったところ、染色体の分離と細長い形状という、一見別々の振る舞いに見える二つの現象の間に次の関係があることが分かりました。①ループ形成力とコンデンシン間引力はともに、染色体中心のクロマチンの密度を高める働きをします。②このようにして作られた高密度のクロマチン領域が生み出す排除体積力(押し合いへし合いの力)が、固く真っすぐな棒状凝集体を作り出すとともに、お互いを排除し合って速やかな分離を可能にします。
つまり染色体の分離と細長い形状は、染色体密度という物理的性質を介してコンデンシンにより制御されているのです。そのため、コンデンシンの分子機能の強さをさまざまに変化させても、図3Eに示すように、染色体の細長さと分離速度は、強い相関をもって変化することが分かりました。
さらに、本研究で構築した染色体凝縮の数理モデルは、コンデンシンのループ形成力とコンデンシン間引力の強さを変化させることで、球状から棒状まで多様な形態の染色体を形成できることが分かりました。そして、このモデルに基づいて、コンデンシンの部分欠損複合体によって形成される異常な染色体構造をシミュレーションで再現することにも成功しました(図4)。
今後の期待
数理的手法を用いることで染色体形成の分子動力学を明らかにした本研究は、染色体の形成と分離という細胞システムにおける重要なイベントが染色体の物理的性質を介して互いに関係していることを示しています。その物理的性質をコンデンシンのループ形成力やコンデンシン間引力といった機能が制御していると考えられます。
本研究の数理モデルの妥当性は、コンデンシンを実験的に制御することにより確かめることが可能です。理論と実験のグループが協力することにより、長年の謎であった染色体の形成と分離のダイナミクスを完全に解明することが近い将来可能になると考えられます。
原論文情報
Yuji Sakai, Atsushi Mochizuki, Kazuhisa Kinoshita, Tatsuya Hirano, Masashi Tachikawa, “Modeling the functions of condensin in chromosome shaping and segregation”, PLOS Computational Biology, 10.1371/journal.pcbi.1006152
発表者
理化学研究所
理論科学連携研究推進グループ(iTHES) 階層縦断型理論生物学研究チーム
特別研究員(研究当時) 境 祐二(さかい ゆうじ)
(現 東京大学 大学院医学系研究科 助教、理化学研究所 開拓研究本部 望月理論生物学研究室 客員研究員)
主任研究員研究室 望月理論生物学研究室
専任研究員 立川 正志(たちかわ まさし)
主任研究員 望月 敦史(もちづき あつし)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 細胞周期
- 真核細胞は、細胞分裂を行う分裂期とそれ以外の時期である間期を繰り返すことによって増殖する。この周期性を細胞周期と呼ぶ。多くの体細胞は細胞周期から外れた静止期にあり、再び細胞周期に戻って増殖したり分化したりする。
-
- 染色体、クロマチン
- 染色体は、真核細胞にあるゲノムDNAとヒストンによって構成される高分子複合体。ヒトの体細胞は46本の染色体を持つ。細胞周期の間期では、太さ約30ナノメートル(nm、1nmは10億分の1m)の糸状のクロマチンの状態で細胞核内に広がっている。間期ではクロマチンどうしは絡まった状態であると考えられているが、細胞分裂時になると凝縮して棒状の染色体が形成されると同時に、絡まり合いが解けて分離が進行する。
-
- 数理モデル
- 時間変化する複雑な現象の一面を簡略化した形で表現し、微分方程式など数式を用いて現象を捉え、論理的に記述すること。
-
- コンデンシン
- 細胞分裂時の染色体凝縮に中心的な役割をするタンパク質複合体。電子顕微鏡で見るとクリップのような形をしている。クロマチン繊維をループ状につなぎとめて、規則的に密に並べる役割を担うと考えられている。
-
- 分子動力学計算
- 多体粒子の時間発展を、ニュートン方程式やランジュバン方程式を数値的に解いて求める方法。材料科学や生体分子などさまざまな系で用いられている。
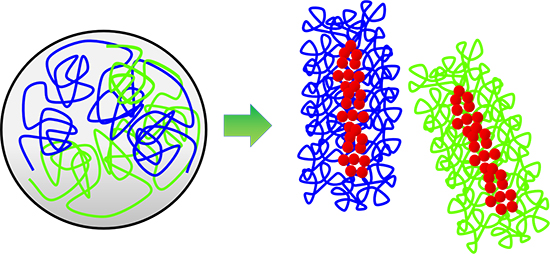
図1 染色体形成の模式図
細胞周期の間期に細胞核内に広がり、互いに絡まり合った状態にあったクロマチン繊維(左、青と緑の線)は、分裂期に入ると、凝縮して棒状の染色体を形成することで、絡まりがほどけて互いに分離する(右)。この染色体形成と分離に、コンデンシン(赤い丸)が中心的な役割を果たしていることが明らかにされている。
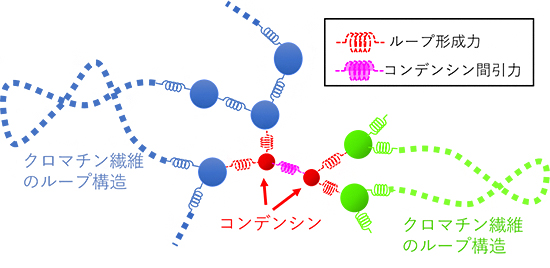
図2 クロマチン繊維とコンデンシンのモデル
バネとビーズの鎖で表現したクロマチン繊維の物理モデル(青、緑)にコンデンシン(赤)を加え、クロマチン-コンデンシン間にループ形成力(赤いバネで表現)を、コンデンシン同士の間に引力(ピンク色のバネで表現)を与えることで、コンデンシンの分子機能をモデル化した。ループ形成力によりクロマチン繊維は束ねられ、ループ構造が形成されている。コンデンシン間引力は、一定距離以内に近づいたコンデンシン同士に働く力である。
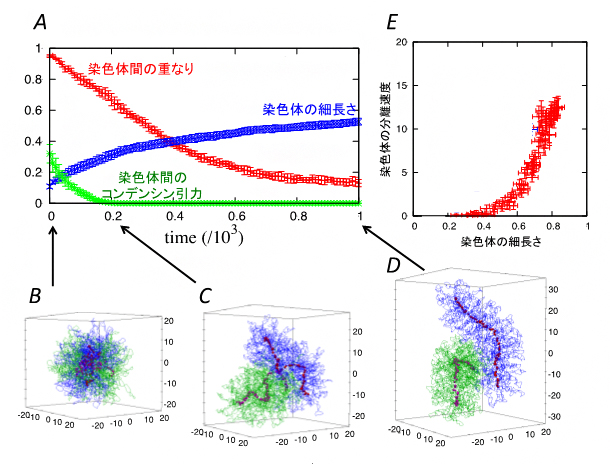
図3 シミュレーションによる染色体の形成と分離のダイナミクス
最初は複雑に絡まり合っていた2本のクロマチンが、時間が経つにつれ、棒状の染色体を形成するとともに、互いの絡まりが解け分離する様子。Aは、染色体間の重なり、染色体の細長さ、異なる染色体上のコンデンシン間引力の時間変化を示している。B–Dは、各時間での2本のクロマチン(青、緑)、コンデンシン(赤)のスナップショットである。Eは、シミュレーションでコンデンシンのループ形成力やコンデンシン間引力をさまざまに変えたときの染色体の細長さと分離速度の相関を示している。
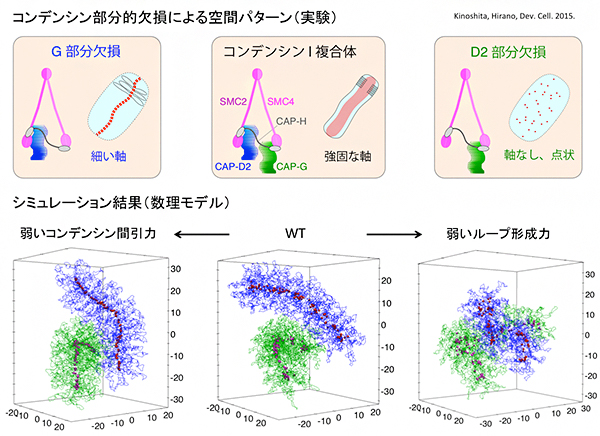
図4 実験で観測されたコンデンシン部分欠損による空間パターンとシミュレーション結果
木下らの実験注3)により、完全なコンデンシンI複合体(上段中央囲みの左)は強固な染色体軸として集合し、染色体自体もコンパクトに折り畳まれる(上段中央囲みの右)が、CAP-GサブユニットやCAP-D2サブユニットを欠損したコンデンシンI複合体では染色体の折り畳みが不十分となり、通常より細い軸(CAP-Gサブユニット欠損の場合、上段左囲み)や軸が消失し点状のコンデンシン集合パターン(CAP-D2サブユニット欠損の場合、上段右囲み)が現れることが示された。本研究の数理モデルでコンデンシンの示す力の強さを変えることにより、これらの部分欠損コンデンシンが生み出す染色体構造とコンデンシン集合パターンの再現に成功した(下段)。
注3)K. Kinoshita, T. J. Kobayashi, T. Hirano. Balancing act of two HEAT subunits of condensin I support dynamics assembly of chromosome axes. Developmental Cell, 33 (2015), pp. 94-106.