2021-06-22 理化学研究所,順天堂大学
理化学研究所(理研)脳神経科学研究センター精神疾患動態研究チームの西岡将基研究員(研究当時、現順天堂大学医学部精神医学講座准教授)、加藤忠史チームリーダー(研究当時、現順天堂大学医学部精神医学講座教授)、分子精神病理研究チームの髙田篤チームリーダーらの共同研究グループは、双極性障害[1]患者における「デノボ変異[2](患者本人からは検出されるが両親からは検出されない新生の変異)」を包括的に解析し、全身の細胞に存在する先天的デノボ変異と一部の細胞にのみ存在する後天的デノボ変異がともに双極性障害に関連することを明らかにしました。
本研究成果は、双極性障害の病態理解を進め、病態に基づく治療法開発の基礎的知見になると期待できます。
デノボ変異は進化の過程において自然選択をほとんど受けないため、疾患の発症に大きく関連する変異が含まれると考えられています。今回、共同研究グループは、双極性障害研究としては世界最多の354家系のデノボ変異データを解析しました。その結果、双極性障害患者では、タンパク質の機能喪失変異[3]が負の自然選択[3]を受けやすい(つまり機能的に重要な)遺伝子に、先天的な機能喪失デノボ変異が多いこと、先天的な機能障害デノボ変異はシナプス[4]・イオンチャネル[4]関連遺伝子に多く存在することを見いだしました。さらに、神経発達障害[5]の原因遺伝子に後天的な機能障害デノボ変異が多いことを示しました。
本研究は、オンライン科学雑誌『Nature Communications』(2021年6月18日付)に掲載されました。
背景
双極性障害は、抑うつ状態と躁状態が交互に繰り返される精神疾患の一つで、人口の約1%の人が罹患する比較的頻度の高い疾患です。うつ状態による苦しみから自分自身を傷つけたり、気分の高揚・攻撃性の高まりから人間関係を壊してしまったりと、本人および家族の社会生活に大きな影響を及ぼします。
現在、双極性障害の治療法としては炭酸リチウムの投与などありますが、有効ではない場合や、これらの治療薬による副作用から使用継続が難しいといった問題もあります。これらの治療薬は臨床現場において経験的に有効性が見いだされ、その後、効果が実証されたものであり、病態メカニズムの理解に基づいて開発されたわけではないことから、病態とそのメカニズムを解明し、革新的な治療・予防法を開発することが求められています。
双極性障害は家族や親族で共通して見られることが多く、遺伝情報が発症や病態に関与すると考えられています。一卵性双生児における双極性障害の一致率は40%以上であることから、遺伝情報によって疾患原因の大部分を説明できると考えられ、これまで多くの遺伝学的研究が行われてきました。
さまざまな疾患に対する遺伝学的研究には、大きく分けて二つのアプローチがあります。一つ目は一般集団にも多く見られるありふれた遺伝子(DNA配列)の個人差に注目して、その関与を網羅的に解析するアプローチで、これにより疾患に関連する遺伝情報の一部が明らかになっています。二つ目は、一般集団では稀にしか存在しない遺伝子の個人差に注目することで、疾患に関わる遺伝情報を検出するアプローチです。双極性障害について、後者のアプローチによる研究は、これまで十分な規模では行われてきませんでした。そこで、共同研究グループは、極めて稀に起こる「デノボ変異(患者本人からは検出されるが両親からは検出されない新生の突然変異)」に焦点を当てました。
研究手法と成果
ヒトの遺伝情報は父親と母親から受け継いだものが大半で、その組み合わせにより個々人の特徴が現れます。しかし、父親の精子と母親の卵が形成される過程や発生発達の過程において、一定の割合でデノボ変異が生じます(図1)。デノボ変異には、精子・卵の形成過程で生じる先天的なデノボ変異と、受精後の発生・発達の課程で生じる後天的なデノボ変異があります。一般的に、父親と母親から受け継ぐ変異は世代を経るごとに多くの人に伝わり、進化の過程で正や負の自然選択により、その変異の数が増えたり減ったりすることで、集団内へと一部が定着していきます。一方で、デノボ変異は上記のような「自然選択と定着の繰り返し」という過程を経ず、一般集団にはほとんど見られない極めて稀な変異が含まれます。世界で1人だけが持つというデノボ変異もあります。
疾患の発症に大きく関連する変異は負の自然選択(自然淘汰)を受けるため、一般集団から見いだされることは極めて稀です。一方、デノボ変異は自然選択をほとんど受けないため、疾患の発症に大きく関連する変異が潜在的に含まれていると考えられ、疾患に関連する変異の検索に重要な標的となります。実際に、自閉症スペクトラム障害や統合失調症などの精神疾患を対象とした大規模ゲノム研究では、稀なデノボ変異が疾患リスクに関与することが近年報告されています。注1-2)
注1)Satterstrom, F.K., et al. Large-Scale Exome Sequencing Study Implicates Both Developmental and Functional Changes in the Neurobiology of Autism. Cell 180, 568-584 e523 (2020)
注2)Howrigan, D.P., et al. Exome sequencing in schizophrenia-affected parent-offspring trios reveals risk conferred by protein-coding de novo mutations. Nature Neuroscience. 23, 185-193 (2020).
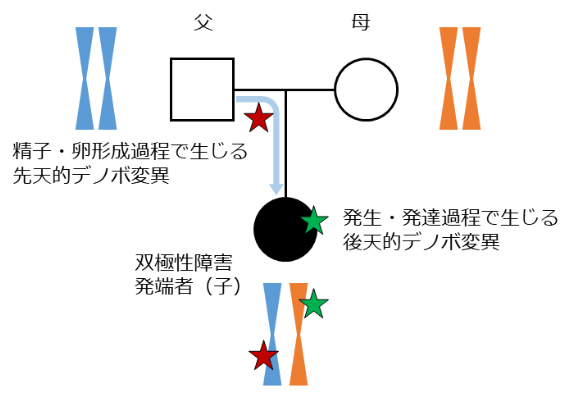
図1 本研究の標的であるデノボ変異の概略図
子どもの遺伝情報のほとんどは父親か母親に由来するが、なかには父親・母親にはない新生の突然変異が生じ、この変異をデノボ変異と呼ぶ。デノボ変異は子どもの患者本人からは検出されるが、両親からは検出されない。先天的なデノボ変異(赤星印)と後天的なデノボ変異(緑星印)の2種類がある。
共同研究グループはこのデノボ変異に注目し、双極性障害の病態に関連する遺伝情報を探索しました。ゲノム遺伝子上のエクソンと呼ばれるタンパク質をコードする領域における変異は、タンパク質の機能を喪失させたり、本来の機能を低下させたり、逆に必要以上に機能を亢進させることがあり、疾患に関連するものが多く含まれることから、エクソンに存在するデノボ変異を網羅的に検出しました。全国の双極性障害研究者が参加している、患者・家族と研究者のネットワーク「双極性障害研究ネットワーク[6]」などを通じて参加者を募り、また過去の研究データも活用し、デノボ変異解析としては世界最多の354家系のデータを用いて研究しました。
まず、双極性障害患者とその両親から提供された唾液や血液から、ゲノム遺伝子上のエクソン領域のDNAを濃縮し、次世代シーケンサー[7]を用いてそれらのDNA配列を決定しました。得られたDNA配列情報をリファレンスゲノム[8](ヒトの一般的なDNA配列情報)と対比させ、配列情報の違いを抽出しました。抽出した配列情報を患者と両親で比較し、患者だけに存在する変異を「全身の細胞に存在する先天的なデノボ変異(生殖細胞系列変異)」として同定しました。
同定した双極性障害の先天的デノボ変異データと同じ解析方法で取得した健常者の先天的デノボ変異データを比較したところ、両群でデノボ変異全体の頻度に有意な差はありませんでした。そこで、解析対象を次の二つに絞り込みました。
1)大規模公開ゲノムデータベース[9]を用いて、精神疾患を持たない集団には存在しない極めて稀なデノボ変異のみを解析対象とする
2)ヒト進化の過程で、タンパク質の機能喪失変異が負の自然選択を受けている(つまり機能的に重要である)と考えられる遺伝子群(3,488遺伝子)のみを解析対象とする
解析の結果、双極性障害患者(257人)では、タンパク質の機能喪失デノボ変異が有意に多いことが分かりました(図2上、多重比較補正後P値[10] 0.0410)。また、重症度が高い双極Ⅰ型障害と統合失調症の症状が併存する統合失調感情障害の患者(203人)では、機能喪失デノボ変異が特に多いことが分かりました(図2下、多重比較補正後P値 0.0194)。
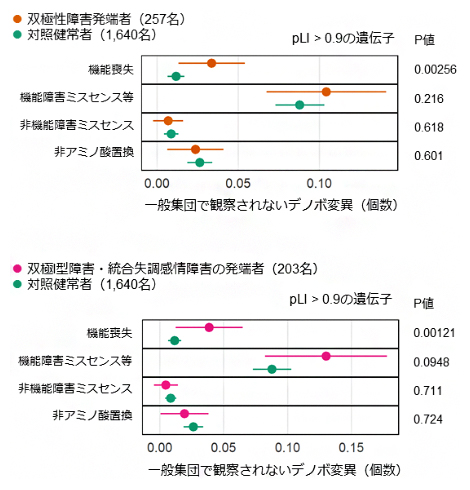
図2 機能喪失変異により負の自然選択を受けやすい遺伝子におけるデノボ変異の数の比較
上:双極性障害患者では、タンパク質の機能喪失デノボ変異が有意に多い。
下:双極I型障害または統合失調感情障害の患者では、タンパク質の機能喪失デノボ変異が著しく多い。
次に、精神疾患を持たない集団にはない極めて稀なデノボ変異のうち、タンパク質の機能障害をもたらすと予想される変異(機能障害デノボ変異)がどのような遺伝子に存在するか統計的に解析しました。すると、機能障害デノボ変異は、シナプス前アクティブゾーンや神経伝達物質といったシナプスに関わる遺伝子や、二価金属イオン(カルシウムイオンなど)のイオンチャネルに関わる遺伝子など、神経細胞の中心的な機能を担う生物学的経路に関与する遺伝子に多いことが分かりました(図3)。このようなシナプス・イオンチャネル関連遺伝子はこれまでにも双極性障害との関連が重ねて報告されており、これを支持するデータが得られたことから、双極性障害の病態理解がさらに一歩進んだといえます。
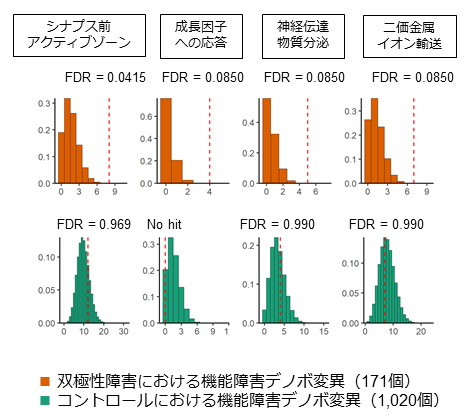
図3 双極性障害におけるタンパク質の機能障害デノボ変異の生物学的特徴
双極性障害・コントロールの各群で認められた機能障害デノボ変異の数をもとに、ランダムにエクソン上デノボ変異を発生させるシミュレーションを100万回行った。その結果について、四つの生物学的経路に関する遺伝子上にデノボ変異が生じる個数をx軸に、その頻度をy軸にグラフ化した。赤点線は、実際に双極性障害・コントロールの各群において観測された生物学的経路上のデノボ障害変異の数を示す。双極性障害では、シナプス前アクティブゾーンなど四つの生物学的経路において、ランダムなシミュレーションでは出現しえないほど多い数のデノボ障害変異が観測された。すなわち、双極性障害のデノボ障害変異はシナプス・イオンチャネル関連の遺伝子に多いといえる。
さらに、脳神経組織においてどのような細胞種に双極性障害に関連する候補遺伝子が多く発現しているかを明らかにするために、稀なタンパク質の機能障害デノボ変異を持つ遺伝子の特徴を単一細胞RNAシーケンス[11]のデータと併せて解析しました。UMAP[12]という機械学習手法を用いて、気分障害(うつ病や双極性障害など、気分の変動を主な症状とする精神疾患を総称して気分障害と呼ぶ)との関連が指摘されている前帯状皮質[13]における一細胞RNAシーケンスデータを解析した結果、細胞種を16個のクラスターに分けることができました(図4a)。
それぞれのクラスターについて解析すると、興奮性神経細胞[14]のある一群(c8)において強く発現する遺伝子に、上記の機能障害デノボ変異が多く見られました(図4b)。この興奮性神経細胞の一群では、シナプス・カルシウムチャネル遺伝子に加えて、発達障害の原因遺伝子や双極性障害のゲノムワイド関連解析(GWAS)[15]で見いだされた遺伝子の発現も多いという特徴がありました(図4c)。そのため、この一群の興奮性神経細胞は双極性障害の病態において特に重要な役割を果たしている可能性があり、今後の病態解明研究における新たなヒントになると考えられます。
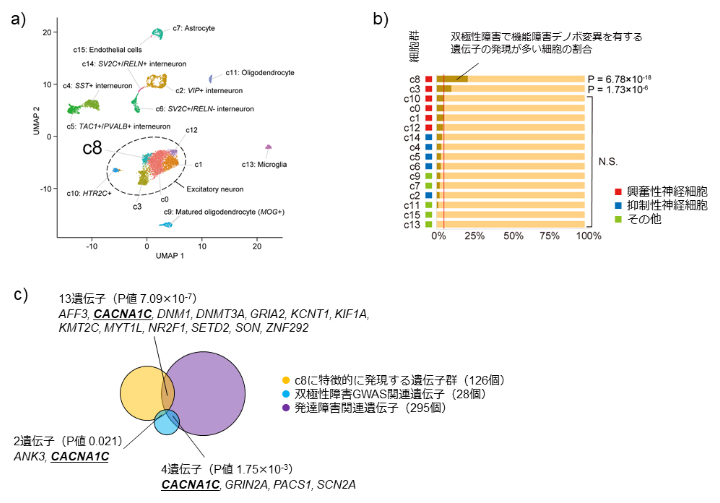
図4 双極性障害の機能障害デノボ変異を持つ遺伝子と細胞種の関係
(a)単一細胞RNAシーケンスデータをUMAPという手法で16群(c0-c15)に分けた状態を図解したもの。黒破線で囲まれた部分には興奮性神経細胞の各群が含まれる。
(b)双極性障害の機能障害デノボ変異は、興奮性神経細胞サブタイプの一種(c8)で発現する遺伝子に多く見られる。
(c)興奮神経細胞のサブタイプc8で特徴的に発現する遺伝子(黄)は、双極性障害のゲノムワイド関連解析(GWAS)で見いだされた関連遺伝子(青)や、重度発達障害と関連する遺伝子(紫)と重複する遺伝子が多く、c8の特性と考えられる。中でもCACNA1Cというカルシウムイオンチャネルの一つをコードする遺伝子は、三つの遺伝子群の重複として見いだされた。
また、双極性障害デノボ変異が観察された個々の遺伝子に注目した解析も行いました。機能喪失により進化の過程で負の自然選択を受けやすい遺伝子の中に、ヒストン[16]をメチル化するタンパク質をコードするKMT2C遺伝子[16]があり、この遺伝子の機能喪失デノボ変異は知的障害や特異顔貌を伴う神経発達障害(Kleefstra症候群)の原因となることが知られています。一方、本研究でKMT2C遺伝子に機能喪失デノボ変異を持つことが分かった双極性障害患者には、Kleefstra症候群の症状はありませんでした。
この不一致の原因を明らかにするため、同定されたデノボ変異について詳しく調べたところ、このデノボ変異は体の細胞ごとに変異の有無が異なる「モザイク状態」で検出され、発生発達の過程で生じた「一部の細胞にのみ存在する後天的なデノボ変異(体細胞変異)」であることが分かりました(図5a,b)。
この発見をきっかけに、後天的デノボ変異についても、特化した解析アルゴリズムを用いて網羅的な解析を実施しました。その結果、双極性障害患者では、先天的デノボ変異が神経発達障害の原因であることが知られている遺伝子(例えばKMT2C)に、稀で後天的な機能障害デノボ変異が有意に多い(P値 0.00135)ことが分かりました(図5c)。また、患者2人から独立して神経発達障害(Floating-Harbor症候群)の原因遺伝子であるSRCAP遺伝子[17]に後天的機能障害デノボ変異が検出されました。SRCAP遺伝子は、後天的デノボ変異が双極性障害と関連する遺伝子の有力な候補であると考えられます。
この知見から、先天的デノボ変異が神経発達障害の原因となる遺伝子(KMT2C遺伝子やSRCAP遺伝子など)の変異が、特定の神経細胞種や脳領域など一部の細胞に生じた場合、双極性障害の発症リスクにつながるという興味深い仮説が導出されました。
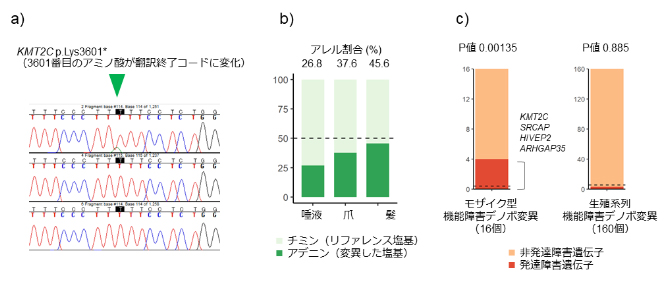
図5 双極性障害におけるモザイク型(後天的)デノボ変異の代表的な例と全体の特徴
(a)KMT2C遺伝子上のデノボ変異に対するサンガーシーケンスは通常よりも低い波形であり、モザイク型が疑われた。
(b)KMT2C遺伝子上のデノボ変異をターゲットアンプリコンシーケンスにて確認したところ、唾液、爪、髪の組織でモザイク型であることが判明し、発生初期に生じた変異と考えられた。
(c)双極性障害におけるモザイク型機能障害デノボ障害変異は、既知の重度発達障害の原因遺伝子上に多く見られ、これは生殖系列機能障害デノボ変異には見られない特徴であった。
今後の期待
本研究では、先天的デノボ変異と後天的デノボ変異の2種類について網羅的な研究を実施し、双極性障害の遺伝学的構造の一端を明らかにしました。先天的デノボ変異の研究では、タンパク質機能喪失デノボ変異など一部の変異が確かに双極性障害リスクに関与することを明らかにし、またこれまでに双極性障害の病態との関与が示唆されていたシナプス・イオンチャネル関連遺伝子が、重要な役割を果たしていることを証明しました。
また、後天的デノボ変異の研究からは、先天的デノボ変異が神経発達障害の原因となる遺伝子の変異が、一部の細胞(例えば特定の神経細胞種や脳領域)で存在すると、双極性障害の発症リスクにつながるという興味深い仮説を導出するような知見が得られました。今後、患者の脳のゲノムを調べることによって、この仮説を直接的に検証できると考えられます。
本研究では双極性障害デノボ変異探索としては、世界最多の354家系の解析を行いましたが、より確実で深い知見を得るためには、さらに多くの家系や患者のゲノム解析を行う必要があります。そのような研究を推進し、ゲノム解析の知見を病態理解につなげ、病態理解から新たな診断・治療・予防法の開発へと展開することが期待できます。
補足説明
1.双極性障害
気分が高揚する躁状態と、気分が落ち込むうつ状態を繰り返す精神疾患の一つで、人口の1%前後が罹患する。躁状態のときには攻撃性が高まったり、社会的な逸脱行為を行ったりするために、本人の社会的な生命に損害を与えることがままある。抑うつ状態による本人の苦痛とともに、解決すべき医療上の課題となっている。激しい躁状態を伴い、躁状態が1週間以上持続する双極Ⅰ型障害と、相対的に軽度で持続期間がより短い躁状態を伴う双極Ⅱ型障害に分類される。
2.デノボ変異
両親から半分ずつ遺伝情報が伝達され、子どもの遺伝情報が形成されるが、精子・卵の発生・形成過程でDNA複製エラーなどにより新生の変異が生じることがある。このような変異をデノボ変異と呼び、子どもの遺伝情報としては検出されるが、両親からは通常検出されない。世代伝達による負の自然選択(自然淘汰)を受けないため、病気に対して大きな効果をもつ変異が潜在的に含まれる。
3.タンパク質の機能喪失変異、負の自然選択(自然淘汰)
タンパク質への翻訳が途中で終了ないし、途中から大きく翻訳内容が変わるために、合成されるタンパク質が実質的に機能しなくなるDNA上の変異があり、これを機能喪失変異と呼ぶ。
機能喪失変異による表現型が生存や繁殖に不利になりやすい(負の自然選択 [自然淘汰] を受けやすい)遺伝子があり、このような遺伝子は上記大規模データベースで理論値と観測値と比較することで推定できる。
4.シナプス、イオンチャネル
シナプスとは、神経細胞同士の情報伝達のためにある接続構造であり、出力側と入力側の間で化学物質が伝達されることで情報伝達がなされる。イオンチャネルは、イオンを透過させる役割を持つ膜タンパク質であり、細胞膜や細胞小器官の膜に存在する。
5.神経発達障害
乳幼児期~小児期にかけて現れる発達の遅れや偏りであり、日常生活・社会生活・学業における障害を伴うことが多い。中枢神経系の機能障害が原因と想定されており、神経発達障害と呼ばれる。原因となる遺伝子変異が同定されている場合もあるが、原因が未知の場合も多い。
6.双極性障害研究ネットワーク
英国のニコラス・クラドック教授による、研究者と双極性障害の当事者の直接のパートナーシップによる研究推進の仕組み「Bipolar Disorder Research Network(BDRN)」に学び、加藤忠史チームリーダー(研究当時)らが呼びかけ、2011年に日本版BDRNとして「双極性障害研究ネットワーク」が設立された。月1回、研究者による最新研究情報などを掲載したニュースレターを配信している。
※配信希望者はbipolar-admin [at] umin.ac.jp(※[at]は@に置き換えてください。)宛に、件名を「ニュース申し込み」とし、本文に登録希望名をご記入の上、メールにてお申し込み下さい。登録終了のお知らせが自動配信され、次回からニュースが配信されます。
7.次世代シーケンサー
数百万~数億分子の断片化したDNAを並列して配列決定する機械。このような機械が誕生する前までは、配列決定したいDNAに対して限られた量の配列決定を行っていたが、大規模な並列化を行う技術の誕生によって網羅的に遺伝情報を解析することが可能になった。
8.リファレンスゲノム
ヒトの遺伝情報を担うDNA配列は個々人で異なるが、大部分は共通している。この共通配列をヒトの標準的なDNA配列として設定し、多型や変異の解析の際の参照先として用いる。この標準配列をリファレンスゲノムと呼ぶ。ヒトゲノム解析の進展に伴い、より精緻なリファレンスゲノムが作成されており、バージョン改訂が繰り返されている。今回は二つのバージョンを用いて網羅的に変異を同定した。
9.大規模公開ゲノムデータベース
本研究では、世界全体の多型・変異を網羅するgnomAD (genome aggregation database![]() ) と、日本人における多型・変異の大規模データである東北メディカルメガバンク機構のデータベース(https://jmorp.megabank.tohoku.ac.jp/202102/variants)の二つを用いた。このような大規模ゲノムデータベースにより、多型や変異の一般集団における頻度が検索できる。
) と、日本人における多型・変異の大規模データである東北メディカルメガバンク機構のデータベース(https://jmorp.megabank.tohoku.ac.jp/202102/variants)の二つを用いた。このような大規模ゲノムデータベースにより、多型や変異の一般集団における頻度が検索できる。
10.P値
帰無仮説(例えば、疾患群と健常群で差が無いという仮説)が正しいという仮定の下で、少なくとも実際に観測された結果と同じくらい極端な結果が得られる確率であり、値が小さいほど結果が偶然としては起こりにくいことを意味する。
11.単一細胞RNAシーケンス
組織から細胞や細胞核を単離し、一細胞・一細胞核単位で、RNA配列決定を行うこと。ヒト脳神経組織を用いる場合は死後試料を用いるため、一細胞核単位の解析となる。本研究では、アレン脳科学研究所(アメリカ合衆国ワシントン州シアトル)で採取・解析され公開されている単一細胞RNAシーケンスデータを用いた。
12.UMAP
次元削減のための多様体学習手法の一つ。本研究のような単一細胞RNAシーケンスデータに対しては、多次元のデータを解釈しやすい低次元数に圧縮することで、細胞群などに分類するために用いる。UMAPは、Uniform Manifold Approximation and Projectionの略。
13.前帯状皮質
大脳の内側面で脳梁の辺縁を前後方向に走る脳回を帯状皮質と呼び、その前部にあたる。気分障害との関連が示唆されている脳部位の一つである。
14.興奮性神経細胞
シナプスにおける化学物質の伝達によってシナプス後細胞を脱分極させ、活動電位の発火を促進する作用を持つシナプス前細胞(神経細胞)のこと。
15.ゲノムワイド関連解析(GWAS)
疾患の有無や、身長・体重などの形質と関連するDNA多型を網羅的に解析する研究手法。GWAS は、genome-wide association studyの略。
16.ヒストン、KMT2C遺伝子
DNAをコイル状に凝集させコンパクトにまとめる機能を持つヒストンというタンパク質があり、このヒストンタンパク質を構成する一部のアミノ酸(リジンやアルギニンなど)に対して分子修飾(メチル基の付加反応であり「メチル化」という)がなされることで、転写・翻訳の調整が行われている。KMT2C遺伝子にコードされるKMT2Cタンパク質は、ヒストンのメチル化修飾を触媒する酵素活性を持ち、このメチル化修飾を介して広汎に他の遺伝子発現に影響を及ぼす。
17.SRCAP遺伝子
SRCAP遺伝子にコードされるSRCAPタンパク質は、ヒストンの中でもその一部を交換する酵素活性を持つ。ヒストンの構成要素を制御する因子の一つであり、SRCAPタンパク質の異常はヒストン構造の制御異常をもたらし、広汎に他の遺伝子発現に影響を及ぼす。
共同研究グループ
理化学研究所 脳神経科学研究センター
精神疾患動態研究チーム(研究当時)
研究員(研究当時) 西岡 将基(にしおか まさき)
(現 順天堂大学 医学部 精神医学講座 准教授)
チームリーダー(研究当時) 加藤 忠史(かとう ただふみ)
(現 順天堂大学 医学部 精神医学講座 教授)
テクニカルスタッフ(研究当時) 数野 安亜(かずの あんあ)
テクニカルスタッフ(研究当時) 酒井 直美(さかい なおみ)
テクニカルスタッフ(研究当時) 小森 敦子(こもり あつこ)
テクニカルスタッフ(研究当時) 石渡 みずほ(いしわた みずほ)
大学院リサーチ・アソシエイト(研究当時) 的場 奈々(まとば なな)
大学院リサーチ・アソシエイト(研究当時) 片岡 宗子(かたおか むねこ)
分子精神病理研究チーム
チームリーダー 髙田 篤(たかた あつし)
順天堂大学 医学部 精神医学講座
研究員(研究当時) 中村 匠(なかむら たくみ)
横浜市立大学 医学研究科
遺伝学教室
助教 濱中 耕平(はまなか こうへい)
大学院生 アルカナック アフメド(Ahmed Alkanaq)
教授 松本 直通(まつもと なおみち)
生化学教室
講師 仙石 徹(せんごく とおる)
教授 緒方 一博(おがた かずひろ)
藤田医科大学 医学部 精神科
准教授 池田 匡志(いけだ まさし)
教授 岩田 仲生(いわた なかお)
滋賀医科大学 医学部 精神科
准教授 藤井 久彌子(ふじい くみこ)
埼玉医科大学病院 神経精神科・心療内科
教授 松尾 幸治(まつお こうじ)
東京大学大学院 総合文化研究科 生命環境科学系
教授 坪井 貴司(つぼい たかし)
医療法人南山会 横浜メンタルクリニック戸塚
院長 早馬 俊(はやま たかし)
医療法人社団慈泉会 市ヶ谷ひもろぎクリニック
理事長 渡部 芳徳(わたなべ よしのり)
特定医療法人十全会 十全病院
理事長 岡 敬(おか たかし)
研究支援
本研究は日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム「トリオサンプルのシーケンス解析による、遺伝子型によって定義される双極性障害の一群の同定(研究代表者:高田篤)」、AMEDゲノム医療実現推進プラットフォーム事業(先端ゲノム研究開発:GRIFIN)「精神疾患のゲノム医療実現に向けた統合的研究(研究代表者:加藤忠史)」、「オリゴジェニックモデルに基づくヒト疾患の遺伝的構造の解析(研究代表者:高田篤)」、AMED戦略的国際脳科学研究推進プログラム「双極性障害に対する体細胞変異の意義の解明と神経ゲノム病理学的手法の開発(研究代表者:西岡将基)」、AMED難治性疾患実用化研究事業「遺伝統計学的解析によるてんかん性脳症の新規原因遺伝子探索及び病態解明(研究代表者:高田篤)」、日本学術振興会(JSPS)科学研究費補助金「双極性障害・統合失調症のトランスオミックス・モデリングによる構成的理解」「マルチスケール精神病態の構成的理解」「Comprehensive analysis of splicing regulation and splicing quantitative trait loci (sQTL) in brains of major psychoses」「クラスタ/ハブ細胞を決定する遺伝子・鍵分子経路の特定およびヒト疾患との関連解析」「精神疾患における転移因子デノボ転移の意義」などの支援を受けて行われました。
原論文情報
Masaki Nishioka, An-a Kazuno, Takumi Nakamura, Naomi Sakai, Takashi Hayama, Kumiko Fujii, Koji Matsuo, Atsuko Komori, Mizuho Ishiwata, Yoshinori Watanabe, Takashi Oka, Nana Matoba, Muneko Kataoka, Ahmed N. Alkanaq, Kohei Hamanaka, Takashi Tsuboi, Toru Sengoku, Kazuhiro Ogata, Nakao Iwata, Masashi Ikeda, Naomichi Matsumoto, Tadafumi Kato, Atsushi Takata, “Systematic analysis of exonic germline and postzygotic de novo mutations in bipolar disorder”, Nature Communications, 10.1038/s41467-021-23453-w
発表者
理化学研究所
脳神経科学研究センター 精神疾患動態研究チーム(研究当時)
研究員(研究当時) 西岡 将基(にしおか まさき)
(現順天堂大学医学部精神医学講座准教授)
チームリーダー(研究当時) 加藤 忠史(かとう ただふみ)
(現順天堂大学医学部精神医学講座教授)
分子精神病理研究チーム
チームリーダー 髙田 篤(たかた あつし)
報道担当
理化学研究所 広報室 報道担当
順天堂大学 総務部 文書・広報課