アルツハイマー病などの神経難病の根本治療に大きな進歩
2021-08-13 東京医科歯科大学,日本医療研究開発機構
研究成果のポイント
- 研究グループがこれまでに独自に開発した核酸医薬である「DNA/RNAヘテロ2本鎖核酸(HDO)」を更に発展させ、従来の核酸医薬では効率よく通過できなかった血液脳関門※1の突破を可能にした、革新的な核酸医薬である「血液脳関門(BBB)通過型ヘテロ2本鎖核酸」を開発しました。
- 脊髄性筋萎縮症に対して核酸医薬が承認され、神経難病の根本治療が可能となりつつありますが、核酸医薬品は侵襲性のある髄腔内への直接投与を一生涯に渡って実施する必要があり、患者にとっては負担の少ない投与法が強く求められています。
- 開発した血液脳関門通過型ヘテロ2本鎖核酸は、負担の少ない全身投与法により中枢神経(脳および脊髄)で様々なRNA(メッセンジャーRNA、マイクロRNAなど)などの遺伝子に対して発現を抑制します。皮下注射などの自己注射が可能となって、患者にとって優しい新規の医薬品開発の可能性が出てきました。
- アルツハイマー病・筋萎縮性側索硬化症・パーキンソン病などのこれまで根本的な治療法のなかった中枢神経の難治疾患や、狂牛病を含めた神経感染症への治療にも応用が期待できます。
概要
東京医科歯科大学大学院 医歯学総合研究科 脳神経病態学分野(脳神経内科)の横田隆徳教授、永田哲也プロジェクト准教授は、アイオニス・ファーマシューティカルズ社(IONIS Pharmaceuticals)および武田薬品工業(Takeda Pharmaceutical Company Limited)との共同研究で、従来のアンチセンス核酸医薬※2では不可能であった全身投与(静脈内および皮下投与)による中枢神経での遺伝子の発現抑制を可能とする新技術の開発に成功しました。この研究は日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業における研究課題「第3世代ヘテロ核酸の開発」、先端的バイオ創薬等基盤技術開発事業における研究課題「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的分子標的治療とブレインイメージング」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「新機能創出を目指した分子技術の構築」研究領域(研究総括:山本尚教授)における研究課題名「画期的な新規核酸医薬の分子技術の創出」(いずれも研究代表者:横田 隆徳)などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Nature Biotechnology(ネイチャーバイオテクノロジー)に、2021年8月12日午後4時(英国夏時間)にオンライン版で発表されました。
研究背景
核酸医薬は、従来の低分子化合物や抗体医薬では困難な標的RNAの選択的制御を可能とする先端的なバイオ医薬技術です。この3年ほどで脊髄性筋萎縮症、家族性アミロイドポリニューロパチーやデュシャンヌ型筋ジストロフィーなどの神経・筋疾患で既に核酸医薬品が承認されています。これ以外にも、筋萎縮性側索硬化症・パーキンソン病・アルツハイマー病等、多くの中枢神経疾患で臨床試験が進行しています。一方で中枢神経疾患を標的にする場合、髄腔内に直接投与する(腰椎穿刺)ことが必要です。これは従来のアンチセンス核酸やsiRNA等の核酸医薬品は全身投与では血液脳関門通過のバリアを通過できず、脳や脊髄といった中枢神経に届かないためです。髄腔内投与は背中から長い針を腰椎の隙間から脊髄の周りの髄液まで到達させる投与方法で、高齢者に多い抗凝固薬治療をおこなっている患者や神経難病に多い側弯症を有する患者には投与自体が難しく、また稀ですが感染や出血等様々な危険性が伴います。
そこで本研究グループは、髄腔内投与しなくても、通常の静脈内投与や皮下投与で脳や脊髄の遺伝子制御のできるヘテロ2本鎖核酸の開発に着手しました。
研究の概要
東京医科歯大学脳神経内科の研究グループは従来の核酸医薬と異なる分子構造(図1(A))、多様なデリバリー分子(図1(B))、独自の細胞内作用メカニズムで高い有効性を有すDNA/RNAヘテロ2本鎖核酸を独自に開発しましたが、脳の制御はなかなか困難でした。そこで相補鎖に様々な脂質送達分子(リガンド)※3を結合させて、血液脳関門の通過性のスクリーニングを検討しました。その結果、コレステロールを結合してマウスの静脈内に投与すると、中枢神経における標的RNAを劇的に抑制しました。この効果は複数回投与により、効果が加算されて増強されました(図1(C)および(D))。
一方で従来の1本鎖アンチセンス核酸では単回投与・複数回投与のいずれでも中枢神経での遺伝子発現抑制効果が見られませんでした。また1本鎖アンチセンス核酸にコレステロールを直接結合した核酸でも比較しましたが、効果が弱く、高い毒性が認められました。
上記の血液脳関門通過型ヘテロ2本鎖核酸を静脈内投与することによって中枢神経への送達が確認され、さまざまな標的RNAに対して中枢神経での遺伝子発現抑制効果が確認されました(図2)。また、さらに詳細に神経細胞・各種グリア細胞のそれぞれの細胞での遺伝子発現抑制効果を検討したところ、特に神経細胞やミクログリアで強い遺伝子発現抑制効果が観察されました。図1(E)に示すのはin vivo共焦点レーザー顕微鏡を用いた実験で得られたライブイメージで、血液脳関門通過型ヘテロ2本鎖核酸でのみ明らかな脳内への移行が観察されました。
静脈内投与に加えて、皮下投与でも中枢神経での遺伝子発現抑制効果が観察され、患者が毎回医療機関に来なくても皮下投与による自己注射が可能となって、患者の利便性にも大きな進歩となる可能性があります。
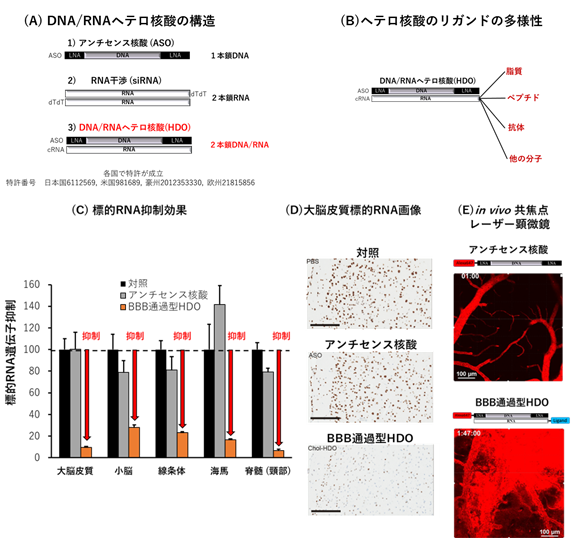
図1(A)ヘテロ核酸の構造を示す。1本鎖アンチセンス核酸や2本鎖RNAであるsiRNAとは全く異なる分子構造である。(B)ヘテロ核酸はペプチドや抗体を含む任意のドラッグデリバリーシステム分子と結合可能である。(C)BBB通過型ヘテロ核酸をマウスに複数回、静脈内投与した際の大脳皮質を含む脳における各部位での劇的な標的遺伝子(RNA)抑制効果(70-95%)。比較対象の1本鎖アンチセンス核酸では遺伝子抑制効果は見られない。(図は代表例)(D)BBB通過型ヘテロ核酸をマウスに複数回、静脈内投与した際の大脳皮質でのRNA画像。茶色のシグナルがRNAを示すがBBB通過型ヘテロ核酸では殆どシグナルが著しく抑制された。(スケールは100μm)(E)in vivo共焦点レーザー顕微鏡で観察したマウス脳のライブイメージ。赤く見えるのがそれぞれの核酸である。1本鎖アンチセンス核酸では血管内に核酸が留まり、脳実質(黒い部分)に送達されないが、BBB通過型ヘテロ核酸では血管から脳実質への直接の移行が観察される。
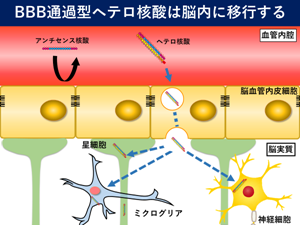
図2血液脳関門通過型ヘテロ核酸は脳血管内皮を通過して、脳内に移行して、神経細胞・ミクログリア・星状細胞に取り込まれて遺伝子発現抑制効果を示す。一方で1本鎖アンチセンス核酸では脳血管内皮自体を通過しない。
研究成果の意義
神経難病の多くが10年以上の長期の治療が必要です。侵襲性の高い髄腔内投与を回避して、患者に優しく便利な投与方法が可能となれば、とくにアルツハイマー病のような頻度の高い疾患に有用となります。加えて神経難病の中には、脳脊髄のみならず心臓や筋肉の全身症状を有する疾患も多くあることから、中枢神経疾患と全身臓器を1度に治療できる長所もあります。BBBヘテロ核酸の適応が期待される対象疾患としては表に示すような他の多くの神経変性疾患や、てんかんや脳梗塞、難治性の神経感染症等が広範な適応が期待できます。すでに複数の大手製薬企業でこれらの疾患で創薬に向けた共同研究が進行しています。

表 BBBヘテロ核酸の適応が期待される疾患。
用語解説
- ※1血液脳関門(Blood-brain barrier; BBB)
- 脳実質組織とそこに酸素と栄養を供給する血管との間には、血液脳関門(BBB)と呼ばれるバリアが存在する。BBBは解剖学的には、脳毛細血管内皮細胞、アストロサイトおよびペリサイトの3種類の細胞が機能的に一体となって構築している。BBBの存在により脳組織を外因物質から保護している。多くのトランスポーターによって、栄養素(グルコース、アミノ酸など)は選択的に血液脳関門を透過する。一方で水溶性の高い物質あるいはタンパク質などの大きな分子はこの関門を透過し難く、核酸医薬自体は通過しないことがよく知られている。脳内に薬剤を送達させるには、この関門の透過することが必須である。
- ※2アンチセンス核酸
- 細胞内に存在するRNA等を標的とする核酸医薬で、1本のDNA鎖を基本構造とし様々な化学修飾が施されている。既存の低分子医薬や抗体医薬では標的にできない細胞内のRNAを標的として結合することが可能であり、その結果標的RNAから翻訳される疾患に係わるタンパク質量を一過性に低下させ機能を抑制したり、発現上昇させたりと、これまで治療法のなかった疾患の治療薬の主流となりつつある。主な国内での承認薬として脊髄性筋萎縮症に対するヌシネルセン、家族性ポリアミロイドニューロパチーに対するイノテルセンやデュシャンヌ型筋ジストロフィーに対するビトラルセンなどがあり、現在も複数の臨床治験が進行中である。
- ※3脂質送達分子(リガンド)
- 核酸自体は極性が高く、非常に親水性が高いことが知られています。その為に、血液脳関門を通過しないと考えられております。神経細胞のみならず、細胞は多くの脂質で構成されており、特に細胞膜で重要な構成成分です。そこでわれわれは核酸に疎水性であり、細胞膜の構成成分である脂質を送達分子としてつけることにより、通過が可能となると考えました。10以上の脂質リガンドを試したところコレステロールが圧倒的に血液脳関門性を示しました。
論文情報
- 掲載誌
- Nature Biotechnology
- 論文タイトル
- Systemically administered DNA/RNA heteroduplex oligonucleotides achieve blood to brain delivery and efficient gene knockdown in the CNS
研究者プロフィール
横田 隆徳(ヨコタ タカノリ)Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科)教授
研究領域:神経内科学、核酸医薬
永田 哲也(ナガタ テツヤ)Tetsuya Nagata
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科)プロジェクト准教授
研究領域:神経内科学、核酸医薬
お問い合わせ先
研究に関すること
国立大学法人東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野 横田 隆徳(ヨコタ タカノリ)
報道に関すること
国立大学法人東京医科歯科大学 総務部総務秘書課広報係
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当