神経筋疾患病態モデル構築と創薬研究への利用
2021-09-13 京都大学iPS細胞研究所
ポイント
- Myogenic Differentiation 1(Myod1)という転写因子注1)を搭載した温度感受性センダイウイルスベクター
注2)を用いて、ヒトES細胞/iPS細胞から骨格筋細胞へ分化させる手法を確立しました。 - 一時的な高温環境培養における熱ストレス注3)による骨格筋細胞への分化成熟促進と、残存する多能性幹細胞の除去により、分化誘導効率を高めることができました。
- この手法を用いると、分化開始から14日でES細胞/iPS細胞から高純度の骨格筋細胞を調整することができました。
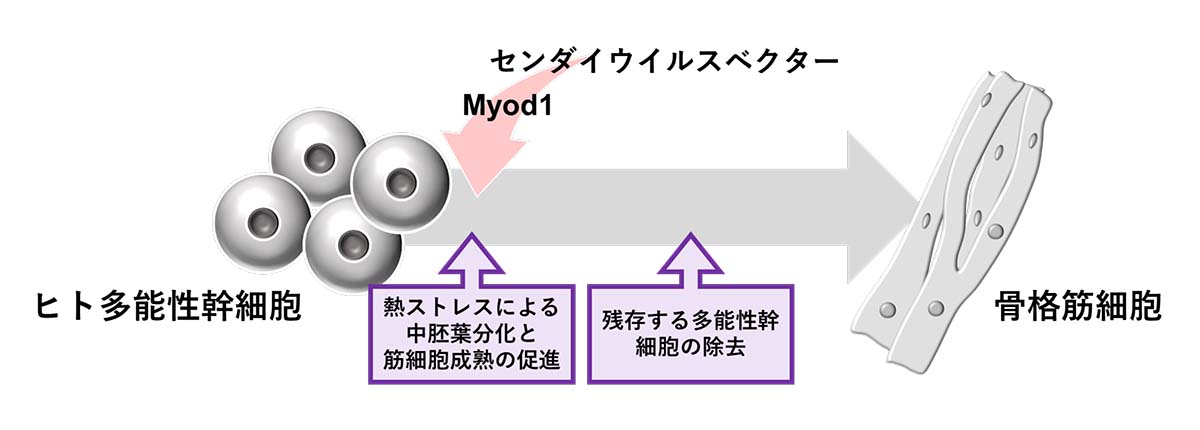
論文概要図
1. 要旨
Tan Ghee Wang元大学院生 (京都大学CiRA増殖分化機構研究部門)、近藤孝之特定拠点講師(CiRA同部門・理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チーム)、井上治久教授(CiRA同部門・理化学研究所BRC同チームチームリーダー)らの研究チームは、株式会社IDファーマ(アイロムグループ100%子会社)との共同研究で、温度感受性センダイウイルスベクターによる転写因子Myod1の外来性強制発現により、ヒトES細胞/iPS細胞から骨格筋細胞を迅速に分化誘導することに成功しました。そして、この分化過程において熱ストレスが骨格筋細胞への分化誘導効率と成熟化を促進することも明らかにしました。今後、さまざまな疾患の患者さんから樹立したiPS細胞を用いた、病態解明および創薬研究への応用が期待されます。
この研究成果は2021年9月13日午前7時(日本時間)にJournal of Cellular and Molecular Medicine誌でオンライン公開されました。
2. 研究の背景
ES細胞/iPS細胞は、その増殖能と多分化能の特性から、再生医療と疾患研究における重要な資源となっています。そして、さまざまな神経筋疾患において障害される骨格筋細胞も、ES細胞/iPS細胞から分化誘導する方法が開発されてきました。この中で特に、骨格筋の発生過程において重要な働きをする転写因子であるMyogenic Differentiation 1(Myod1)の一過性導入は、ES細胞/iPS細胞から骨格筋細胞へと速やかに分化させることができる強力な誘導方法であることが知られています。
本研究では、外来遺伝子の導入がしにくい細胞種であるES細胞/iPS細胞であっても、培地中に添加するだけで速やか、かつ強力に目的の遺伝子を発現させることができるセンダイウイルスベクターを用いて、Myod1を導入しました。このセンダイウイルスベクターは、RNAウイルスベクターであり、感染した細胞のゲノム配列には組み込まれず、ES細胞/iPS細胞から脊髄運動神経細胞の誘導に用いることができるなど実績のあるベクターです。
本研究ではさらに、温度感受性センダイウイルスベクターを38℃の高温環境培養により除去する過程で、熱ストレスが中胚葉注4)系への分化および骨格筋細胞の成熟にも促進的に働くことを見出しました。最終的に得られた骨格筋細胞は、電気刺激に対して応答し、その機能を有していました。
この技術は、ヒト骨格筋作製を簡便にし、疾患モデル研究の有用な手段となると考えられます。
3. 研究結果
温度感受性センダイウイルスベクターを用いて、ES細胞/iPS細胞に転写因子Myod1を外来性に強制発現させると、成熟骨格筋細胞のマーカーであるMyosin heavy chain(MHC)陽性の骨格筋細胞が誘導されました。本研究でMyod1の導入に用いた温度感受性センダイウイルスは、高温環境で培養することにより細胞内から除去される特性を持っています。この特性を利用して、分化誘導途中の細胞内にとどまっている温度感受性センダイウイルスベクターを除去するために、38-40℃の高温環境において5日間培養しました。この一過性の高温環境培養は、熱ストレスを分化過程にある細胞に加えることで、中胚葉系あるいは骨格筋系細胞への分化誘導効率と成熟化も促進させることを見出しました(図1)。
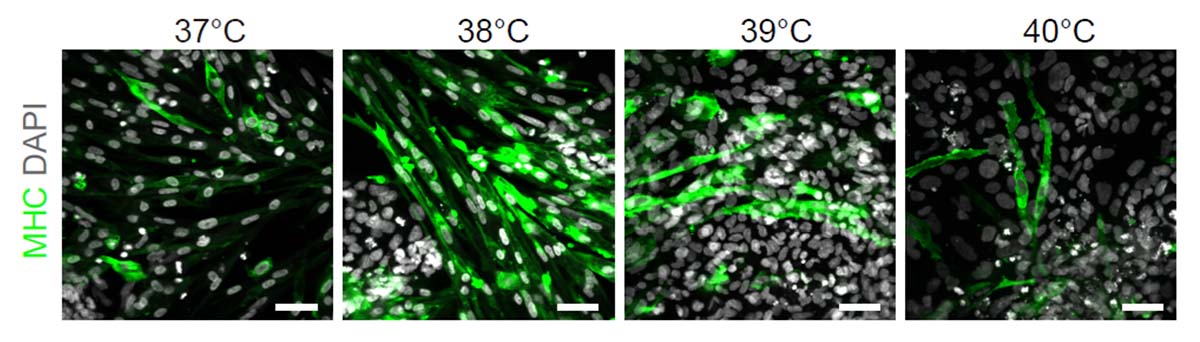
図1:通常環境(37℃)と高温環境(38-40℃)において5日間培養した骨格筋細胞(分化開始から8日目)
Myosin heavy chain (MHC)陽性の骨格筋細胞は、通常の培養環境である37℃と比較して、より高い温培養温度環境にさらされることで成熟した形態である紡錘形の筋菅類似形態を呈する細胞の数が増加する。しかし39℃あるいは40℃では細胞数減少と細胞形態の変化など細胞障害が生じた。スケールバーは100μmを示す。
さらに、多能性幹細胞に特異性の高い糖鎖であるrBC2LCNを指標として、残存するES細胞/iPS細胞を能動的に除去することで、80-90%を超える高い純度の骨格筋細胞を調整することができました(図2)。
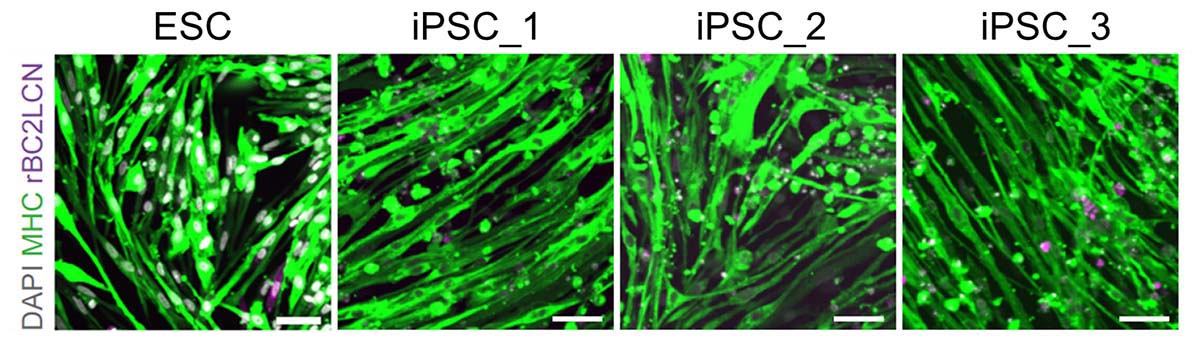
図2:ES細胞/iPS細胞から分化誘導した骨格筋細胞(分化開始から14日目)
ヒトES細胞あるいはヒトiPS細胞から、Myosin heavy chain(MHC)陽性の骨格筋細胞が誘導された(iPSC-1、iPSC-2、iPSC-3はサンプルの違いを示す)。その一方で、多能性幹細胞に特性の高い糖鎖であるrBC2LCN陽性細胞は分化過程で除去され、分化開始から14日目の時点でほとんど観察されなくなった。スケールバーは100μmを示す。
最後に、本研究の手法により分化誘導した骨格筋細胞の機能を確かめるため、電気刺激への反応性を調べました。結果、ヒトES細胞あるいはヒトiPS細胞から分化誘導した骨格筋細胞すべてにおいて電気刺激への反応性を示していることが確認できました(図3)。
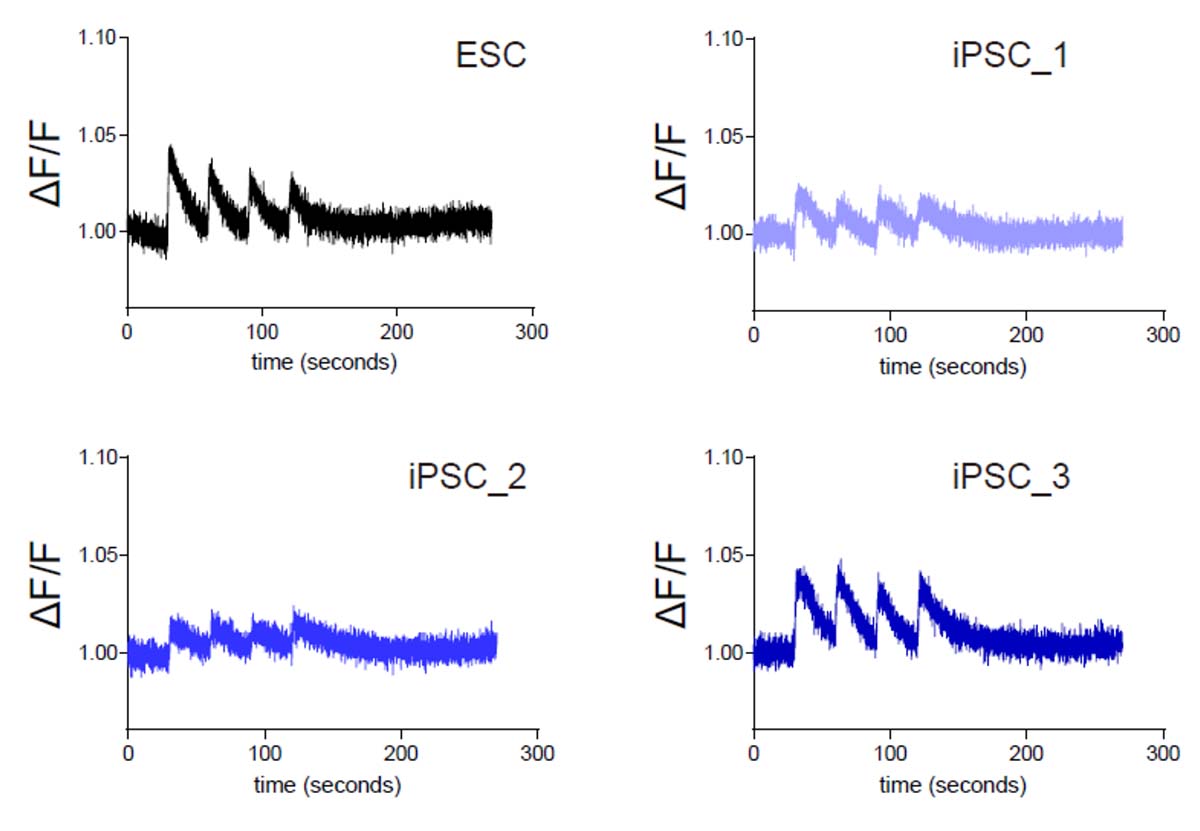
図3:骨格筋細胞の電気刺激反応性
縦軸はカルシウム指示薬が呈する蛍光の、基底状態からの強度変化率(ΔF/F)、横軸は経過時間を示す。(iPSC-1、iPSC-2、iPSC-3はサンプルの違いを示す。)30秒おきに電気刺激を加えると、電気刺激応答性に蛍光強度が増強することから、本研究で調整された骨格筋細胞は電気刺激に応答し、その機能を有することが示された。
4. まとめ
本研究では、温度感受性センダイウイルスベクターを用いて、ヒトES細胞/iPS細胞から骨格筋細胞を簡便に作製する技術を開発しました。本手法は、分化誘導効率が高いこと、また骨格筋細胞の純度が高いことから、さまざまな患者さんのiPS細胞からの分化誘導が必要とされる神経筋疾患の病態モデル構築や創薬研究に利用されることが期待されます。
5. 論文名と著者
- 論文名
Simple derivation of skeletal muscle from human pluripotent stem cells using temperature-sensitive Sendai virus vector - ジャーナル名
Journal of Cellular and Molecular Medicine - 著者
Ghee Wan Tan1, Takayuki Kondo1,2,3*, Keiko Imamura1,2,3, Mika Suga1,2, Takako Enami1,3,
Ayako Nagahashi1,3, Kayoko Tsukita1,2, Ikuyo Inoue1,3, Jitsutaro Kawaguchi4, Tsugumine Shu4, Haruhisa Inoue1,2,3*
* 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 理化学研究所バイオリソース研究センター(BRC)iPS創薬基盤開発チーム
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 株式会社IDファーマ 研究開発センター
6. 本研究への支援
本研究は、AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)により支援されました。
7. 用語説明
注1)転写因子
DNAに結合し、DNAからRNAへの転写に関わる因子。タンパク質合成は、DNA上の遺伝子を鋳型にmRNAが転写され、このmRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わる因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
注2)温度感受性センダイウイルスベクター
ベクターとは遺伝子の「運び手」で、生体内外において核酸物質を細胞内へ導入し細胞の機能を改変する能力を持つ。ウイルス法は、一般的に遺伝子導入効率は高いものの、その細胞毒性やゲノム障害性に問題があったが、センダイウイルスベクターは、遺伝子が標的細胞の核内に侵入せず染色体に組み込まれないという特長を持ち、安全性や効率の面で優れている。さらに本研究で用いたセンダイウイルスベクターは遺伝子配列に工夫がなされており、高温培養を経ることで細胞内から除去される性質を獲得しています。
注3)熱ストレス
熱環境をはじめとする多様な外環境に起因する細胞ストレスが、個体では炎症応答など、あるいは細胞レベルでは細胞応答機能などに影響を及ぼすことが知られ、ほとんどの生物が持つ普遍的生命現象の一つ。
注4)中胚葉
受精後の胚からできる細胞の塊はまず、内胚葉、中胚葉、外胚葉に分けられる。その後、内胚葉は、消化器官や呼吸器官を形成する。