2021-09-23 東京大学
木瀬 孔明(生物科学専攻 特任准教授)
糟谷 豪(自治医科大学 助教)
岡本 紘幸(生物科学専攻 博士課程1年)
山之内 大地(生物科学専攻 修士課程2年)
小林 幹(研究当時:生物科学専攻 特任助教)
草木迫 司(生物科学専攻 助教)
西澤 知宏(研究当時:生物科学専攻 准教授)
中條 浩一(自治医科大学 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- 神経細胞や心臓の電気活動に必須の役割を果たす電位依存性カリウムチャネル(注1) Kv4.2と2種類の制御サブユニット(注2) KChIP1、DPP6Sからなる巨大複合体の立体構造を明らかにした。
- KChIP1とDPP6SがKv4.2の電気生理学的特性を適切に調整する機構を初めて明らかにした。
- Kv4.2、KChIP1、DPP6Sの遺伝子変異は、てんかん、自閉症、統合失調症といった脳機能の疾患や不整脈、心不全といった心疾患との関わりが報告されている。本研究の成果は、Kv4の機能を制御し、疾患の治療薬となる薬剤の設計と開発に大きく貢献することが期待できる。
発表概要
神経細胞や筋細胞の電気活動に必須の役割を果たすイオンチャネル(注3) は、多様な制御サブユニットから電位依存性やゲートの開閉のキネティクスkinetics (注4)の調整(モジュレーションmodulation (注5) )を受けて、複合体としてその生理的機能を獲得します。しかしながら、イオンチャネルのモジュレーション機構については、イオン選択性や電位依存性の機構と比べて、未解明の問題として残されています。
今回、東京大学大学院理学系研究科の濡木理教授、木瀬孔明特任准教授らのグループは、神経細胞で活動電位の逆伝搬(注6)を抑制する重要な役割をもつ電位依存性カリウムチャネルKv4.2と制御サブユニットKChIP1およびDPP6Sとの複合体構造をクライオ電子顕微鏡(注7)で決定することに成功しました。さらに自治医科大学医学部の中條浩一教授、糟谷豪助教との共同研究のもと、電気生理学的解析を組み合わせることによって、KChIP1がKv4.2のゲートと相互作用すること、またDPP6SがKv4.2の電位センサードメインと相互作用することによって、Kv4.2の活性化、不活性化のキネティクスをモジュレートすることを初めて明らかにしました。このようなモジュレーションの機構は全く新規であり、また本研究成果はヒト脳機能の疾患、あるいは心疾患の原因となるイオンチャネル複合体の機能を制御できる疾患の治療薬の開発につながることが期待されます。
本研究成果は、英科学誌Natureにオンライン公開されました。
発表内容
研究の背景
脳神経系における神経細胞間の情報伝達は、多様なイオンチャネルが生み出す電気信号によって行われます。一般的に電気信号は神経細胞の樹状突起で受け取られ、活動電位と呼ばれる形で軸索から送り出されます(図1)。

図1:神経細胞は電気信号を樹状突起で受け取り、活動電位として軸索から送り出す。Kv4は神経細胞の樹状突起に局在し、活動電位の逆伝搬を抑制する(右)。Kv4は速く活性化し、速く不活性化する特性を持つ(左)(横軸:時間、縦軸:電流値)。
それぞれのイオンチャネルには透過するイオンの選択性やイオンを通すゲートの開閉の時空間制御機構に違いがあるため、個々の神経細胞で発現する多様なイオンチャネルの組み合わせによって、その生理的機能に必要な固有の電気信号のパターンが生み出されます。例えば電位依存性カリウムチャネルは細胞膜の電位変化に応答して細胞外にカリウムイオンを流出させて、神経細胞が受け取った正の電気信号を負に抑える働きを持っていますが、膜電位変化に対する応答性やチャネルのゲートが開閉する速度はカリウムチャネルの種類によって異なります。
イオンチャネルの多くは、多様な制御サブユニットと複合体を形成することによって電位依存性、ゲートの開閉のキネティクスの調整(モジュレーション)を受けて、複合体としてその生理的機能を獲得します。実際に、イオンチャネル本体だけではなく、制御サブユニットの遺伝子変異もヒトの脳機能の疾患に関わることが知られています。2003年のノーベル賞の受賞対象となったように、イオンチャネルのイオン選択性や電位依存性の機構が構造生物学的手法によって明らかにされてきました。しかしながら、これらの研究成果はイオンチャネルのコアとなる普遍的な性質の機構を解明したに過ぎず、制御サブユニットがどのようにイオンチャネルの特性をモジュレートし、イオンチャネル複合体の多様な「個性」を生み出すのかについては未だ明らかではありません。
神経細胞の樹状突起に局在する電位依存性カリウムチャネルKv4サブファミリー(Kv4.1-Kv4.3)は、活動電位の樹状突起への逆伝搬の抑制や、記憶・学習に関わる樹状突起での繰り返し発火パターンの制御を行います(図1)。Kv4は速く活性化し、速く不活性化する特性を持っていますが、この速いキネティクスを獲得するためには細胞質内タンパク質KChIP(KChIP1-KChIP4)と1回膜貫通タンパク質DPP(DPP6Sなど)の2つの制御サブユニットによってモジュレーションを受けることが必要です。しかしながら、これら2種類の制御サブユニットがどのようにKv4の電気生理学的特性をモジュレートするのかについては、その発見以来、約20年間不明でした。
研究の成果
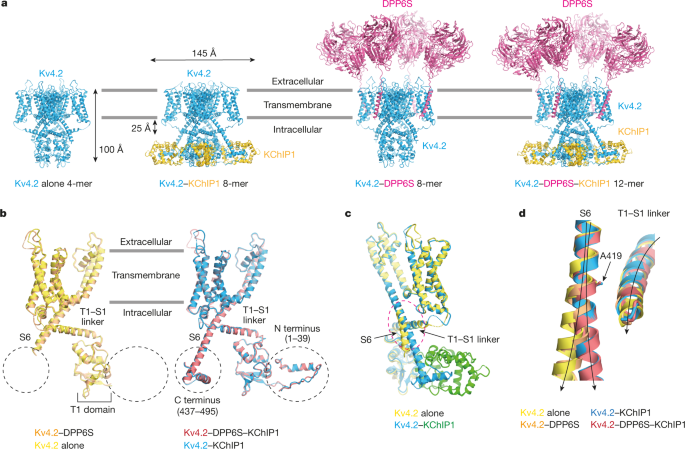
今回、東京大学大学院理学系研究科の濡木理教授、木瀬孔明特任准教授らのグループは、クライオ電子顕微鏡を用いてKv4.2単体(4量体)、Kv4.2-KChIP1複合体(8量体)、Kv4.2-DPP6S複合体(8量体)、Kv4.2-DPP6S-KChIP1巨大複合体(12量体)の立体構造を決定することに成功しました(図2)。
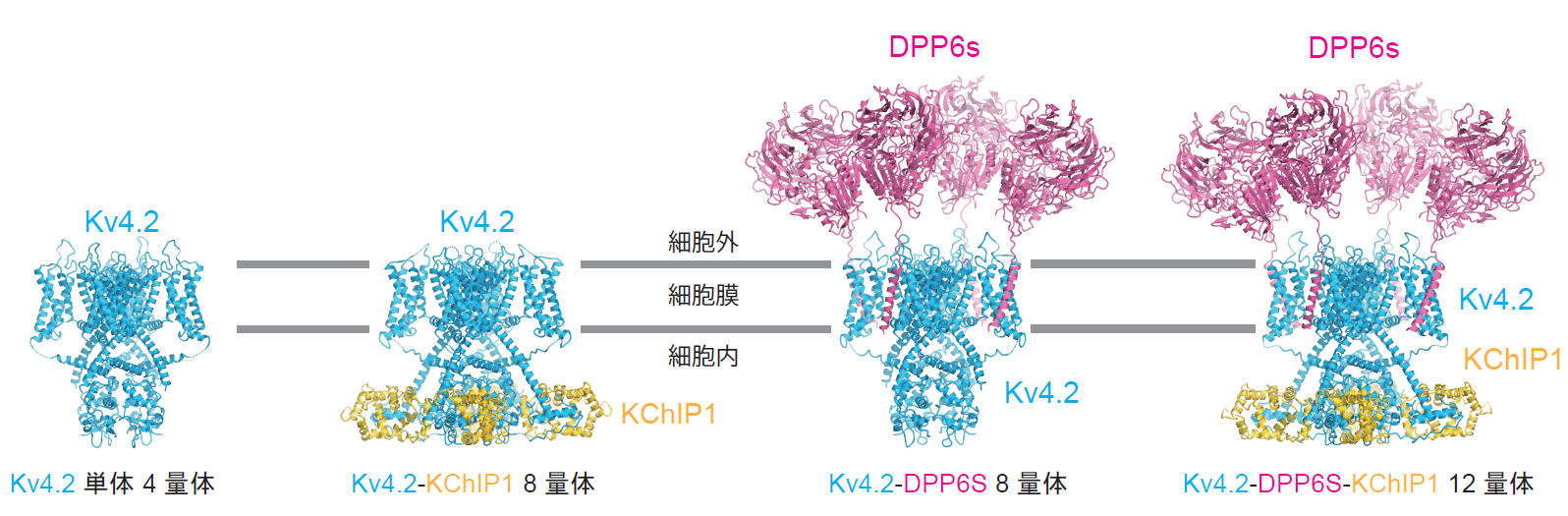
図2:Kv4.2単体、Kv4.2-KChIP1、Kv4.2-DPP6S、Kv4.2-DPP6S-KChIP1複合体構造。
これら4種類の構造を比較した結果、(1)KChIP1がKv4.2のポア(カリウムイオンを通す小さな穴)の開閉を制御するS6ゲートと相互作用し、ゲートの構造を安定化すること、(2)1つのKChIP1が隣り合った2つのKv4.2サブユニットを結びつけることによって、4本のS6の動きが連動する仕組みになっていることが初めて分かりました(図3)。また、DPP6SがKv4.2の電位センサードメインを構成するS1-S2の構造を安定化するように相互作用することが初めて明らかになりました(図4)。さらに、Kv4.2におけるKChIP1、DPP6Sとの相互作用部位に変異を導入すると、KChIP1、DPP6SによるKv4.2のモジュレーションが変化することが、自治医科大学医学部の中條浩一教授、糟谷豪助教による電気生理学的解析から明らかになりました(図5)。
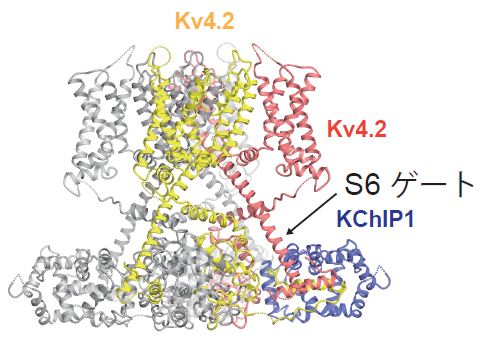
図3:KChIP1は Kv4.2の膜貫通領域S6から細胞内へと伸びるS6ゲートと相互作用する。
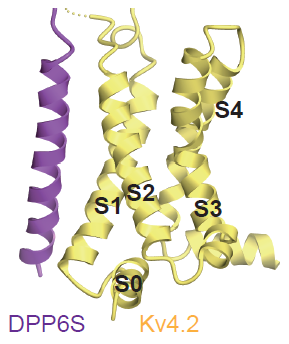
図4:DPP6Sは Kv4.2の膜貫通領域S1、S2と相互作用する。
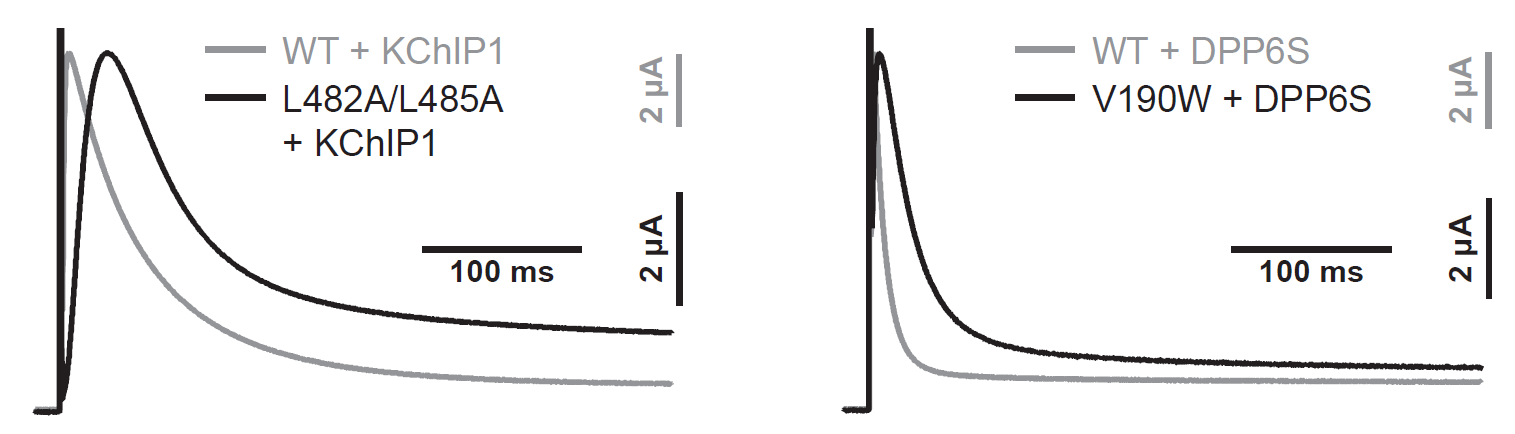
図5:Kv4.2のKChIP1、DPP6Sとの相互作用部位に変異を導入すると、Kv4.2変異体はKv4.2野生型と比べてKChIP1(左)、DPP6S(右)によるモジュレーションを正常に受けることができず、活性化、不活性化に遅れが生じる(横軸:時間、縦軸:電流値)。灰色線がKv4.2野生型(WT)、黒線がKv4.2変異体(L482/L485(左)またはV190W(右))のカリウム電流の波形。
これらの結果から、KChIP1がS6ゲートの開閉速度を上昇させ、DPP6Sが膜電位変化に応じたKv4の電位センサーの構造変化の速度を上昇させることで、Kv4チャネル複合体が速く活性化し、速く不活性化する特性を獲得するというモジュレーションのモデルを提唱しました。今回の研究成果は、過去20年にわたる電気生理学的研究だけでは解決できなかった問題を、クライオ電子顕微鏡によるKv4チャネル複合体の立体構造の解明と組み合わせることによって一挙に解決へと導きました。
今後の展望
神経細胞や心筋細胞で機能するさまざまなイオンチャネルとその制御サブユニットの遺伝子変異による機能異常は、てんかん、自閉症、統合失調症などのヒト脳機能の疾患や心疾患と関わりのあることが分かってきています。本研究を皮切りに、イオンチャネル巨大複合体の多様なモジュレーション機構が今後、次々と明らかにされると予想されます。これら基礎研究の成果は、イオンチャネルの機能を制御し、疾患の治療薬となる薬剤の開発に大きく貢献できることが期待されます。
謝辞
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木理)、CREST「細胞内現象の時空間ダイナミクス」(課題番号:20344981 研究代表者:濡木理)および基盤研究(B)「神経興奮調節やてんかんに関わる電位依存性K+チャネルKCNQ2の作動機構の解明」(課題番号:20H03200 研究代表者:糟谷豪)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、クライオ電子顕微鏡などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
発表雑誌
- 雑誌名
Nature論文タイトル
Structural basis of gating modulation of Kv4 channel complexes著者
Yoshiaki Kise*#, Go Kasuya*#, Hiroyuki Okamoto, Daichi Yamanouchi, Kan Kobayashi, Tsukasa Kusakizako, Tomohiro Nishizawa, Koichi Nakajo & Osamu Nureki#DOI番号
10.1038/s41586-021-03935-z
用語解説
注1 電位依存性カリウムチャネル
細胞膜内外の電位差(膜電位)の変化を感知して開閉するカリウムチャネル。6本の膜貫通領域(S1-S6)からなり、S1-S4が電位センサードメイン、S5-S6がカリウムイオンを通すゲートとポアドメインを形成する。興奮していない静止状態の細胞では細胞外を0mVとしたときに細胞内は約-70mVの電位差(静止膜電位)がある。静止膜電位付近ではチャネルは閉じているが、細胞が電気信号を受け取り膜電位が正方向に変化すると、電位センサードメインの構造変化が起こり、それに伴ってポア(イオンを通す小さな穴)が開く。この時、カリウムイオンは細胞内の方が高濃度であるため、細胞外に放出される。
注2 制御サブユニット
イオンチャネルのポアを形成するαサブユニットと複合体を形成し、イオンチャネルの細胞内局在や、電位依存性、チャネルの開閉の速度を制御するβサブユニット。
注3 イオンチャネル
細胞の生体膜は脂質二重膜から構成されているため、イオンをほとんど透過しない。イオンチャネルは生体膜にある膜貫通タンパク質であり、イオンを透過させる機能を持つ。1種類のイオンだけを選択的に透過させるチャネルもあれば、イオン選択性の低いチャネルもある。膜電位変化やリガンド依存的に活性化する。
注4 キネティクスkinetics
ある状態から異なる状態へと移行する速度のこと。例えば、電位依存性イオンチャネルは膜電位に応じて静止状態、活性化状態、不活性化状態を取り、それらの状態間の移行速度こと。
注5 モジュレーションmodulation
イオンチャネルの電位依存性やチャネルの開閉のキネティクスを変化させること。
注6 逆伝搬
神経細胞の樹状突起で受け取られた電気信号は細胞体に集積し、軸索の根本で活動電位へと変換される。活動電位は軸索を介して下流の神経細胞に伝達されると同時に、樹状突起へと逆向きにも伝搬する(図1)。これを逆伝搬という。
注7 クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの生体分子に対して電子線を照射して像を拡大し、試料を観察するための装置。電子線の持つ波長は可視光線よりも短いため、光学顕微鏡では見ることが難しい原子レベルの大きさの試料を観測することが可能となる。タンパク質の立体構造を高分解能で決定する手法として、検出器などにおいて目覚ましい技術革新を遂げており、2017年に、その開発に貢献した海外の研究者三名にノーベル化学賞が贈られた 。