肝切除後の補助化学療法は生存改善を認めず
2021-09-27 国立がん研究センター
発表のポイント
- これまで有用性が明らかになっていなかった大腸がんの肝臓への転移に対する肝臓切除後の術後補助化学療法について、切除単独療法よりも優れた治療法であるかどうかを検証しました。
- 検証の結果、術後補助化学療法を実施した場合、無病生存期間は延長されましたが、全生存期間は延長されませんでした。
- 大腸がんの肝臓への転移に対する肝臓切除後の患者さんに対しては、これまで十分な根拠がないままに術後補助化学療法が多く行われていましたが、本結果により補助化学療法を一律に推奨すべきではないことを世界に先駆けて明らかにしました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)中央病院(病院長:島田和明、所在地:東京都中央区)が中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(JCOG)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
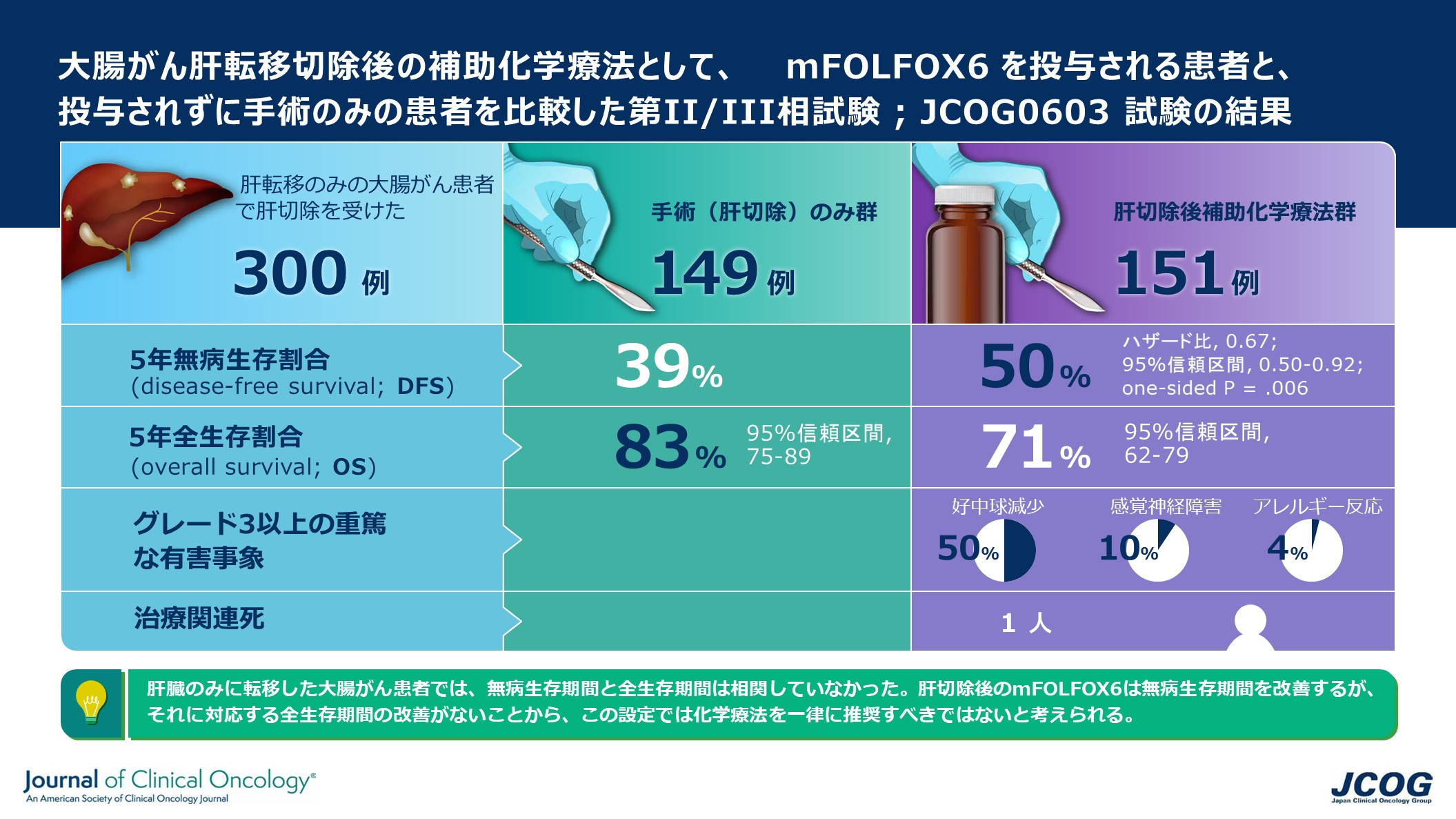
この度、JCOGの大腸がんグループでは、大腸がんが肝臓に転移(肝転移)し、転移巣を含む部分の肝臓を切除した患者さんを対象として、標準治療である肝転移切除単独療法と、オキサリプラチン併用5-FU/l-leucovorin療法(mFOLFOX6)の術後補助化学療法を比較するランダム化第II/III相試験を実施し、術後補助化学療法の有効性と安全性を検証しました。その結果、無病生存期間(がんがなく生存している期間)は延長されましたが、全生存期間(生存している期間)は延長されませんでした。これにより、本対象患者での術後補助化学療法を一律に推奨すべきではないと結論づけられました。これまで十分な根拠がないまま広く行われていた肝切除後の補助化学療法に対して歯止めをかけ、肝転移巣の大きさが大きくない場合には、肝切除後はそのまま経過観察する治療が第一選択として推奨されることになります。
わが国から発信する、肝切除後mFOLFOX6の意義に関する初の科学的エビデンスであり、本試験の結果により、日本だけでなく全世界の研究者に重要な情報を提供し、日常診療が変わる可能性があります。
本研究の成果は、米国学術雑誌「Journal of Clinical Oncology」に日本時間2021年9月14日付けで発表されました。
背景
大腸がんの肝転移は、大腸がん患者さんの約30%(注1)に見られ、また大腸がん患者さんの死亡原因の半数以上(注2)を占めています。他の治療法では長期生存が望めないため、肝転移を有する大腸がん患者さんに対しては、現在、転移巣を含む部分の肝切除が最も有効な治療法と考えられています。しかしながら、肝切除のみでは治癒やしないことが多く、切除後の5年間で70~80%の患者さんに再発が見られます。そのため、肝切除後の補助化学療法の有用性が検討されてきました。
しかし、過去の臨床試験や複数の臨床試験結果を総合的に評価するメタアナリシスによると、肝切除後の補助化学療法は再発等がない無病生存期間を改善しますが、全生存期間の有益性については改善効果があるか否かに関して議論がありました。現在推奨されている肝転移に対する補助化学療法のFOLFOX療法は、EORTC intergroup trial 40983(欧州で行われた、切除可能な肝転移を伴う大腸がんに対して、外科的切除単独と術前・術後のFOLFOX療法+外科的切除を比較した臨床試験)の結果に基づいて推奨されている治療法です。同試験では、肝転移を有する患者さんに対する術前・術後のFOLFOX療法は、無増悪生存期間(がんの増悪がなく生存している期間)には効果がありますが、全生存期間には効果がないことが示されました。さらに、切除可能な肝転移を有する大腸がん患者さんを対象とした同試験の術前・術後の化学療法のデータをまとめて、補助化学療法の価値について結論を出すことには注意が必要で、大腸がんの肝転移に対する補助化学療法の意義を明らかにするには、充分な精度をもった検証的な臨床試験が不可欠です。
注1. Abdalla EK, Adam R, Bilchik AJ, et al. Improving resectability of hepatic colorectal metastases: expert consensus statement. Ann Surg Oncol. 2006;13時12分71–80.
注2. Kemeny N. The management of resectable and unresectable liver metastases from colorectal cancer. Curr Opin Oncol. 2010;22時36分4-73.
研究方法と成果
そこで、JCOG大腸がんグループでは、日本の代表的な大腸がんの専門病院を中心に、標準治療である肝切除単独療法に対し、肝切除後に補助化学療法を行う治療の優越性を検証するランダム化比較第II/III相試験(JCOG0603/研究代表者:国立がん研究センター中央病院大腸外科科長 金光幸秀)を実施しました。
(臨床研究実施計画・研究概要公開システム https://jrct.mhlw.go.jp/latest-detail/jRCTs031180285 外部サイトにリンクします)
本試験計画時点で肝切除後にmFOLFOX6を行った第II相試験結果の報告はなかったために、登録開始から最初の78例(B群:mFOLFOX6群 39例)で第II相部分を行い、安全性を確認した後、引き続いて第III相部分を行う第II/III相試験としました。主要評価項目は第III相部分では無病生存期間、第II相部分ではmFOLFOX6療法の完遂割合、副次的評価項目は全生存期間、有害事象、再発形式としました。
対象の組み入れ規準は、年齢が20~75歳、組織学的に確認された切除可能な肝転移を有する大腸がん患者さん、原発巣と肝転移の両方が根治切除され、肝転移が最初で唯一の再発であること、全身状態が良好(ECOG PS 0または1)、CTまたはMRIで肝外転移や再発がないこと、オキサリプラチンを用いた化学療法の既往がないこと、十分な臓器機能を有すること、登録前3カ月以内に他の化学療法または放射線療法を受けていないこととしました。
2007年3月から2019年1月までに、300人がランダムに、肝切除単独療法、または、肝切除後に補助化学療法を行う治療に割り付けられ、どちらかの治療を受けました。第II相と第III相を合わせて手術のみ群が149人、化学療法群が151人でした。第II相部分は最初78人で行われましたが、mFOLFOX6の副作用による中止が多く起きたことから治療完遂割合を高めるために治療変更規準を変更したプロトコール改訂が行われ、その後第II相にさらに78人が登録されました。2019年12月の第III相部分の中間解析(データカットオフは2019年6月5日)では、肝切除後に化学療法を行った患者の方が無病生存期間が有意に長かったため、試験は早期に終了しました。
mFOLFOX6による補助化学療法は、肝切除単独に比べて無病生存期間を改善しましたが、全生存期間については肝切除単独群に比べて化学療法群が下回る傾向を認めました。化学療法群において、約半数で重篤な有害事象を認め、mFOLFOX6療法を3コース実施した後、1名が死亡しました。
5年間の無病生存割合は、肝切除単独群では38.7%、補助化学療法を行った群では49.8%で、補助化学療法群は肝切除単独群に比べて無病生存期間を改善しました。一方で、5年間の全生存割合は、肝切除単独群では83.1%、補助化学療法群では71.2%で、肝切除単独群に比べて補助化学療法群が下回る傾向を認めました。有害事象(副作用)については、補助化学療法群の約半数で重篤な有害事象を認め(グレード3以上の重篤な有害事象で最も多かったのは好中球減少50%、次いで感覚神経障害10%、アレルギー反応4%)、mFOLFOX6療法を3コース実施した後、1名が死亡しました。
展望
本試験の結果、肝切除後のmFOLFOX6は無病生存期間を改善しましたが、それに伴う全生存期間の改善がないことから、化学療法を一律に推奨すべきではないと結論づけられました。これまで十分な根拠がないまま広く行われていた肝切除後の補助化学療法に対して歯止めをかけ、肝転移巣の大きさが大きくない場合には、肝切除後はそのまま経過観察する治療が第一選択として推奨されることになります。
全生存期間の改善が見られない理由をより深く理解し、今後はどのような患者さんに対して化学療法を検討すべきかを明らかにする必要があります。わが国から発信する、肝切除後mFOLFOX6の意義に関する初の科学的エビデンスであり、本試験の結果により、日本だけでなく全世界の研究者に重要な情報を提供し、臨床が変わる可能性があります。
発表論文
雑誌名: Journal of Clinical Oncology
タイトル: Hepatectomy followed by mFOLFOX6 versus hepatectomy alone for liver-only metastatic colorectal cancer (JCOG0603): a phase II/III randomized controlled trial
著者: Kanemitsu Y, Shimizu Y, Mizusawa J, et al.
DOI: 10.1200/JCO.21.01032
URL: https://ascopubs.org/doi/abs/10.1200/JCO.21.01032
掲載日: 2021年9月14日
研究費
- 国立がん研究センター研究開発費
成人固形がんに対する標準治療確立のための基盤研究
23-A-19, 26-A-4, 29-A-3, 2020-J-3(重点課題・JCOG) - 平成19~21年度がん臨床研究事業および平成26~令和1年度の日本医療研究開発機構研究費
(革新がん-044, 16ck0106047h0003,17ck0106308h0001,18ck0106308h0002,19ck0106308h0003) - がん対策推進総合研究事業
大腸がん肝転移切除例に適した新規抗がん剤を用いた術後補助化学療法の研究
日本臨床腫瘍研究グループ(JCOG)の概要
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)は、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する各種委員会、中央支援機構(国立がん研究センター中央病院臨床研究支援部門)から構成されており、法人格を有さない任意団体です。
JCOG website: http://www.jcog.jp/index.htm(外部サイトにリンクします)
問い合わせ先
日本臨床腫瘍研究グループ(JCOG)
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 多施設研究支援室
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室