難治性疾患の新規治療標的候補を複数同定
2021-10-11 国立がん研究センター,慶應義塾大学医学部,宮崎大学,京都大学,日本医療研究開発機構
発表のポイント
- 単一細胞解析を行った事例のうち、単一疾患としては国際的にも最大規模の臨床検体を用いて、最新技術である単一細胞マルチオミクス解析(注1)を実施した。
- ひとつひとつの単一細胞から網羅的なmRNA発現データのみならず、100種類を超える細胞表面マーカー発現データや、T細胞/B細胞受容体レパトア情報を得られる技術を駆使し、ウイルス発がんの病態に迫った。
- 成人T細胞白血病リンパ腫(ATL)の原因ウイルスであるヒトT細胞白血病ウイルス1型(HTLV-1)の感染細胞を正確に同定可能で、従来の解析では不可能だった細胞群で発現解析を可能とした。
- その結果、新たなHTLV-1感染マーカー、ATL進展マーカーを複数同定し、新規の治療標的候補となりうることを実験的にも証明した。
- 本研究の網羅的解析により、HTLV-1感染やATLへの進展に伴う免疫微小環境(注2)の変化や、腫瘍細胞の遺伝子異常(注3)による微小環境の変容など、さまざまな事象が明らかとなり、今後のATL病態研究、ウイルス発がん研究の新たな方向性を提示した。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所 分子腫瘍学分野 古屋淳史主任研究員、斎藤優樹任意研修生、慶應義塾大学医学部内科学教室(血液) 片岡圭亮教授(国立がん研究センター分子腫瘍学分野 分野長を兼任)らの研究グループは、宮崎大学医学部内科学講座血液・糖尿病・内分泌内科学分野 下田和哉教授、京都大学大学院医学研究科腫瘍生物学講座 小川誠司教授らと共同で、最新技術である単一細胞マルチオミクス解析を用いて、ヒトT細胞白血病ウイルス1型(HTLV-1)感染を原因とする成人T細胞白血病/リンパ腫(ATL)の多段階発がん分子機構を解明しました。
本研究結果は2021年9月3日(米国東部時間)に米科学誌「Blood Cancer Discovery」に掲載されました。今回の研究の主な成果は以下の点です。
- 世界的にも最新の技術である単一細胞マルチオミクス解析を用いて、HTLV-1感染を原因とするATLの多段階発がん分子機構を解明しました。
- HTLV-1感染細胞を単一細胞レベルで正確に同定し、HTLV-1感染細胞のクローン拡大およびATLへの進展に伴う細胞動態の変化を分子レベルで網羅的に明らかにしました。その過程で、新たなHTLV-1感染関連分子やATL進展関連分子を複数同定し、新たな治療標的候補となりうることを実験的にも証明しました。
- HTLV-1感染やATL発症に伴う免疫微小環境の変化、そして腫瘍細胞の遺伝子異常による微小環境の変容などのさまざまな事象が、多くの機能解析実験と組み合わせることで紐解かれました。
これらの成果は、HTLV-1感染からATLへの進展に至るまでの非常に長い期間における多段階の発がん分子機構を網羅的に明らかにした初めての研究であり、新たに同定した感染や腫瘍化に関連する分子や、免疫環境動態の変化は診断のためのバイオマーカー(注4)や新しい治療標的にもなり得るため、難治性疾患であるATLの診療に役立つことが期待されます。
本研究は、日本医療研究開発機構 新興・再興感染症研究基盤創生事業(多分野融合研究領域)・日本医療研究開発機構 革新的がん医療実用化研究事業・日本医療研究開発機構 次世代がん医療創生研究事業・日本学術振興会 科学研究費助成事業・国立がん研究センター 研究開発費研究事業・公益財団法人武田科学振興財団 武田報彰医学研究助成・公益財団法人内藤記念科学振興財団 内藤記念科学奨励金・NPO法人白血病研究基金を育てる会 公益信託日本白血病研究基金の支援を受けて行われました。
背景
成人T細胞白血病リンパ腫(Adult T-cell leukemia/lymphoma,ATL)は造血器腫瘍(血液がん)のひとつで、HTLV-1感染を原因とするCD4陽性T細胞(注5)腫瘍として、日本での発症率が高い病気です。感染の主な経路は乳児期に母乳を介した母子感染で、近年では保健指導などの徹底によって無症候性キャリア(注6)の方や、ATLを新規に発症する人数は減少傾向にあります。しかしながら、現在でも年間700名ほどがATLに罹患し、造血幹細胞移植以外に治癒に至る治療法がないという予後不良の疾患です。
HTLV-1感染成立後にウイルス由来のタンパク質であるTaxなどによって、CD4陽性T細胞の不死化が引き起こされますが、主に免疫応答などによって最終的にATLの発症に至るのはHTLV-1感染キャリアの5%以下で、それも発症までに50年から70年程度と非常に長い年月を要します。このATL発症までの長い期間において、HTLV-1感染細胞はもちろん、それまでHTLV-1感染細胞を監視して増殖を抑え込んでいたリンパ球を中心とする免疫細胞にも変化が起きて、ひとつひとつの細胞の性質が不均一な状態が存在していることが想定されていました。しかし、これまでの研究技術では、さまざまな種類の細胞が混在した状態でしか網羅的遺伝子発現解析(注7)などを行うことができず、数百~数万個からなる不均一な細胞集団を平均した状態しか知ることができませんでした。
近年の技術革新によって、1細胞レベルでの網羅的な遺伝子発現状態を解析することが可能となり、さまざまな細胞の種類が含まれている状態の臨床検体からでも、個々の細胞を分けて解析することで、その細胞集団の不均一性や多様性を評価することができるようになりました。
研究方法・成果
研究グループは、この単一細胞遺伝子発現解析技術をさらに発展させた単一細胞マルチオミクス解析技術を用いてHTLV-1感染状態とATL発症状態における感染細胞や腫瘍細胞、そして免疫細胞の不均一性・多様性を明らかにしました。単一細胞マルチオミクス解析では、ひとつひとつの細胞から網羅的な遺伝子発現のみならず、100を超える細胞表面マーカー(注8)、T細胞/B細胞受容体レパトア(注9)などの情報を得ることのできる世界的にも最新の研究手法です(図1)。
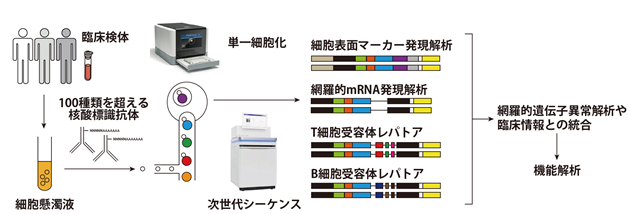
図1.本研究の解析の流れ
細胞表面マーカーは日常臨床でもフローサイトメトリー(注10)を用いて解析されており、細胞の種類を分類する際に非常に有用なツールですが、これまでは技術的な問題で、ひとつの細胞に対して一度に数種類から20種類程度の細胞表面マーカーしか調べることができませんでした。今回の解析では、それぞれのマーカーに対する抗体に特異的なオリゴヌクレオチドバーコード(注11)で標識する手法を用いており、これらを次世代シーケンサー(注12)で解析することによって、原理的には数千を超える細胞表面マーカーを同時に測定することが可能となります。これまでの血液学や免疫学では細胞表面マーカーによって細胞の種類を分類した上で、機能解析などを行ってきており、本研究手法はこれまで積み重ねられてきた表面マーカー情報と単一細胞網羅的遺伝子発現解析の結果を直接的に結び付ける画期的な実験系を採用しています。
本研究手法では、T細胞/B細胞受容体レパトアを組み合わせて解析できる点が非常に有用です。正常のリンパ球にHTLV-1が感染し、最終的に腫瘍化に至りますが、正常リンパ球、非腫瘍性感染リンパ球、そして腫瘍化したATL細胞を明確に区別することが極めて難しく、このことがATLの病態研究を行う上での障壁となっていました。今回、T細胞受容体レパトア情報を同時に得られることによって、モノクローナルに増殖している腫瘍細胞であるか否かを明確に区別することが可能となり、これが最大の利点となりました。
さらにこの単一細胞解析とは別に取得したそれぞれの臨床検体における遺伝子異常解析や、患者さんの臨床データ、そしてさまざまな機能解析実験を組み合わせることによって、HTLV-1感染状態およびATL発症状態を網羅的に描写し、病態の理解を深め、新たな治療標的を探索しました。
まず、健常ドナー4検体、無症候性HTLV-1感染キャリア11検体、そしてATL34検体の末梢血単核球を用いて、生細胞を選別した上で、オリゴヌクレオチドバーコードを付与した102抗体で標識したのちに、単一細胞解析のためのRNAサンプル調製を行い、次世代シーケンサーを用いて解析しました。(図1)。
その結果、合計49検体から233,093細胞について、網羅的遺伝子発現、細胞表面マーカー、T細胞/B細胞受容体レパトアの情報を得ました。
網羅的遺伝子発現データをもとに、クラスタリング(注13)を行った結果をUniform Manifold Approximation and Projection(UMAP)という手法で二次元上にプロットしました。さらに、代表的な細胞表面マーカーを用いてそれぞれの細胞集団がどの細胞の種類に属するかを区分し、CD4陽性T細胞については、上述したT細胞受容体レパトア解析の結果をもとに、腫瘍細胞と非腫瘍細胞に分類しました(図2)。
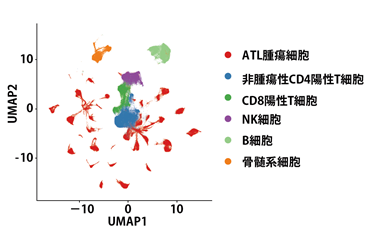
図2.解析した49検体233,093細胞の細胞系列同定
次に非腫瘍性CD4陽性T細胞(図2)を抽出し、再度クラスタリングを行ったのちに再び二次元上にプロットし直し、HTLV-1由来のmRNAであるHBZの発現レベルを重ね合わせたところ、非感染性ナイーブとエフェクターメモリーCD4陽性T細胞と非腫瘍性HTLV-1感染CD4陽性細胞に明確に区別することができました(図3)。この成果により、非感染正常CD4陽性T細胞、非腫瘍性HTLV-1感染CD4陽性細胞、そして腫瘍細胞であるATL細胞の間で遺伝子発現比較解析を行うことが可能になりました。
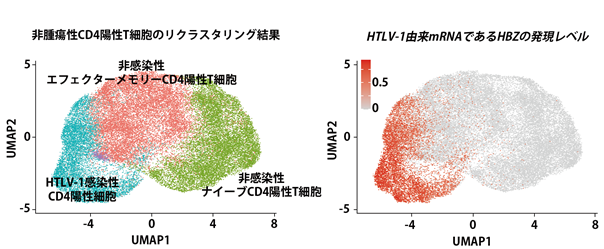
図3.非腫瘍性HTLV-1感染細胞の正確な同定
非腫瘍性HTLV-1感染細胞では非感染ナイーブとエフェクターメモリーCD4陽性T細胞と比較して、抗原提示(注14)に重要な分子群の発現が顕著に上昇していました(図4左)。さらにmRNAで最も発現が上昇していたLGALS1という分子について機能解析を行ったところ、LGALS1の高発現によって、同感染細胞が細胞障害性T細胞からの攻撃によるアポトーシス(注15)誘導を回避することを見出しました。
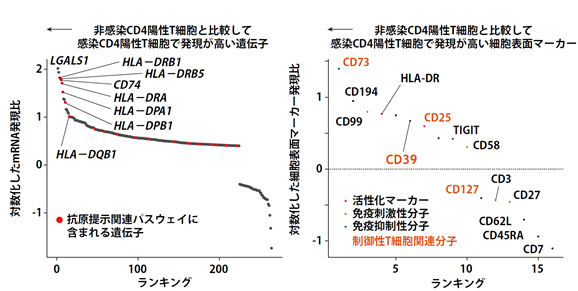
図4.非腫瘍性HTLV-1感染CD4陽性T細胞における遺伝子発現プロファイリング
また、細胞表面マーカー発現解析では非HTLV-1感染CD4陽性T細胞からHTLV-1感染CD4陽性T細胞、さらにはATLに進展するに従って発現が上昇する分子としてCD99を同定しました(図4右)。ATL細胞株でCD99を欠失させると増殖が抑制されたことから、新規の治療標的となる可能性があります。
さらに研究グループは、非腫瘍性HTLV-1感染CD4陽性T細胞に注目し、T細胞受容体レパトアを重ね合わせたところ、非腫瘍性HTLV-1感染CD4陽性T細胞中に既にクローン性に増殖している細胞があることが分かりました(図5左)。重要なことに、無症候性キャリア検体において、クローン増殖の程度は、末梢血単核球中のHTLV-1感染CD4陽性T細胞の割合に比例しており、ATLへの進展を示すバイオマーカーになる可能性が示されました。そこで、非腫瘍性HTLV-1感染CD4陽性を非クローン性細胞とクローン増殖している細胞に分けて遺伝子発現解析を行ったところ、感染に際して上昇していたMHC class II分子群が、クローン増殖している感染CD4陽性T細胞では低下しており、免疫機構からの回避がクローン増殖に寄与することが示唆されました(図5右)。
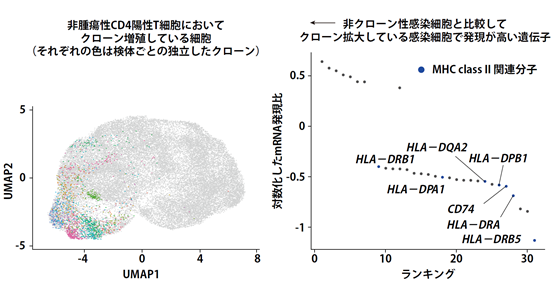
図5.クローン増殖している非腫瘍性HTLV-1感染CD4陽性T細胞の同定とプロファイリング
次に、HTLV-1感染状態とATL発症状態における免疫微小環境を評価するために、非腫瘍細胞中に含まれる各血液細胞分画の割合を比較したところ、CD8陽性T細胞の減少はHTLV-1感染状態でもATL発症状態でも認められる一方で、B細胞の減少や骨髄球系細胞の増加はATL発症状態に特異的であることが分かりました(図6)。
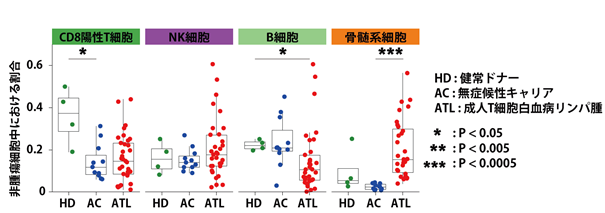
図6.健常ドナー/無症候性キャリア/ATLでの非腫瘍細胞分画中における割合の比較
最後に、腫瘍細胞における遺伝子異常が免疫微小環境に及ぼす影響を解析しました。ATL症例の20-30%で免疫チェックポイント分子(注16)であるPD-L1をコードしているCD274のmRNA構造異常が認められ、この遺伝子異常はATL細胞のPD-L1発現を上昇させ、免疫機構からの回避に寄与していることがこれまでに示されています。興味深いことに、今回の研究で、腫瘍細胞におけるこの遺伝子異常が、腫瘍細胞だけでなく、B細胞や骨髄系細胞といった非腫瘍細胞でもPD-L1の発現上昇をもたらしていることが明らかになりました(図7左)。そこで、研究グループが独自に作製したCD4陽性T細胞に特異的にPd-l1のmRNA構造異常を模倣する遺伝子改変マウスを用いて、Pd-l1の発現を解析したところ、CD4陽性T細胞のみならず、骨髄系細胞でもPd-l1の発現上昇を認め、実際に生体内においてPd-l1タンパク質が他の細胞に移行していることが示されました(図7右)。
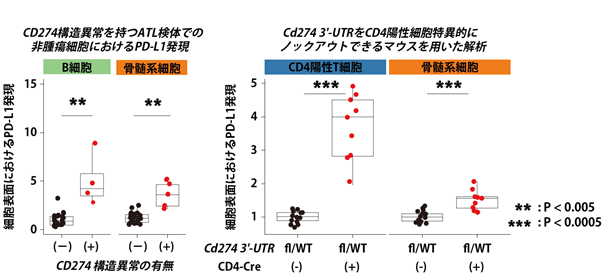
図7.CD274構造異常による非腫瘍細胞におけるPD-L1の発現上昇
この非腫瘍細胞に移行したPD-L1がATLの病態に関与しているかを解明するために、研究グループは共培養実験(注17)を行いました(図8上)。まずHEK293Tという不死化培養細胞にPD-L1-GFP(注18)融合タンパク質を強制的に高発現させ、正常の末梢血単核球と共培養を行ったところ、実際にPD-L1が移行することが確認されました(一次共培養、図8左下)。さらに、このPD-L1が移行した正常末梢血単核球と活性化させたCD8陽性T細胞と共培養を行ったところ、CD8陽性T細胞の増殖を抑制することが明らかとなりました(二次共培養、図8右下)。今回の単一細胞マルチオミクス解析でもPD-L1遺伝子異常を有する症例ではCD8陽性T細胞の割合が減少しており、腫瘍細胞のPD-L1高発現のみならず、非腫瘍細胞に移行したPD-L1も免疫微小環境の変化に影響を及ぼしている可能性が示唆されました。
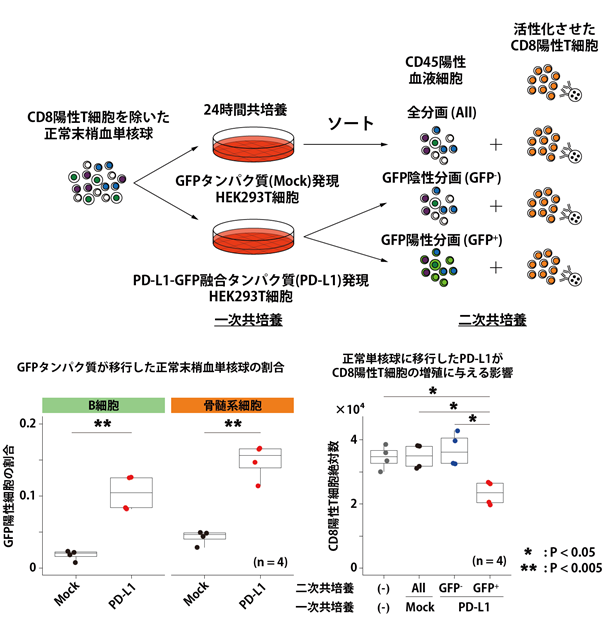
図8.PD-L1タンパク質の非腫瘍細胞への移行による免疫微小環境への影響
展望
研究グループは、単一疾患としては今までにない最大規模の単一細胞マルチオミクス解析を行うことにより、HTLV-1感染を原因とするATLの発がん分子機構を、感染細胞、腫瘍細胞、そして免疫微小環境のすべての面から網羅的に明らかにしました。
本研究が示すように、単一細胞マルチオミクス解析は、従来の解析では見出すことが技術的に不可能だった発がんメカニズムを明らかにする上で非常に有用です。研究グループは今後も単一細胞マルチオミクス解析の技術革新を図るとともに、その技術を臨床現場に応用していけるように、さらなる発がんメカニズムの全容解明を通じて、より病態に特異的で副作用の少ないと思われる治療標的の同定を目指します。
発表論文
- 雑誌名
- Blood Cancer Discovery
- タイトル
- Single-cell analysis of the multicellular ecosystem in viral carcinogenesis by HTLV-1.
- 著者
- 古屋淳史、斎藤優樹、亀田拓郎、木暮泰寛、湯浅光博、長崎譲慈、Marni B. McClure、新垣清登、田畑真梨子、田平優貴、秋月渓一、上運天綾子、関根雅明、幣光太郎、久冨木庸子、日高智徳、北中明、中野伸亮、宇都宮與、冨樫庸介、小川誠司、下田和哉、片岡圭亮
- 掲載日
- 2021年9月3日(米国東部時間)
研究費
- 日本医療研究開発機構 新興・再興感染症研究基盤創生事業(多分野融合研究領域)
「シングルセル免疫動態解析によるHTLV-1感染状態・関連疾患における宿主―病原体相互作用の統合的理解」(JP20wm0325013) - 日本医療研究開発機構 革新的がん医療実用化研究事業
「PD-L1分子異常による、がん-免疫ネットワーク変容・破綻の分子基盤および臨床的特性の解明」(JP19ck0106261)
「成人T細胞白血病・リンパ腫(ATL)最適化医療の確立とハイリスクキャリアの同定」(JP19ck0106254)
「単一細胞マルチオミクス解析による悪性リンパ腫の腫瘍細胞と微小環境の多様性の網羅的解明」(JP20ck0106542)
「遺伝子異常の全貌とクローン構造の理解に基づくATL個別化診療の確立」(JP20ck0106538) - 日本医療研究開発機構 次世代がん医療創生研究事業
「がん横断的解析による遺伝子異常の機能的・臨床的意義の統合的理解」(JP20cm0106575) - 日本学術振興会科学研究費助成事業
「CRISPRライブラリースクリーニングによるリンパ腫発症の遺伝子基盤の統合的理解」(19K22573) - 国立がん研究センター研究開発費研究事業
「大規模シングルセル解析の臨床応用に向けた検証研究」(31-A-4) - 公益財団法人武田科学振興財団 武田報彰医学研究助成
「全がん解析による網羅的な遺伝子異常の解明とそれに基づくがん免疫回避機構の探求」 - 公益財団法人内藤記念科学振興財団 内藤記念科学奨励金
「免疫チェックポイントゲノム異常によるリンパ腫発症・進展機構の解明」 - NPO法人白血病研究基金を育てる会 公益信託日本白血病研究基金
「免疫関連ゲノム異常が腫瘍微小環境に与える影響の解明」
用語解説
- 注1:単一細胞マルチオミクス解析
- ひとつひとつの単一細胞から網羅的な手法を用いてmRNA発現や細胞表面マーカー発現などさまざまなデータを得ることのできる新規技術。
- 注2:免疫微小環境
- 腫瘍組織やその周囲に混在する正常組織や免疫細胞を含んだ環境。さまざまな細胞・非細胞成分から構成され、腫瘍の進行に大きな役割を果たすことが知られている。
- 注3:遺伝子異常
- 遺伝子DNAに生じた異常。
- 注4:バイオマーカー
- 病気の変化や治療に対する反応に相関し、その指標となるもの。
- 注5:CD4陽性T細胞
- 白血球中のリンパ球の一種で、ウイルスや細菌を攻撃する司令官として機能する。
- 注6:無症候性キャリア
- HTLV-1感染は持続しているが、ATLやそれ以外のHTLV-1感染を原因とする疾患に進展せず、症状がない状態。
- 注7:網羅的遺伝子発現解析
- 複数の検体間で複数の遺伝子の発現レベルを網羅的に比較する研究手法。
- 注8:細胞表面マーカー
- 細胞の表面に存在する細胞の起源や性格を示す目印となるタンパク質。
- 注9:レパトア
- 免疫細胞であるT細胞やB細胞は、多種多様な抗原に反応できるように、ひとつひとつの細胞が異なる特異性を持つT細胞受容体やB細胞受容体を細胞の表面に発現している。この受容体によって特徴づけられる集団。
- 注10:フローサイトメトリー
- 検体中に存在する細胞などの特性を、光や蛍光色素などを利用してひとつずつ、迅速かつ高感度に測定する方法。
- 注11:オリゴヌクレオチドバーコード
- 個々の分子や細胞を識別するためにA、T、C、Gを組み合わせて作られたバーコード。
- 注12:次世代シーケンサー
- 塩基配列(シーケンス)を高速に読み出せる技術。次世代シーケンス技術の発展により、同時に多数の遺伝子の異常を調べることが可能になった。
- 注13:クラスタリング
- データ間の類似度にもとづいて、データをグループ分けする手法。
- 注14:抗原提示
- マクロファージや樹状細胞が取り込んだ異物の一部を細胞膜の外に示し、T細胞が認識できるようにすること。
- 注15:アポトーシス
- 細胞の死に方の一種で、能動的な細胞死。
- 注16:免疫チェックポイント分子
- 免疫状態を保つために自己に対する免疫応答を抑えるとともに、過剰な免疫反応も抑制する分子群。
- 注17:共培養実験
- 異なった2種類以上の細胞や組織を同じ試験管上で培養すること。細胞間の相互作用を再現することが可能となる。
- 注18:GFP
- 緑色蛍光タンパク質(Green Fluorescent Protein)。解析したいタンパク質に融合することで、フローサイトメトリーや蛍光顕微鏡などを用いて細胞内における局在を知ることができる。
お問い合わせ先
研究に関する問い合わせ
国立がん研究センター
研究所 分子腫瘍学分野
古屋淳史
慶應義塾大学医学部
内科学教室(血液)
片岡圭亮
広報窓口
国立がん研究センター
企画戦略局 広報企画室
慶應義塾大学
信濃町キャンパス総務課
宮崎大学
企画総務部総務広報課広報係
京都大学
総務部広報課 国際広報室
AMED事業に関する問い合わせ
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課