2021-11-12 東京大学
1. 発表者:
原田 雄仁 (東京大学大学院薬学系研究科 特任助教)
川口 大地 (東京大学大学院薬学系研究科 助教)
後藤 由季子 (東京大学大学院薬学系研究科 教授/東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)主任研究者)
2. 発表のポイント:
◆大人の脳に存在する神経幹細胞は、胎生期の特別な幹細胞集団(起源細胞)から作られます。
◆起源細胞が大人までの長い間、幹細胞として維持される分子メカニズムを明らかにしました。
◆大人の神経幹細胞から作られる神経細胞は学習・記憶、損傷修復、本能行動などに寄与し、その異常は精神・神経疾患の症状の一部を担う可能性があります。本成果は、これら疾患の理解や治療法の開発に繋がることが期待されます。
3.発表概要:
哺乳類の脳には神経幹細胞が存在し、生涯にわたり神経細胞を産むことで学習・記憶、脳の損傷修復、本能行動などに貢献します。成体脳での神経幹細胞の異常が、様々な精神疾患や神経変性疾患の症状に関与する可能性が報告されています。先行研究によって、マウス成体の神経幹細胞は、胎生期において細胞分裂が抑制された特別な細胞集団(起源細胞)に由来することが明らかとなりました。しかし、細胞分裂の抑制がいかにして起源細胞の出現につながるのかは不明でした。
今回、東京大学大学院薬学系研究科の原田雄仁特任助教、川口大地助教、後藤由季子教授らの研究グループは、胎生期の神経幹細胞の分裂抑制により、Notch-Hey1経路が活性化することを見出しました。さらに、Hey1が安定した発現様式を示すことで、分化遺伝子の発現を持続的に抑制し、起源細胞の形成・安定維持に貢献することを発見しました(図)。この研究は、一生維持される神経幹細胞が形成される初めのステップを明らかにしたものであり、精神・神経疾患の発症機序の理解や、幹細胞を利用した脳の損傷に対する治療に繋がることが期待されます。
本研究成果は、日本時間11月12日(金)付で米国科学誌Nature Communicationsに掲載されました。
4.発表内容:
①研究の背景
哺乳類の脳には、発生が完了した後も生涯にわたって神経細胞を作り続ける神経幹細胞が存在します。成体の神経幹細胞により産まれた神経細胞は、既存の神経回路に組み込まれることで、学習・記憶、脳の損傷修復、本能行動などに貢献します。
成体神経幹細胞は、細胞分裂を停止した静止状態を保っており、稀にしか分裂しません。静止状態は、成体神経幹細胞が生涯維持されるのに重要です。一方で、胎生期の神経幹細胞は、限られた期間に多くの分化細胞を産み出す必要があるため、盛んに分裂します。これまで、成体神経幹細胞は、胎生期の盛んに分裂した神経幹細胞からランダムに選ばれると考えられていました。しかし先行研究によって、胎生期神経幹細胞の中には分裂を抑制した細胞集団(起源細胞)が存在し、この集団が将来、大脳脳室下帯(注1)の成体神経幹細胞になることが明らかになりました。すなわち、胎生期の脳内には、盛んに分裂する神経幹細胞と、分裂を抑制した成体神経幹細胞の起源細胞が共存しており、それぞれが「短期間での脳の発生」と「長期間の幹細胞維持」という異なる役割を果たすことが示されました。しかし細胞分裂の抑制がどのようなメカニズムで成体神経幹細胞の起源細胞の形成・維持に貢献するかは不明でした。
②研究内容
今回、東京大学大学院薬学系研究科の原田雄仁特任助教、川口大地助教、後藤由季子教授らの研究グループは、成体神経幹細胞とその起源細胞で分裂を抑制する、CDK阻害因子p57(注2)に着目し、分裂の抑制が起源細胞の形成と、大人までの長期維持に貢献する分子メカニズムを初めて明らかにしました。
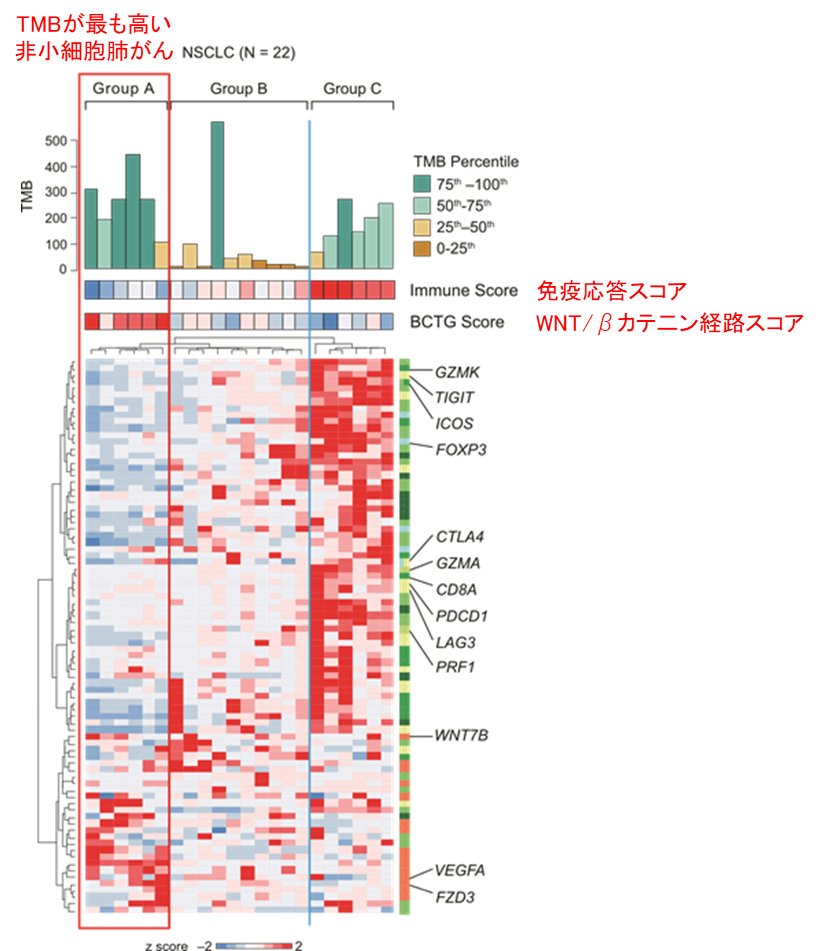
まず、分裂の抑制が神経幹細胞に与える影響を調べるために、胎生期の盛んに分裂する神経幹細胞にp57を発現し、人為的に細胞分裂を抑制しました。網羅的遺伝子発現解析を行った結果、分裂を抑制した神経幹細胞の遺伝子発現プロファイルが成体神経幹細胞に近づく(つまり分裂を止めるだけで成体神経幹細胞様に転換する)ことを発見しました。
次に、分裂抑制による幹細胞長期維持メカニズムを探索しました。その結果、p57の発現によりNotchシグナル経路(注3)が高レベルで活性化することを見出しました。胎生期の盛んに分裂する神経幹細胞では、Notchシグナル下流でHes1とHes5が機能することが知られています。一方で研究グループは、分裂を抑制した起源細胞におけるNotchシグナル下流因子を調べたところ、(Hes1/Hes5ではなく)Hey1が選択的に活性化されることを発見しました。そこで、Hey1が成体神経幹細胞と起源細胞に貢献するかを検討するために、Hey1ノックアウトマウス(注4)の脳組織を観察しました。その結果、Hey1ノックアウトマウスでは正常マウスと比べて起源細胞と成体神経幹細胞の数が減少していました。すなわち、分裂抑制の下流でHey1が誘導されることが、起源細胞の形成・維持に必須の役割を果たすことが示されました。
それでは、Hey1はどのように起源細胞に貢献するのでしょうか?Hes1/Hes5と比べ、Hey1には特別な性質があるのでしょうか?胎生期の盛んに分裂する神経幹細胞では、Hes1とHes5が“振動発現”することで、分化遺伝子の振動を引き起こし、幹細胞の増殖とその後の分化を制御します(図左)。一方で起源細胞は、増殖や分化を抑えて、大人までの長期間幹細胞として維持されます。そこで、Hey1は(Hes1/Hes5とは異なり)振動せず安定的に発現することで、分化遺伝子を持続的に抑制するのではないかと考えました。この仮説を検討する為、培養系神経幹細胞を用いてHey1とHes5の発現動態を比較しました。その結果、Hes5は先行研究通り約90分周期の振動発現を示したのに対し、Hey1は振動せず安定して発現することを発見しました。このことから、起源細胞ではHey1が安定かつ高いレベルで発現することで、分化因子を持続的に抑制し、未分化な状態を強固に維持することが示唆されました(図右)。
以上のように、研究グループは、分裂頻度の違いによるNotchシグナル下流因子の使い分け(Hes1/Hes5対Hey1)によって、「胎生期に脳をつくる神経幹細胞」と「生涯維持される神経幹細胞」がそれぞれ制御されることを新たに発見しました。
③社会的意義・今後の予定など
大人の脳における神経細胞の新生は、学習・記憶、脳の損傷修復や恒常性維持に貢献し、その異常が精神疾患や神経疾患の症状に関与する可能性が報告されています。本研究は、その担い手となる成体神経幹細胞が発生期からどのように形成・維持されるかを分子的に明らかにした点で大きな意義があります。また、Notchシグナルは、様々な組織の幹細胞運命制御を担う非常に重要な分子経路です。本研究は、Notchシグナル下流因子の発現動態の違いと、それを利用した胎生期 vs成体期幹細胞の運命制御メカニズムの違いを世界で初めて示したものであり、発生や幹細胞の研究分野にとっても非常に重要な発見です。
<本研究の主な助成事業>
科学研究費補助金(JP17J09837, JP18K06477, JP16H06481, JP16H06279, JP16H06479, JP15H05773)、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域における研究開発課題「胎児における神経幹細胞の制御はいかにして生後脳の発達と自閉症様行動に影響するか」(研究開発代表者:後藤由季子)
5.発表雑誌:
雑誌名:Nature Communications(11月12日オンライン版)
論文タイトル:Cell cycle arrest determines adult neural stem cell ontogeny by an embryonic Notch-nonoscillatory Hey1 module
著者:Yujin Harada, Mayumi Yamada, Itaru Imayoshi, Ryoichiro Kageyama, Yutaka Suzuki, Takaaki Kuniya, Shohei Furutachi, Daichi Kawaguchi* & Yukiko Gotoh*
DOI番号:10.1038/s41467-021-26605-0
6.問い合わせ先:
(研究に関すること)
東京大学大学院薬学系研究科
教授 後藤 由季子(ごとう ゆきこ)
東京大学大学院薬学系研究科
助教 川口 大地(かわぐち だいち)
(広報に関すること)
東京大学国際高等研究所ニューロインテリジェンス国際研究機構(WPI-IRCN)
広報担当
7.用語解説
注1:大脳脳室下帯
大脳脳室下帯は、側脳室の壁に沿った領域。哺乳類脳の大脳脳室下帯と海馬歯状回の少なくとも二つの領域には成体神経幹細胞が存在し、生涯にわたって神経細胞を新生する。
注2:CDK(Cyclin-dependent kinase)阻害因子p57
細胞周期の進行に必須なサイクリン依存性キナーゼを阻害することで、細胞周期を遅らせるタンパク質。
注3 : Notchシグナル経路
幹細胞の増殖や分化などの運命決定に寄与するシグナル伝達経路。細胞膜上に発現するNotchタンパク質と隣接細胞の膜上に発現するNotchリガンドが結合することによってシグナルが伝達される。Notch活性化の下流では、Hes/Heyファミリー遺伝子が誘導されることで、分化遺伝子を抑制する。
注4:ノックアウトマウス
標的遺伝子を破壊することで、そのタンパク質が作られなくなったマウス。
8.添付資料:
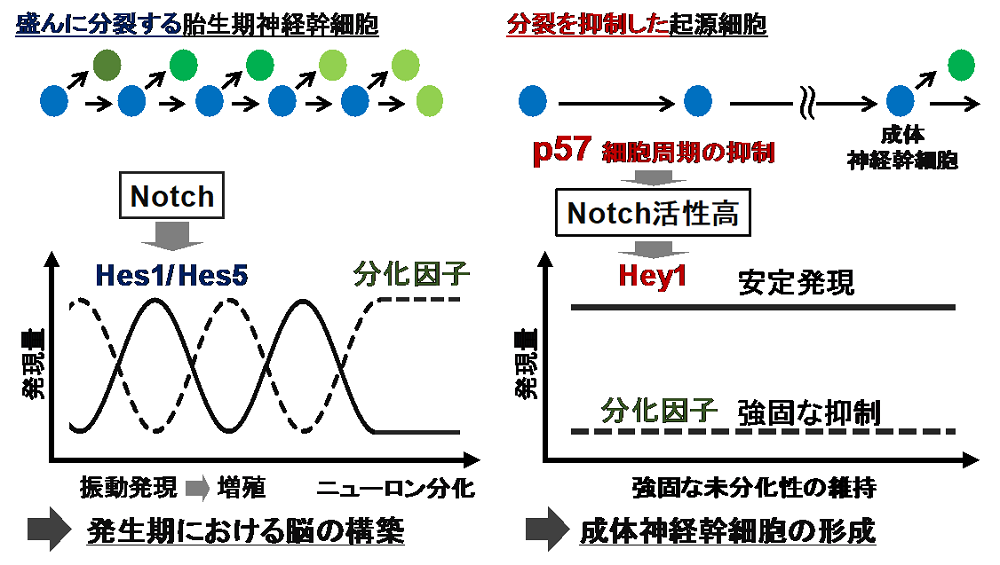
図 本研究のモデル図。盛んに分裂する神経幹細胞では、Hes1/Hes5が振動することで幹細胞の増殖と分化を制御します(左)。一方、成体神経幹細胞の起源細胞では、分裂抑制の下流でHey1が振動せず安定的に高発現することで、強固な未分化性の維持に貢献することを明らかにしました(右)。