2021-12-21 東京大学
1.発表者
辻村 真樹(東京大学 大学院工学系研究科 応用化学専攻 修士課程2年)
小島 慧一(岡山大学 学術研究院 医歯薬学域 助教)
須藤 雄気(岡山大学 学術研究院 医歯薬学域 教授)
石北 央(東京大学 先端科学技術研究センター 理論化学分野/大学院工学系研究科 応用化学専攻 教授)
2.発表のポイント
- 理論化学的手法と生化学的手法を用いて、光による神経抑制を可能にするタンパク質であるアニオンチャネルロドプシン(ACR)の反応メカニズムを明らかにしました。
- 光照射に伴ってACRの内部で起こる陰イオンの透過と水素イオンの移動を、2つのアミノ酸残基を連携させるという巧みな方法により制御できることを示しました。
- 今後、ACRの機能の向上や改変の基盤になる結果であり、光遺伝学ツール開発に大きく貢献することが期待されます。
3.発表概要
東京大学先端科学技術研究センターの石北央教授、同大学大学院工学系研究科の辻村真樹大学院生、岡山大学学術研究院医歯薬学域の須藤雄気教授および小島慧一助教らの共同研究グループは、光に応答して陰イオンを透過するタンパク質の反応メカニズムを明らかにしました。
アニオンチャネルロドプシン1(ACR1)は、光を受容して陰イオンを透過する膜タンパク質です。ACR1は、光によって神経活動を自在に制御する技術である「光遺伝学(注1)」において広く用いられていますが、ACR1が陰イオンを透過するメカニズムは分かっていませんでした。
研究グループは理論化学的手法と生化学的手法を組み合わせて、ACR1の変異体が吸収する光の波長を解析しました。その結果、色素の近くに存在する2つのアミノ酸残基が、光照射後に起こる陰イオンの透過を水素イオンの移動とともに制御することが分かりました。
本研究成果は、ACR1の反応メカニズムをさらに明らかにしていくための基盤になるとともに、光遺伝学ツールとしてのACR1の、機能の向上や改変に貢献することが期待されます。
本研究成果は、2021年12月21日(日本時間)に国際学術誌「eLife」に掲載されました。
4.発表内容
多くの生物は光を受容するためのタンパク質を持ちます。ロドプシンはレチナール(注2)を色素とする膜タンパク質であり、微生物からヒトにまで広く保存されています。藻類が持つアニオンチャネルロドプシン1(ACR1)は、光を受容して陰イオンを透過します。この性質から、ACR1を神経細胞に発現させると、光の照射によりその神経細胞の活動を「オン」から「オフ」に切り替えることができます。そのためACR1は、光によって神経活動を自在に制御する技術である「光遺伝学」において広く用いられています。
ところがこれまで、ACR1が陰イオンを透過するメカニズムは分かっていませんでした。ACR1はレチナールとタンパク質の接合部分である「シッフ塩基」の近くに、アスパラギン酸(Asp234:注3)とグルタミン酸(Glu68:注4)を持ちます(図1)。アスパラギン酸やグルタミン酸はカルボキシ基(COOH)をもつため、水素イオンを解離した負電荷を帯びた状態(COO–)と、解離しておらず電荷をもたない状態(COOH)の2通りで存在する可能性が考えられます(図2)。多くの先行研究において、Asp234は水素イオンを解離していない電気的に中性な状態(COOH)として存在すると指摘されてきました。これは主に、Asp234を電気的に中性であるアスパラギン(図2)に変えた変異体:D234Nが吸収する光の波長が、変異導入をしていない野生型ACR1と一致するためです(図3a, b)。Asp234がもし水素イオンを解離した負電荷として存在するのであれば、それを電荷中性のアミノ酸であるアスパラギンに変異させると、静電相互作用が大きく変化するために吸収波長は大きく変わるはずです。一方で、D234N変異体は野生型ACR1と異なり、陰イオンを透過しません。D234N変異体が陰イオンを透過しない理由を明らかにできれば、野生型ACR1が陰イオンを透過するメカニズムの解明に近づくと考えられます。
研究グループは、Asp234とGlu68を異なるアミノ酸に変異させた変異体ACR1が吸収する光の波長に注目しました。分子動力学法(注5)と量子化学的手法(QM/MM法、注6)を組み合わせた理論化学的な手法を用いて、光の吸収波長を計算しました。また、変異体ACR1をヒト由来の培養細胞で合成し、吸収波長を測定しました。Asp234は、水素イオンを解離した状態(COO–)で存在すると仮定すると、吸収波長の計算値と実験値が一致しました。この結果はAsp234が水素イオンを解離した負電荷を帯びた状態(COO–)で存在することを示すものであり、これまでの定説を覆すものです。それではなぜ、(1) D234N変異体の吸収波長は野生型ACR1と一致し、(2) D234N変異体は野生型ACR1と異なり、陰イオンを透過しないのでしょうか。鍵を握っていたのがGlu68(図1)でした。なおGlu68は野生型ACR1においては、水素イオンを解離していない状態(COOH)で存在します。
(1) 負電荷を持つAsp234を電荷中性のアスパラギンに変異させても吸収波長が変わらないのは、D234N変異体においてGlu68が水素イオンを解離し(COO–)、シッフ塩基の方向に配向を変え、変異によって失われるAsp234の負電荷を埋め合わせているためでした(図3c, d)。 (2) D234N変異体が陰イオンを透過しないのは、水素イオンを解離し、配向を変えたGlu68が、陰イオンの透過経路を塞いでしまうためでした(図4)。Glu68は物理的にイオンの透過経路を塞ぎます。また、水素イオンを解離したGlu68(COO–)は負電荷を持っていますので、同じく負電荷を持つ陰イオンとの静電反発によっても、陰イオンの透過を防ぐのです。
これらの結果は、Glu68が水素イオンの解離状態を変え、配向を変えることで、陰イオンの透過を制御する「門番」として働くことができることを示しています。実際に、光反応の途中、L中間体からM中間体に遷移するときに、Glu68が向きを変えて水素イオンの移動経路を形成する構造変化が、陰イオンの透過経路を切断することで陰イオンが流れなくなる機構が明らかになりました(図5)。
本研究は、ACR1において陰イオンの透過に必須であるAsp234が、これまでの定説とは異なり、水素イオンを解離した負電荷を帯びた状態で存在することを明らかにしました。さらに、Glu68が水素イオンの解離状態と配向を変えることで、陰イオンの透過を制御する「門番」として働くことを示しました。これらの結果は、ACR1の反応メカニズムをさらに詳細に明らかにしていくための基盤になるとともに、光遺伝学ツールとしてのACR1の、機能の向上や改変に貢献することが期待されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業チーム型研究(CREST)(課題番号JPMJCR1656)日本学術振興会科学研究費助成事業(課題番号:JP21K15054, JP20K21482, JP21H0040413, JP21H0244613, JP18H05155, JP18H01937, JP20H03217, JP20H05090)等の支援を受けて実施しました。
5.発表雑誌
- 雑誌名:
- 「eLife」
- 論文タイトル:
- Proton transfer pathway in anion channelrhodopsin-1
- 著者:
- Masaki Tsujimura, Keiichi Kojima, Shiho Kawanishi, Yuki Sudo*, Hiroshi Ishikita*
- アブストラクトURL:
- https://doi.org/10.7554/eLife.72264
6.用語解説
(注1)光遺伝学
神経細胞などの活動の「オン」と「オフ」を光により制御する手法。光に応答してイオンを通すタンパク質を、遺伝学的な手法を用いて神経細胞に発現させると、その神経細胞の細胞膜間で起こるイオンの移動を光で制御することができる。神経細胞の活性化や抑制は、細胞膜間のイオンの移動をきっかけとするので、光の照射により神経細胞の活動を制御できる。
(注2)レチナール
タンパク質と結合して、動物の視覚や、微生物による光エネルギーの獲得などに関わる色素。光照射に伴うレチナールの異性化反応により、タンパク質の構造が変化することで、シグナル伝達やイオン輸送などの機能が発現する。
(注3)アスパラギン酸
側鎖にカルボキシ基(COOH)を持つアミノ酸(図2)。水素イオンの解離状態に応じて、負電荷を帯びた状態(COO–)と、解離しておらず電気的に中性の状態(COOH)の2通りで存在し得る。
(注4)グルタミン酸
アスパラギン酸と同様に、側鎖にカルボキシ基(COOH)を持つアミノ酸(図2)。水素イオンの解離状態に応じて、負電荷を帯びた状態(COO–)と、解離しておらず電気的に中性の状態(COOH)の2通りで存在し得る。
(注5)分子動力学法
タンパク質などの分子を構成する原子に働く力、およびその動きを計算することで、分子内で起こる原子の物理的な動きを解析する方法
(注6)QM/MM法(quantum mechanical/molecular mechanical approach)
タンパク質などの高分子に対し、注目する部分は精度が高い量子化学計算を、それ以外の部分は計算コストの小さい分子力学計算を適用して、分子内で起こる化学反応などを解析する方法。
7.添付資料
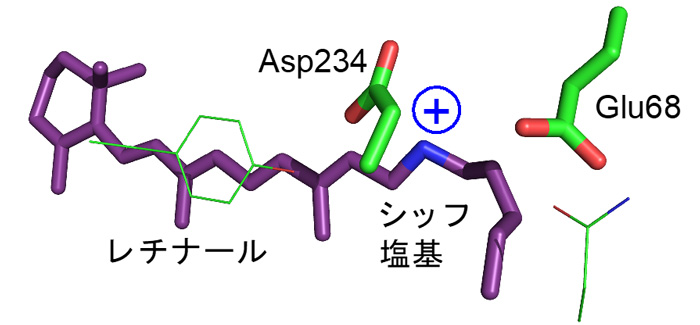
図1. ACR1におけるレチナール周辺の構造。シッフ塩基は正電荷を帯びています。
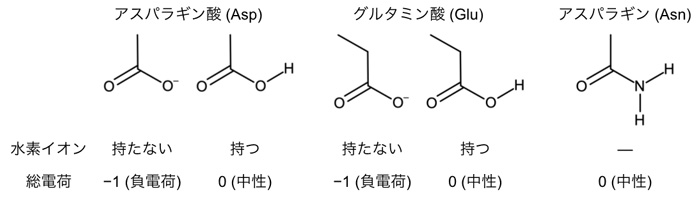
図2. アスパラギン酸(Asp)、グルタミン酸(Glu)、アスパラギン(Asn)のアミノ酸側鎖の化学構造。
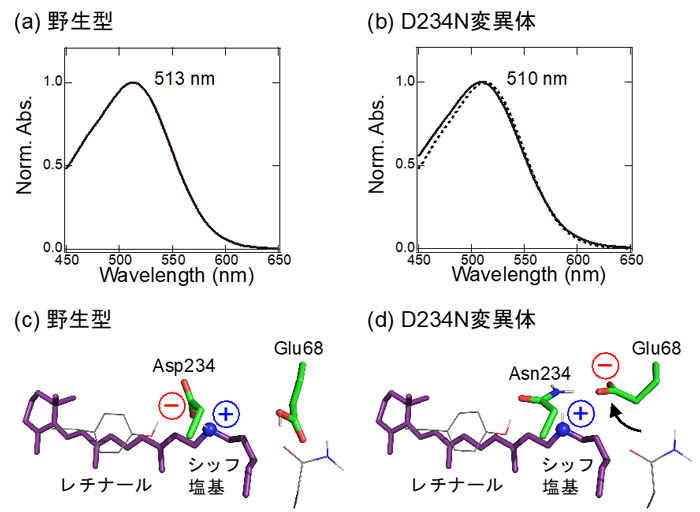
図3. (a) 野生型ACR1と (b) D234N変異体の吸収スペクトル。(b) における点線は、野生型ACR1の吸収スペクトルを示します。(c) 野生型ACR1と (d) D234N変異体におけるレチナール周辺のアミノ酸残基の構造。D234N変異体において、負電荷を持ったGlu68がシッフ塩基の方向に配向を変えることで、変異によって失われたAsp234の負電荷を補う働きをしています。
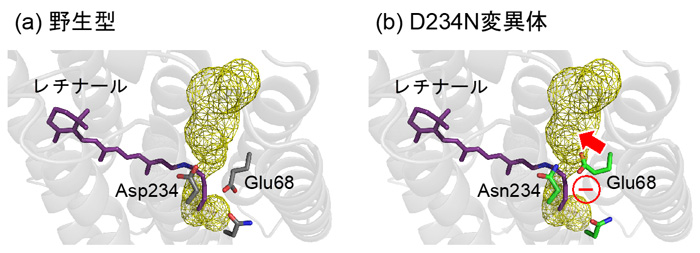
図4. (a) 野生型ACR1と (b) D234N変異体におけるAsp/Asn234とGlu68の配向。黄色のメッシュは陰イオンの透過経路を示しています。D234N変異体において、負電荷を持ったGlu68が陰イオンの透過経路と干渉します。その結果Glu68は、陰イオンが透過できるスペースを物理的に狭くします。同時に、同じく負電荷を持つ陰イオンとの静電反発も、陰イオンが透過することを防ぎます。
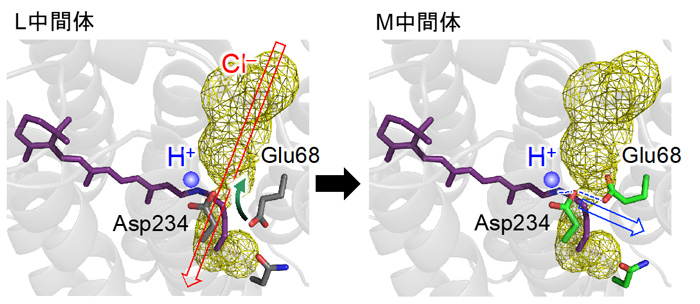
図5. 光反応の途中、L中間体からM中間体に遷移するときに起こる構造変化。Glu68が向きを変えてAsp234とともに水素イオン(H+)の移動経路を形成する構造変化が、陰イオン(Cl-)の透過経路を切断することで陰イオンが流れなくなります。