2022-02-18 鹿児島大学,日本医療研究開発機構
鹿児島大学の小戝健一郎教授(大学院医歯学総合研究 遺伝子治療・再生医学分野 教授、附属南九州先端医療開発センター長、鹿児島大学病院 探索的医療開発センター長)を研究開発代表者(総括責任者)、永野聡教授(医学部保健学科 理学療法学専攻 臨床理学療法学 教授/大学病院 探索的医療開発センター 副センター長)を治験調整/責任医師とする研究グループは、独自開発した腫瘍溶解性アデノウイルスのSurv.m-CRA-1(サバイビン反応性・多因子増殖制御型アデノウイルス)*1の第Ⅰ相試験を実施・完了し、安全性と治療効果の両面で良好な結果を得ました。今回、この成果を踏まえ、世界初の悪性骨腫瘍への承認(実用化)を目指した多施設共同(鹿児島大学、国立がん研究センター中央病院、久留米大学)の第Ⅱ相試験を開始します。
ポイント
世界で初めて悪性骨腫瘍への承認を目指す、独自開発した腫瘍溶解性ウイルス(OV) “Surv.m-CRA-1”の、第Ⅱ相多施設医師主導治験
- 次世代のOVを効率的に作製できるプラットフォーム技術(m-CRA)*2を用いて、第一弾医薬品(再生医療等製品)としてSurv.m-CRA-1を日本で独自開発
- ICH*3準拠の非臨床ならびに臨床開発まで全て研究者グループのアカデミアが主体となって実施
- First-in-Human*4第Ⅰ相医師主導治験では高い安全性と一部有効性を確認し、世界の競合技術を凌ぐ性能を示唆
- 今回、世界初の悪性骨腫瘍へのOVの実用化を目指す第Ⅱ相医師主導治験を多施設共同で開始
- 有効な治療法がないアンメット・メディカル・ニーズの悪性骨腫瘍への画期的治療薬となることが期待される
- グローバル基準で遺伝子治療製剤を海外施設で製造
- 日本医療研究開発機構(AMED)などの公的研究費でここまで開発を進めた実績を持ち、今後は企業連携で実用化を目指す
- さらに開発中の一連の次世代OVシーズの実用化の加速に繋がり、本分野での日本の科学技術・市場形成に繋がる大きな波及効果が期待できる
背景
遺伝子治療の世界と日本での開発状況
遺伝子治療は、次世代医療の最重要技術分野の一つであり、特に近年は、実用化に向けた開発が世界的に加速化しています。さらに新型コロナウイルス・ワクチンで、新モダリティ(治療手段)としての遺伝子治療技術の革新性や有用性が広く認知されたこともあり、今後、遺伝子治療製品の開発競争は世界的にはさらに加速していくものと考えられます。しかし一方で現状でのin vivo遺伝子治療製品(ex vivo遺伝子細胞治療、新型コロナウイルス・ワクチンを除く)の承認薬は、本分野全体でも米国で三品目、日本では条件付き承認の二品目のみで、OVという本技術分野に限れば、次項記載のように承認薬は日米欧でも二品目に過ぎません。さらに悪性骨腫瘍に対して承認された遺伝子治療薬は、OVに限らず遺伝子治療薬全体としても、世界でも未だ例がありません。
腫瘍溶解性ウイルス(OV)の開発状況
がん細胞だけで増殖してがん細胞のみを殺傷するように遺伝子改変したOVは、1品目が2015年に欧米でFirst-in-Class医薬品*5として初めて承認され、2021年には日本で1品目が条件付き承認を得ています。さらにOV療法と免疫チェックポイント阻害剤との併用の臨床試験で、相乗的治療効果がもたらされることが明らかにされています。このため世界的にはOV技術分野全体が革新的がん治療薬の最有力候補の一つとして期待され、さらに優れた治療性能を持つ新たなOVの探索と開発が最重要課題となっています。
しかしOVは、技術開発自体が高度専門性を要求されるだけでなく、その非臨床開発(製剤製造、安全性試験、規制対応)や医師主導治験を含む臨床開発も、通常の低分子医薬品と比べて特殊であるため、高度専門性が必要です。つまり従来は、高度の遺伝子改変を施したOVを短期間に多数作製すること自体が非常に困難でした。つまり基礎研究段階で複数の候補OVを比較検討して最善のものを選ぶということができないため、「決め打ち」した「単純構造」のOVを臨床開発していくため、臨床試験で良好な結果が得られず、開発が頓挫してしまっている例が数多くありました。
また実用化には、これらをグローバル基準で行う必要があります。日本では、研究者自身が国内で独自開発したOV技術を、さらにICH準拠の非臨床開発、First-in-Human第Ⅰ相医師主導治験、承認を目指した多施設共同・第Ⅱ相医師主導治験まで研究者自身が進めてきた例は、極めて稀(おそらく国内初)と思われます。
悪性骨腫瘍について
骨に「がん」が発生する原発性骨悪性腫瘍(悪性骨腫瘍)は、肉腫と呼ばれる腫瘍がほとんどで、肉腫全体では約25%が骨の肉腫です。100万人に対し4人(日本全体で年間500-800人)の発症頻度の、いわゆる希少がん(数が少ないが故に診療・受療上、不利な状況にあると考えられるがん種)の代表です。多くの悪性骨腫瘍には有効な治療法がなく、革新的な医薬(遺伝子治療、分子標的薬、免疫チェックポイント阻害剤など)も開発が十分には進んでいない、アンメット・メディカル・ニーズ(いまだに有効な治療方法が見つかっていない病気に対する、新しい治療薬や治療法への患者さん、医師からの強い要望)の高い難治性がんの一つです。悪性骨腫瘍に対して承認されたOVや遺伝子治療薬は、世界でも未だ例がありません。
m-CRA技術とSurv.m-CRA-1について
開発代表者は、革新的な治療性能を持つ次世代OVを効率的に開発するために、まずm-CRAというプラットフォーム技術を独自開発しました(図1)。
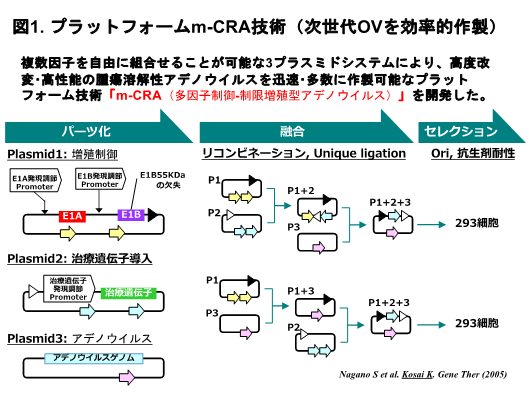
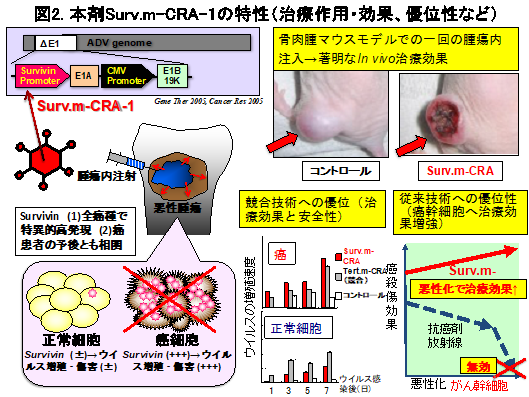
m-CRA技術で開発した第一弾創薬シーズのSurvivin反応性m-CRA(Surv.m-CRA)は、基礎研究において、1)治療効果と安全性とも競合技術を凌ぎ、2)癌特異性(安全性)をさらに向上する技術、3)既存治療法が無効の癌幹細胞も有効に治療できるという、革新的性能を示しました(図2)。まず、治療遺伝子未搭載のSurv.m-CRA-1を日本で実用化するため、ICH準拠のGMP製剤製造、GLP試験、ならびに規制対応等も含めた非臨床研究を厚生労働科学研究等で着実に進めてきました。その成果を基にAMED事業(橋渡し研究加速ネットワークプログラム、革新的がん医療実用化研究事業、等)の支援を受けて、鹿児島大学(単施設)で治療抵抗性(標準治療無効例)の骨軟部腫瘍へFirst-in-Human医師主導治験第I相を実施し、9例で完了しました。その臨床成績も、最高用量群まで問題となるような副作用は認められず、高い安全性を示しただけでなく、9例中6例で奏効を認め、長期経過を追跡できた低用量群の2例の患者では、二年以上に奏効が維持できており、高い有効性も示唆されました。
今回、AMED革新がん研究事業で、悪性骨腫瘍への世界初のOVの承認を目指し、Surv.m-CRA-1の多施設共同(鹿児島大学、久留米大学、国立がん研究センター中央病院)の医師主導治験第Ⅱ相を開始しました。
多施設共同治験第Ⅱ相の対象疾患
- 治験課題名
- 進行性原発悪性骨腫瘍を対象としたサバイビン反応性増殖制御型アデノウイルス(Surv.m-CRA-1)の反復腫瘍内局所投与の第II相試験
- 対象疾患
- 標準的治療法の対象とならない進行性の原発性悪性骨腫瘍
- 治験デザイン
- 多施設・第Ⅱ相・非盲検(対象群のないオープンラベル)・医師主導治験
- 実施施設
-
- 鹿児島大学病院
- 久留米大学病院
- 国立がん研究センター中央病院
意義、期待される成果、今後の展望
本研究で悪性骨腫瘍へSurv.m-CRA-1の第Ⅱ相試験を実施・完遂し、良好な結果が得られれば、再生医療等製品(ならびにオーファン指定)としての早期承認を含めた、「日本発の革新的医薬で悪性骨腫瘍に対する世界初のOV医薬の実用化」の実現が期待できます。
悪性骨腫瘍はアンメット・メディカル・ニーズの難治性腫瘍という観点から、遺伝子治療やOVのみならず、その他の革新医薬も、開発が十分には進んでいません。これは悪性骨腫瘍が希少がんであるため、経済的観点から製薬企業の主対象疾患に成り難いという背景がある上に、さらに今回のOV技術のような最先端治療技術の研究開発となると、製薬企業では難しいということがありました。その点で本研究グループはAMEDを初めとする多くの公的研究費の支援を受け、研究グループ自身で基礎研究、非臨床開発、臨床開発と進め、First-in-Human医師主導第Ⅰ相治験で良好な結果を得られました。よって本剤Surv.m-CRA-1を、一刻も早く医師主導治験第Ⅱ相を進め、今後は企業連携で国内早期実用化に繋げることは、社会的にも重要だと思われます。
また一連のSurv.m-CRAは、全てのがん種を適応にできる治療作用メカニズムを持っていることから、研究代表者は、浸潤・転移が進んだ難治性がんに対しては、抗腫瘍免疫を安全かつ効果的に増強できる免疫遺伝子搭載した、第二、第三弾の次世代Surv.m-CRAも複数開発中です。このように本研究で得られる成果は、世界中で開発競争が進むOV分野で、日本発の優れたOV医薬品を持続的かつ効果的に開発・実用化するための基盤形成にも繋がるという、大きな波及効果が期待されます。
Surv.m-CRA-1の研究開発の主な公的研究費
- 国立研究開発法人日本医療研究開発機構(AMED)研究費 革新的がん医療実用化研究事業、令和3年度~令和5年度、「独自開発・革新性能の増殖制御型アデノウイルスの骨腫瘍(希少・難治性がん)承認への第Ⅱ相医師主導治験」(研究開発代表者 小戝健一郎)
- 国立研究開発法人日本医療研究開発機構(AMED) 研究費 革新的がん医療実用化研究事業、平成30年度~令和2年度、「独自開発の革新的な増殖制御型アデノウイルスの肉腫への承認申請を目指した医師主導治験」(研究開発代表者 小戝健一郎)
- 国立研究開発法人日本医療研究開発機構(AMED)研究費 革新的がん医療実用化研究事業、平成27年度~29年度、「肉腫への革新医薬実用化を目指した独自開発の増殖制御型アデノウイルスの医師主導治験」(研究開発代表者 小戝健一郎)
- 国立研究開発法人日本医療研究開発機構(AMED)研究費 橋渡し研究加速ネットワークプログラム(支援拠点:京都大学) 研究開発施設共用等促進費補助金 シーズC(但しH26年度は文科省事業)、平成26年度~平成27年度、「独自開発の増殖制御型ウイルス医薬の難治癌への医師主導治験」(研究代表者 小戝健一郎)
- 厚生労働科学研究費補助金 がん対策推進総合研究事業(革新的がん医療実用化研究事業、平成24年度~平成26年度、「難治癌を標的治療できる完全オリジナルのウイルス遺伝子医薬の実用化のための前臨床研究」(研究開発代表者 小戝健一郎)
- 厚生労働科学研究費補助金 第3次対がん総合戦略研究事業(革新的治療分野)、平成22年度~平成25年度、「独自m-CRAベクターによる癌幹細胞の同定・標的治療技術の開発と革新的な遺伝子治療の実現」(研究開発代表者 小戝健一郎)
用語説明
- *1 Surv.m-CRA
- サバイビン分子は、アポトーシス阻害因子ファミリーの一つであるが、正常細胞ではG2/M 期に微量発現している一方で、癌細胞ではほぼ全種で異常高発現している。よって最適領域のサバイビンプロモーターでアデノウイルス のE1Aを転写制御し、さらに変異E1Bにした腫瘍溶解性アデノウイルスが、Surv.m-CRAであり、治療遺伝子未搭載の第一弾医薬がSurv.m-CRA-1である。Surv.m-CRA-1は、癌細胞でのみ特異的にウイルスが増殖して細胞傷害を起こす一方、正常細胞ではウイルス増殖とそれによる細胞傷害がほとんど起こらない。治療メカニズムは、このようなウイルス増殖による直接の殺傷効果に加えて、さらに抗腫瘍免疫誘導も示唆されている。
- *2 プラットフォーム技術(m-CRA)
- OVとしてのアデノウイルスは、制限増殖型アデノウイルス(Conditionally replicating adenovirus; CRA)あるいは腫瘍溶解性アデノウイルス と呼ばれる。CRAの効率的・標準化作製技術は確立されておらず、高度複雑に改変されたCRAを効率的に作製する標準化技術はなかった。我々は、アデノウイルス のE1領域の4因子(野生型/変異E1A、野生型/変異E1Bを2つの異なる癌特異的プロモーターで発現)で同時制御も可能で、さらに治療遺伝子を搭載し、ADVゲノム改変も簡単にできる、次世代CRAとして“多因子増殖制御型アデノウイルス”(m-CRA)の効率的作製法を独自開発した。
- *3 ICH(International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use)
- 医薬品規制調和国際会議は医薬品規制当局と製薬業界の代表者が協働して、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議。
- *4 First-in-Human
- 被験薬を動物ではなくヒトに対して世界で初めて投与すること。
- *5 First-in-Class医薬品
- 画期的医薬品、特に新規性・有用性が高く、化学構造も従来の医薬品と基本骨格から異なり、従来の治療体系を大幅に変えるような独創的医薬品をいう。
研究グループ(代表・共同研究者)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 遺伝子治療・再生医学分野 教授、同研究科・附属 南九州先端医療開発センター センター長 /大学病院 探索的医療開発センター センター長 小戝 健一郎(研究開発代表者・統括責任者)
- 国立大学法人鹿児島大学 医学部保健学科 理学療法学専攻 臨床理学療法学 教授/大学病院 革新的治療開発センター 副センター長 永野 聡(治験調整医師・鹿児島大学治験責任医師)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 整形外科学分野 教授/大学病院 整形・運動機能センター 教授/センター長 谷口 昇(整形外科学統括責任者・治験分担医師)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 名誉教授/医療法人くすのき会 新門整形外科 顧問 小宮 節郎 (前・治験責任医師)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 薬物動態制御学分野 教授/大学病院 薬剤部 部長/臨床研究センター 治験管理部門 部門長 武田 泰生(治験調整事務局統括責任者)
- 国立大学法人鹿児島大学 大学病院 薬剤部 薬剤主任 二川 俊隆(治験調整事務局実務責任者)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 血管代謝病態解析学分野 教授/大学病院 検査部 部長 橋口 照人 (検査統括責任者)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 血管代謝病態解析学分野 准教授/大学病院 検査部 副部長 山口 宗一(検査実務責任者)
- 国立大学法人鹿児島大学 大学院医歯学総合研究科 放射線診断治療学分野 教授/大学病院放射線部 部長 吉浦 敬 (画像評価統括責任者)
- 国立大学法人鹿児島大学 大学病院 放射線診療センター 放射線科 助教 中條 正典(画像評価実務責任者)
- 国立研究開発法人国立がん研究センター中央病院 骨軟部腫瘍・リハビリテーション科 科長/希少がんセンター センター長 川井 章(国立がん研究センター中央病院・治験責任医師)
- 国立研究開発法人国立がん研究センター中央病院 骨軟部腫瘍・リハビリテーション科 医長 岩田 慎太郎(国立がん研究センター中央病院・治験分担医師)
- 学校法人久留米大学 医学部医学科 整形外科学講座 准教授 平岡 弘二(久留米大学・治験責任医師)
- 国立大学法人東京医科歯科大学 医学部附属病院 臨床試験管理センター/大学院医歯学総合研究科 臨床統計学分野 教授 平川 晃弘(統計解析責任者)
- 国立大学法人京都大学医学部附属病院・先端医療研究開発機構(前)教授 清水 章(治験体制整備や規制での支援)
- 国立大学法人京都大学医学部附属病院・先端医療研究開発機構(前)特任准教授 角 栄里子(治験体制整備や規制での支援)
- 国立大学法人京都大学医学部附属病院・先端医療研究開発機構 医療開発部 開発・薬事ユニット ユニット長/講師 伊藤 達也(治験体制整備や規制での支援)
- 国立大学法人京都大学産官学連携本部 顧問/国立大学法人鹿児島大学 大学院医歯学総合研究科 客員教授 髙谷 宗男 (技術移転等での支援)
お問い合せ先
研究に関するお問い合わせ
小戝 健一郎(こさい けんいちろう)
国立大学法人鹿児島大学
(1)大学院医歯学総合研究科 遺伝子治療・再生医学分野 教授
(2) 同研究科・附属 南九州先端医療開発センター センター長
(3)大学病院 探索的医療開発センター センター長
報道・取材に関するお問い合わせ
国立大学法人鹿児島大学 鹿児島大学病院 総務課 企画・広報係
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 遺伝子治療研究開発課