2021-02-09 金沢大学,日本医療研究開発機構
金沢大学ナノ生命科学研究所/がん進展制御研究所の大島浩子准教授、大島正伸教授の研究グループは、東京大学の宮園浩平教授、上田泰己教授との共同研究により、遺伝的な多様性を持ったがん細胞集団による転移メカニズムの解明に成功しました。
がん転移機構の新しい概念として、多様性のあるがん細胞集団が細胞塊(クラスター)を形成して体内を移動し、遠隔臓器に転移巣を形成する「ポリクローナル転移(※1)」が提唱されています。しかし、実際に生体内において多様な細胞集団がどのように転移巣を形成するのかは不明でした。研究グループは、異なるドライバー遺伝子(※2)に変異を持つマウス腸管がん由来のオルガノイド(※3)を用いた移植実験を行い、転移性の高い悪性腸管がん細胞が間質の細胞を活性化させて転移ニッチ(※4)を形成し、これに依存して非転移性がん細胞が混在したポリクローナル転移巣を形成することを明らかにしました。
これらの知見は、従来考えられていた遺伝子変異に依存した転移機構とは異なる、新たながん転移モデルの概念の樹立につながり、新しい大腸がん転移の予防・治療薬の開発に活用されることが期待されます。
本研究成果は2021年2月8日午後7時(日本時間)に英国科学誌『Nature Communications』のオンライン版に掲載される予定です。
研究の背景
がん細胞は、遺伝子変異の繰り返しにより、次第に悪性化し、進展します。しかし、がん転移機構は遺伝子変異では説明されず、いまだ不明でした。一方で、がん患者の血中にはがん細胞塊(クラスター)が見つかっており、クラスターのまま遠隔臓器に到達して転移巣を形成する「ポリクローナル転移」機構が提唱されています。しかし、遺伝子変異や悪性度が異なるがん細胞の集団が、どのように転移巣を形成するのかは依然として不明でした。
研究成果の概要
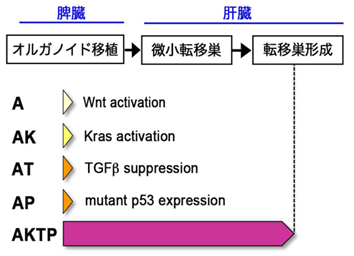
研究グループでは、大腸がん発生と悪性化に重要な4種類のドライバー遺伝子(Apc(A)、Kras(K)、Tgfbr2(T)、Trp53(P))の変異を、さまざまな組み合わせで導入した、腸管腫瘍由来オルガノイドを樹立しました(Sakai et al, Cancer Res, 2018)。これら4種類の変異を持つAKTP細胞は高い転移能を獲得し、1~2種類の変異を持つA、AK、AT、AP細胞は非転移性のがん細胞です(図1)。それぞれを緑色および赤色蛍光で標識して、単独でマウス脾臓に移植すると、AKTP細胞だけが肝臓に転移巣を形成します(図2a)。興味深いことに、非転移性細胞とAKTP細胞を同時に脾臓へ移植すると、ATまたはAP細胞とAKTP細胞の双方から構成されるポリクローナル転移巣が肝臓に形成されました(図2b)。この結果は、非転移性がん細胞でも、転移性がん細胞と一緒にポリクローナル機構により転移し得ることを示します。
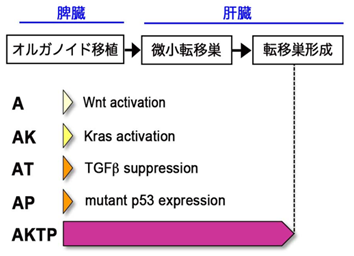
図1.腸管腫瘍由来オルガノイド(A、AK、AT、AP、AKTP)の説明。各遺伝子変異により誘導される変化(Wnt活性化、Kras活性化等)図中に示す。AKTP細胞だけが肝転移能を獲得している。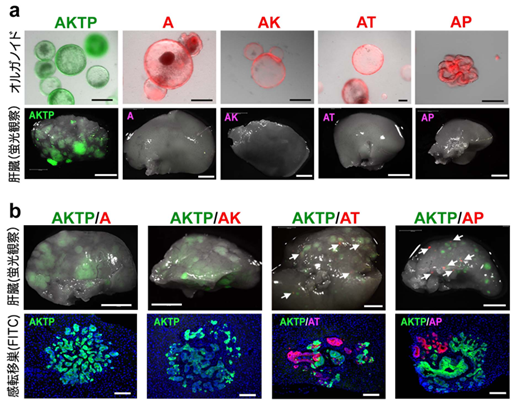
図2.オルガノイド移植実験。a.蛍光標識した各遺伝子型オルガノイド写真(上段)、脾臓移植後の肝臓の蛍光実体顕微鏡写真(下段)。AKTP細胞のみが転移する。b.AKTP細胞と非転移性細胞を同時に移植したマウスの肝臓(上段)と蛍光組織染色(下段)。ATとAP細胞はAKTP細胞といっしょに転移巣を形成する。
さらに、AKTP細胞単独による肝転移巣では、がん細胞が血管周囲の肝星細胞を活性化させて線維性の転移ニッチを形成することが分かりました(図3)。重要なことに、AKTP細胞が転移ニッチを形成した後でAP細胞を移植すると、非転移性のAP細胞単独でも微小転移巣を形成しました。この結果は、転移性がん細胞による転移ニッチ形成が、非転移性がん細胞の生存と増殖に関与する可能性を示しています。
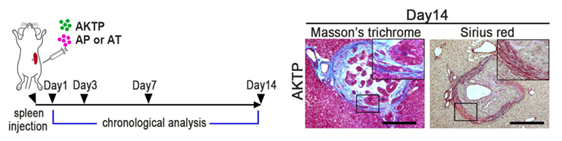
図3.マウスへの細胞移植スケジュール(左)と、AKTP細胞を移植した時に肝臓に形成される転移ニッチ(右:コラーゲン線維染色)。
今回の研究により、がん細胞クラスター内の転移性サブクローンが転移ニッチを形成することで、非転移性がん細胞を含んだポリクローナル転移巣を形成することがはじめて明らかになり、がん転移機構の理解に重要な知見が得られました(図4)。
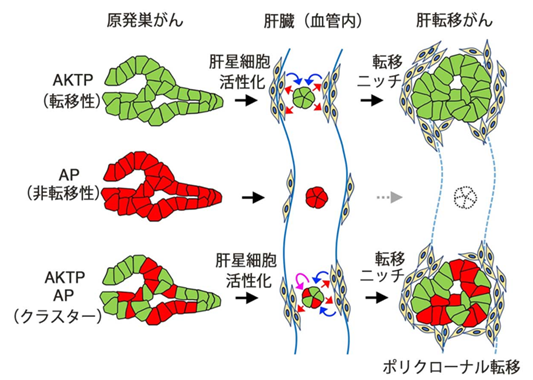
図4.本研究成果の模式図。転移性がん細胞は肝星細胞を活性化して(赤矢印)、転移ニッチを形成し、ニッチの作用により(青矢印)転移巣を形成する。非転移性がん細胞は、転移ニッチの存在や、転移性がん細胞の作用により(ピンク矢印)、生存、増殖してポリクローナル転移巣を形成する。
今後の展開
本研究成果により、悪性がん細胞による転移ニッチ形成を阻害することで、がん細胞クラスターによる転移巣形成を抑制できる可能性が示されました。将来的に、大腸がんの肝転移に対する新規予防・治療薬の開発戦略に大きく貢献することが期待されます。
本研究への支援
本研究は、日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「大腸がん細胞の多段階悪性化が制御する微小環境形成ネットワーク機構の解明と新規予防治療戦略の確立」、および「大腸がん微小転移巣形成機構の理解による新規予防治療戦略の確立」(研究開発代表者大島正伸)、日本学術振興会科学研究費助成事業、および文部科学省世界トップレベル研究拠点プログラム(WPI)の支援を受けて実施されました。
掲載論文
- 雑誌名
- Nature Communications
- 論文名
- Malignant subclone drives metastasis of genetically and phenotypically heterogenous cell clusters through fibrotic niche generation
- (悪性形質を獲得したサブクローンが線維性ニッチを形成して遺伝型および表現型の多様なクラスターの転移を引き起こす)
- 著者名
- Sau Yee Kok, Hiroko Oshima, Kei Takahashi, Mizuho Nakayama, Kazuhiro Murakami, Hiroki, R. Ueda, Kohei Miyazono, Masanobu Oshima
- (コク・サウイ、大島浩子、高橋恵生、中山瑞穂、村上和弘、上田泰己、宮園浩平、大島正伸)
- 掲載日時
- 2021年2月8日午後7時(日本時間)オンライン版に掲載
- DOI
- 10.1038/s41467-021-21160-0
用語解説
- (※1)ポリクローナル転移
- 原発巣で転移能を獲得したがん細胞が単独で転移巣をモノクローナルに形成するという従来の考え方に対して、複数の遺伝的に異なるがん細胞集団がクラスターとして遠隔臓器に血流を介して到達し、多様性を維持したままポリクローナルな転移巣を形成するという仮説。
- (※2)ドライバー遺伝子
- がん細胞で認められる多数の遺伝子変異の中で、その遺伝子の変異が発がんや悪性化、進展に関与する場合、その遺伝子をドライバー遺伝子と呼ぶ。
- (※3)オルガノイド
- 正常組織あるいは腫瘍組織由来の上皮細胞を、生体内と同様の腺管等の組織構造を維持したままマトリックス中で3次元培養した組織。生体内の状況に近いと考えられ、これまでの平面状の培養細胞に代わる生体外培養モデルとして広く研究に使われる。
- (※4)転移ニッチ
- がん転移組織で、がん細胞周囲の宿主由来の細胞で形成される微小環境。線維芽細胞、血管内皮細胞、免疫細胞などで構成され、がん細胞の生存や増殖促進に重要な役割を果たす。
本件に関するお問い合わせ先
研究内容に関すること
金沢大学ナノ生命科学研究所/がん進展制御研究所 教授
大島正伸(おおしままさのぶ)
金沢大学ナノ生命科学研究所事務室
米田洋恵(よねだひろえ)
AMED事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
革新的がん医療実用化研究事業事務局