最多の発がん遺伝子を標的とした治療応用に期待
2022-03-03 国立がん研究センター
発表のポイント
- 多くのがんの発がんに関連している代表的ながん遺伝子でありながら、いまだ有効な治療薬が一部の変異のみに限られているRAS遺伝子変異について、発がんに関わる新たなメカニズムとその弱点を発見しました。
- また、このメカニズムに作用しがん細胞のみを攻撃する核酸医薬を新たにデザインし、治療応用が期待されることを実験で確認しました。
- さらに研究を進めることでRAS遺伝子変異に対する新たな治療法の実用化と、他の遺伝子変異への応用が期待されます。
概要
米国Dana-Farber Cancer Institute(Dr. Pasi A. Jänne)と国立がん研究センター研究所分子病理分野(研究員 小林 祥久)を中心とした国際共同研究チームは、膵臓がん、大腸がん、皮膚がんや肺がんなどさまざまながんで発がんを促進するがん遺伝子であるRAS(KRAS、NRAS、HRAS)遺伝子の変異について、発がんに関わる新たなメカニズムとその弱点を発見し、核酸医薬を用いた新規治療への応用が期待されることを実験で示しました。研究成果は、英国時間2022年3月2日付(日本時間3月3日)に国際学術誌「Nature」に掲載されました。
がんの薬物療法においては、発がんに関わる遺伝子変異により生じる特定の異常タンパク質を標的とする分子標的治療薬が多数開発され、実際のがん治療に使用されています。RAS遺伝子変異は、代表的な発がん遺伝子であり長年にわたり薬剤開発が試みられていますが、いまだ有効な治療薬が一部の変異のみに限られていて、多くの変異に対する有効な薬剤開発には至っていません。
本研究は、がんをはじめとする生物学全般においてこれまであまり研究対象として注目されてこなかったサイレント変異(タンパク質を構成するアミノ酸の変化を伴わない遺伝子変異)が、KRAS Q61K変異の発がんに必須であることを発見しました。この発見を契機に、KRAS, NRAS, HRASのコドンQ61周辺は、スプライシングに対して脆弱な領域であることが判明しました。これらの発見をもとに、生物に元来備わっているスプライシング機構を核酸医薬で誘導することで、発がん変異を持つがん細胞だけを攻撃する新しい治療法の可能性を細胞実験とマウスの実験から示しました(弱点の発見と核酸医薬によるがん治療について米国特許出願済み)。
今後さらに研究を進めることで、本研究で示されたRAS Q61変異(Q61変異はKRASで3番目に多く、NRASとHRASでは最多の遺伝子変異)のある肺がん、膵がん、皮膚がんなどに対する核酸医薬での新たな治療法の実用化と、スプライシングに対する脆弱性という生物学的に重要な本発見のRAS以外の遺伝子への応用が期待されます。
背景
これまであまり注目されてこなかったサイレント変異について
生物の遺伝情報は、DNAからmRNAに転写され、mRNAの3つずつの塩基配列(コドン)がアミノ酸配列へと翻訳されます。さらに、アミノ酸が連なってタンパク質を構成します。
DNAの変異には、アミノ酸配列を変える変異と変わらない変異の2種類があり、一般的にはアミノ酸が変わることでがんやさまざまな機能の変化が生じるため、このアミノ酸配列を変える変異ががんをはじめとする生物学全般での研究対象となってきました。一方、アミノ酸配列が変わらない変異の意義は明確になっておらず、あまり注目されていませんでした。
1.アミノ酸配列を変える変異(non-synonymous変異)
例:CAAで翻訳されるグルタミンQ→AAAで翻訳されるリジンK
2.アミノ酸配列が変わらない変異(サイレント変異またはsynonymous変異)
例:GGT で翻訳されるグリシンG→GGAで翻訳されるグリシンG
RAS遺伝子の変異によって起こるがん
RAS(ラス)遺伝子と呼ばれる一群のがん遺伝子には、KRAS(ケーラス)、NRAS(エヌラス)、HRAS(エイチラス)の3種類があり、約3割のがん患者さんで変異が検出される発生頻度の高いがん遺伝子です。
RAS遺伝子の変異自体は数十年前から見つかっていましたが、薬剤が結合するポケットがないことなどにより、直接治療標的とすることは困難でした。2021年に初めて米国で、日本では2022年に一部のKRAS遺伝子変異(KRAS G12C変異:コドン12番目のグリシン[G]がシステイン[C]に変わる)のあるがんの増殖を特異的に阻害する画期的な薬が承認されました。しかし、KRAS G12C変異のほかに同じ機序を応用できるのは現状では、KRAS G12D変異のみで、他のKRAS変異や、NRAS、HRAS変異に対する有効な薬剤は開発できていません。
研究成果
ポイント1. KRAS遺伝子のQ61K変異によってがんを引き起こすには、すぐ隣のG60Gサイレント変異が必須であることが判明しました
発がん遺伝子変異または薬剤耐性を起こす変異としてこれまでに報告されてきたKRAS G12C、G12D、Q61K、A146T変異を、CRISPRゲノム編集技術によって肺がん細胞株が持っているKRAS遺伝子に生じさせました。すると、KRAS G12C, G12D, A146T変異は期待通り薬剤耐性を起こしましたが、予想外にもKRAS Q61Kだけが全く薬剤耐性を起こしませんでした。詳細な解析から、Q61Kのすぐ隣の G60にサイレント変異を伴った場合のみ、薬剤耐性を引き起こすことが判明しました。
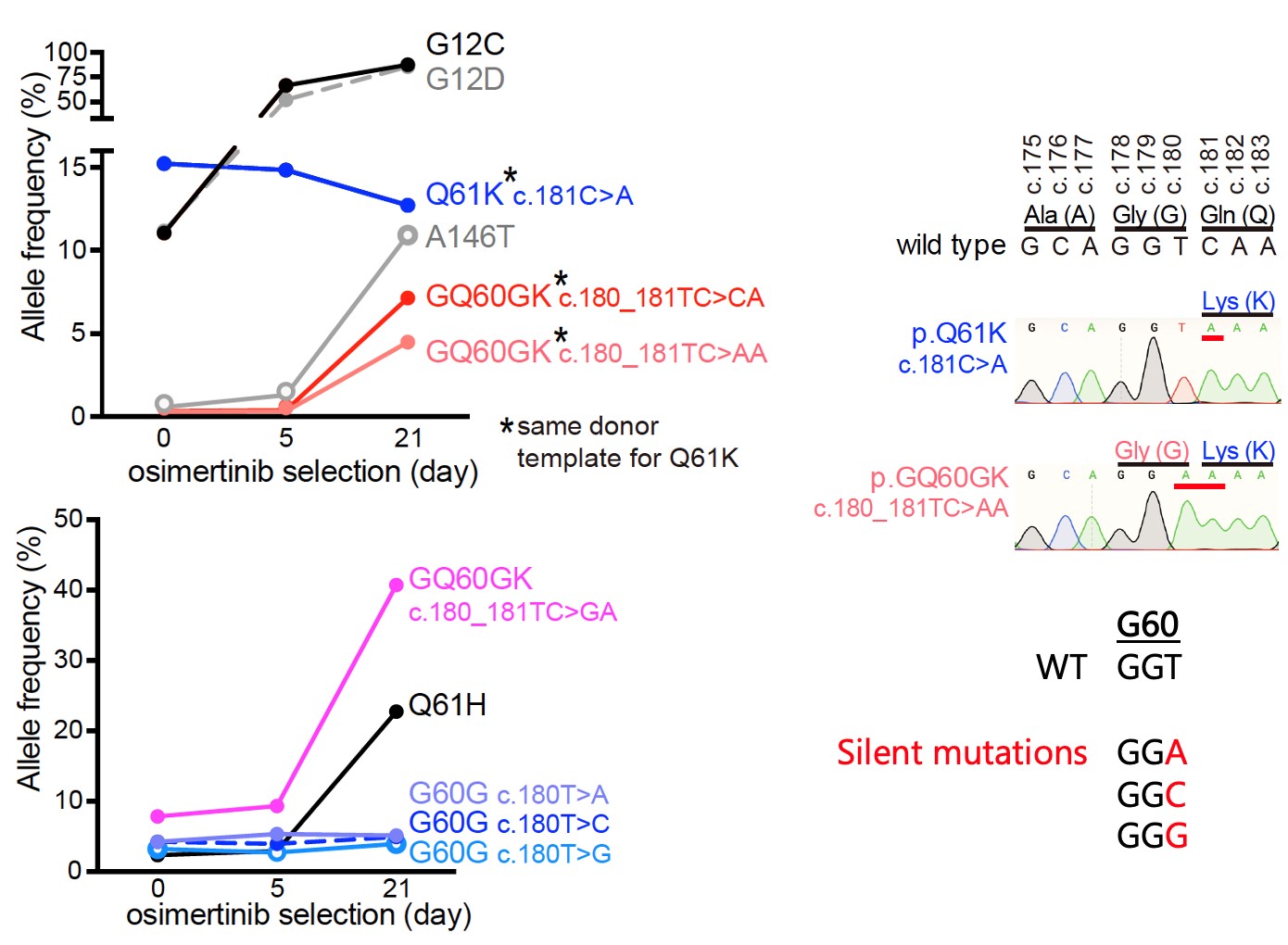
図1 KRAS Q61K変異に必須のG60Gサイレント変異
EGFR変異のある肺がん細胞株に各種KRAS変異を入れたモデルで、EGFR阻害剤osimertinibによる治療に対して薬剤耐性を示す変異のアレル頻度。
ポイント2. RASファミリー遺伝子のQ61周辺はスプライシングに対して脆弱であることが明らかとなりました
DNAはエクソンとイントロンが交互に繰り返される配列をしています。DNAからmRNAに転写されてアミノ酸配列へと翻訳される過程の途中で、DNAからまずpre-mRNAができて、pre-mRNAのイントロンを除去してエクソンだけをつなぎ合わせるスプライシングが起こることでmature mRNAができて、その後アミノ酸に翻訳されます。
KRAS遺伝子の転写産物には、正常なスプライシングが起こった4Aアイソフォームと、エクソン5がスキップしてしまった(選択的スプライシング)4Bアイソフォームの2種類があります。正常細胞やKRAS G12C, G12D, A146T変異を入れた細胞では従来の4A、4Bアイソフォームが確認されましたが、予想外にも薬剤耐性を起こさなかったKRAS Q61K変異のみ(G60Gサイレント変異なし)の細胞では、1.エクソン3のうち112塩基がスキッピングしたアイソフォーム、2.エクソン3全体がスキッピングしたアイソフォームの2種類の転写産物が確認され、これらの異常なスプライシングが起こっていたことがわかりました。
また詳細な検討によって、G60Gサイレント変異は1.の異常なスプライシングからがん細胞が自己を守る働きをしていることが判明しました。さらに、2.の原因として、KRAS Q61周辺にはスプライシングに対して脆弱な領域、つまり遺伝子変異が生じることによって異常なスプライシングが引き起こされやすい領域であることがわかり、これはKRASに限らずNRASとHRASでも同様であることを発見しました。
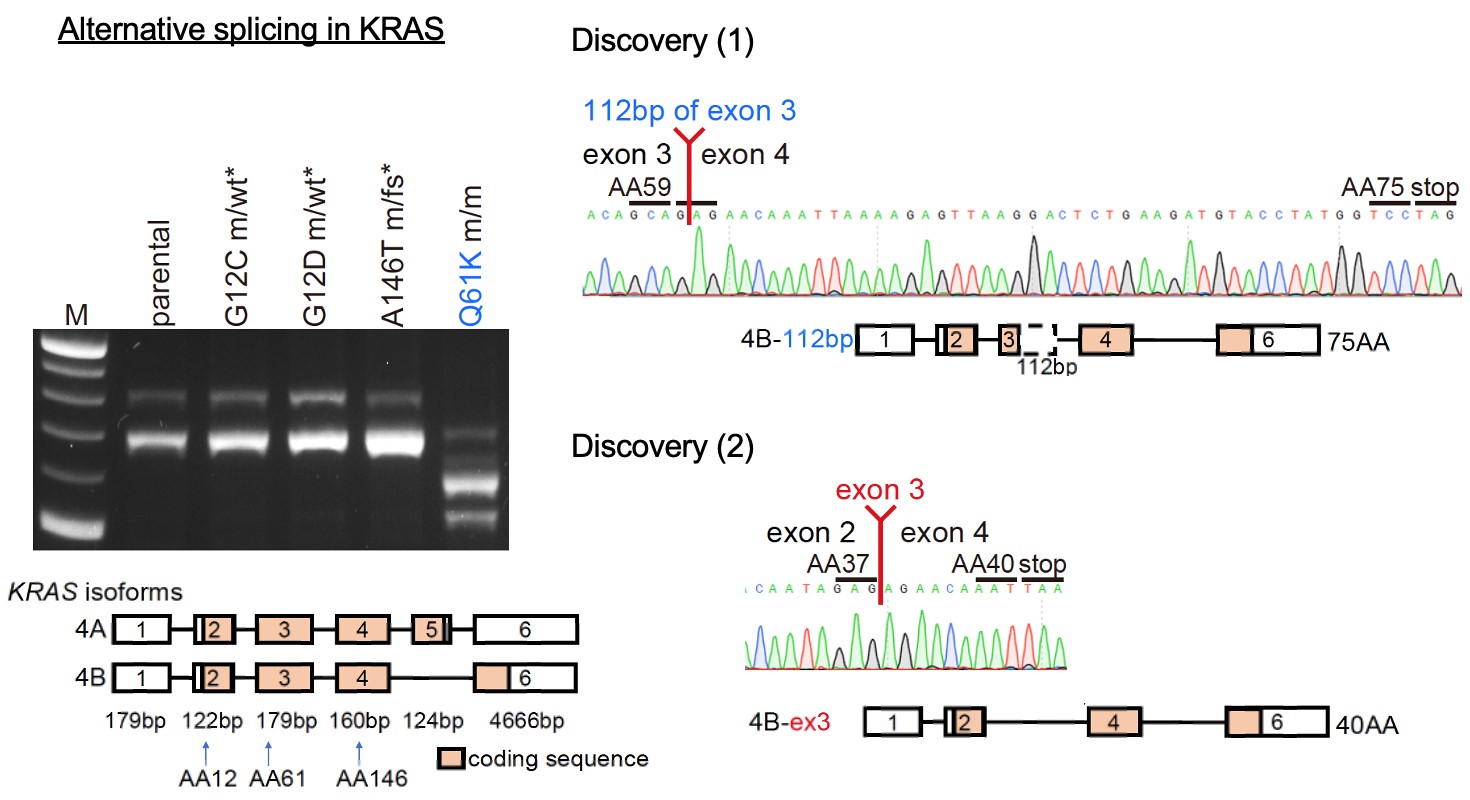
図2 KRAS遺伝子の転写産物
サイレント変異を伴わないKRAS Q61K単独では、他の変異では見られない選択的スプライシングとその後の早期終止コドンが検出されました。
ポイント3. 異常なスプライシングを誘導して、がん細胞だけを攻撃する新規治療の効果を細胞実験とマウス実験で示しました
RAS遺伝子のスプライシングに対する脆弱性を治療に応用するために、人為的に異常なスプライシングを誘導することでがん細胞の発がん蛋白を作れないようにして、がん細胞が増えないようにする治療戦略を考案しました。遺伝子変異のあるpre-mRNA配列だけに結合する核酸医薬をデザインして、がん細胞だけで異常なスプライシングを誘導することに成功しました。さらに、その治療効果を細胞実験とマウスの実験で示しました。
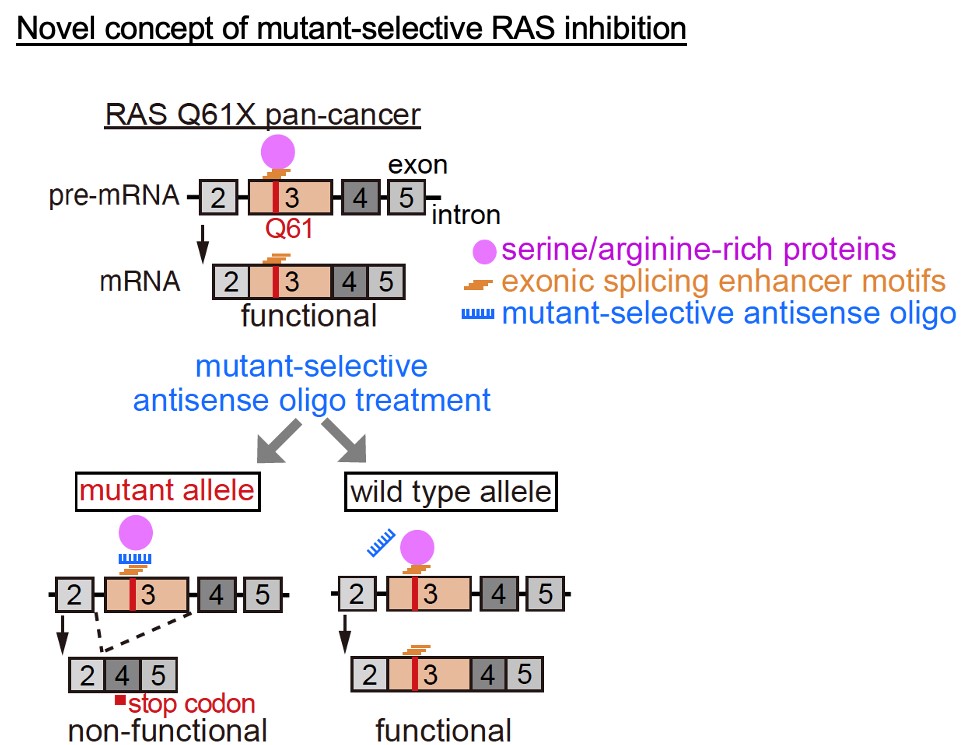
図3 新規治療の概念図
RAS Q61変異のあるがんに対して、変異特異的に結合するようデザインした核酸医薬は選択的スプライシングを誘導して早期終止コドンの出現と不完全な蛋白合成によって増殖を阻害しますが、正常細胞には結合せず影響しないため軽い副作用が期待されます。
展望
核酸医薬によって変異のあるがん細胞だけを攻撃する新たながん治療の実用化が、今後のさらなる研究によって期待されます。スプライシングに対する脆弱性という生物学的な発見は、RAS以外の遺伝子にも応用できる可能性があります。
発表論文
雑誌名
Nature
タイトル
Silent mutations reveal therapeutic vulnerability in RAS Q61 cancers
著者
Yoshihisa Kobayashi*, Chhayheng Chhoeu, Jiaqi Li, Kristin S. Price, Lesli A. Kiedrowski, Jamie L. Hutchins, Aaron I. Hardin, Zihan Wei, Fangxin Hong, Magda Bahcall, Prafulla C. Gokhale, Pasi A. Jänne* *Co-Correspondence
DOI
10.1038/s41586-022-04451-4
URL
https://www.nature.com/articles/s41586-022-04451-4
掲載日
2022年3月2日 (日本時間3月3日)
研究費
- 日本学術振興会 海外特別研究員(代表 小林祥久)
- 上原記念生命科学財団 研究奨励金(代表 小林祥久)
- SGH財団 第33回SGHがん研究助成(代表 小林祥久)
- 鈴木謙三記念医科学応用研究財団 令和3年度調査研究助成(代表 小林祥久)
問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所 分子病理分野
研究員 小林 祥久
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室