2022-03-10 国立長寿医療研究センター
概要
メディカルゲノムセンターの研究グループ※は、孤発性アルツハイマー病(Late-onset Alzheimer’s disease: LOAD)患者の全ゲノムシークエンス解析(※1)を行い、日本人など東アジア人に特異的に見られるOR51G1遺伝子のミスセンス変異(※2)、MLKL遺伝子のストップゲイン変異(※3)がLOAD発症のリスクを高めることを見出しました。またLOAD関連遺伝子群の遺伝間相互作用ネットワーク解析から、4個の主要なハブ遺伝子(NCOR2、DMD、NEDD4、PLEC)を同定されました。これらの知見は、アミロイド仮説だけでは説明がつかないLOADの複雑な発症メカニズムの解明と新たな治療法の開発に寄与するものと期待されます。
この研究成果は、精神医学・神経科学分野の国際科学誌「Molecular Psychiatry」オンライン版に2022年3月10日付で掲載されました。
※研究グループ
国立長寿医療研究センター研究所 メディカルゲノムセンター
研究所長/メディカルゲノムセンター長
新飯田俊平(にいだ しゅんぺい)
バイオインフォマティクス研究部
部長
重水大智(しげみず だいち)
研究員
浅海裕也(あさのみ ゆうや)
研究員
秋山真太郎(あきやま しんたろう)
疾患ゲノム研究部
部長
尾崎浩一(おざき こういち)
研究員
光森理紗(みつもり りさ)
研究の背景
LOADは高齢者で最も多くみられる認知症であり、環境因子や遺伝因子が複雑に関わり発症します。遺伝因子のLOAD発症寄与率は60〜80%程度と推定されており、病因と病態進行に関わる遺伝因子が多数存在すると考えられています。最も高い遺伝リスク因子としてAPOE ε4が知られていますが、その効果は遺伝因子寄与率の2~3割程度です。近年、欧米の大規模コホート研究に基づくゲノムワイド関連解析(Genome-Wide Association Study; GWAS)(※4)から40箇所程のLOAD関連遺伝子座位が報告されていますが、それらを合わせても遺伝因子の半分程度しか説明することができません。一方で、GWASは比較的頻度の高い遺伝子多型(コモンバリアント)を対象とした解析であるため、低頻度な(保有者が極めて少ない)レアバリアント(集団の1%未満)は調べられていません。また、人種・民族・地域差により、遺伝的背景が異なることから、欧米人で発見された遺伝子変異が日本人に必ずしも当てはまるわけではありません。これらのことから、日本人のゲノムデータを用いた低頻度な遺伝子変異解析が、私たちが直面している認知症における新たな遺伝因子の発見につながると考えられます。
研究成果の内容
研究グループは、国立長寿医療研究センターバイオバンクに登録されている日本人LOAD患者140名と認知機能正常高齢者798名の全ゲノムシークエンス(WGS)データの解析、および1,604名のLOAD群と1,235名の対象群からなる検証コホートの解析から、嗅覚受容体遺伝子OR51G1のミスセンス変異(※2)(rs146006146, c.815G>A, p.R272H)がLOADの遺伝リスク因子であることを見出しました(オッズ比 = 2.2)。同研究グループは以前にも日本人LOAD患者の大規模GWASを行い、嗅覚受容体遺伝子OR2B2を同定しており、嗅覚受容体遺伝子とLOADの関連が今回再び示されました。
次に、遺伝子ベースの関連解析から、ネクロトーシス(※5)に関わるMLKLがLOADリスク遺伝子候補として見出されました。この遺伝子上から6箇所のレアバリアントが確認され、その1つのストップゲイン変異(※3)(rs763812068, c.142C>T, p.Q48X)が検証コホートの解析からLOADの遺伝リスク因子であることが見出されました。ヒト培養細胞を用いた機能解析を行ったところ、このMLKL変異は遺伝子発現の消失に関与し(図1a)、ネクロトーシスを阻害していることが示されました(図1b)。さらにMLKLはLOADのバイオマーカーのひとつであるアミロイドβ蛋白(Aβ)に関連する分子Aβ42/Aβ40比を減少させる効果があることも実証しました(図1c)。これらの結果からMLKLのストップゲイン変異は、MLKLの発現を消失させ、それによって本来なら死ぬべき異常細胞が蓄積され、LOADの発症を誘発した可能性が示唆されました。
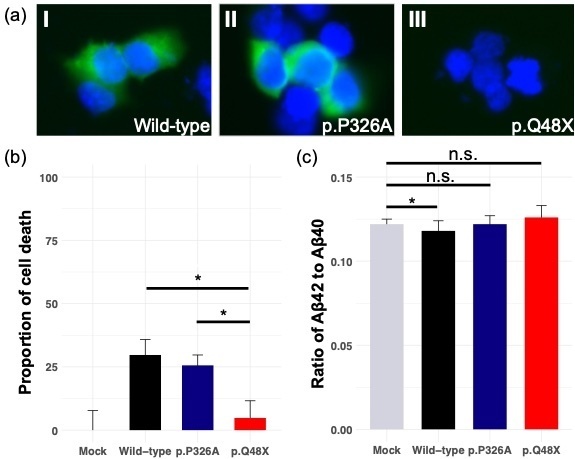
図1.MLKL遺伝子変異の培養細胞を用いた機能解析
最後に、遺伝子ベースの関連解析から検出された67個の遺伝子セットを用いた遺伝子間相互作用ネットワーク解析から8個のハブ遺伝子を同定しました(図2)。そのうちの4個(NCOR2、DMD、NEDD4、PLEC)が脳での発現が認められ、LOAD発症関連候補遺伝子として示唆されました。
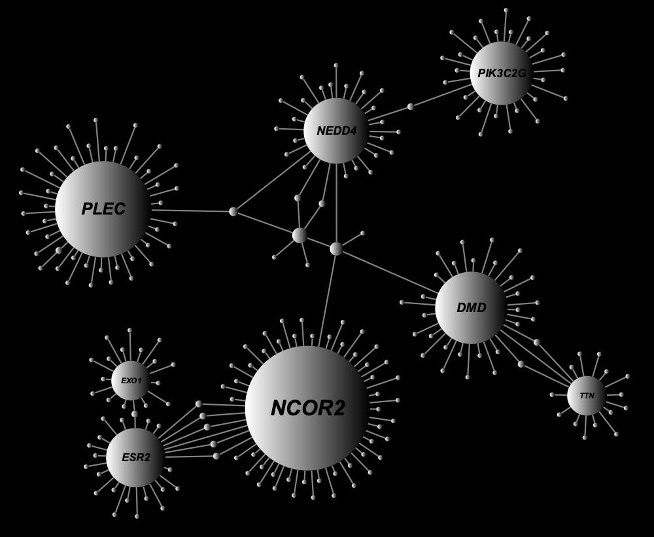
図2 遺伝子間相互作用ネットワークから同定されたハブ遺伝子
研究成果の意義
今回、欧米の大規模コホートに基づく先行研究で得られたLOADのリスク遺伝子群にはない、日本人を含む東アジア人特異的な複数のLOADリスク遺伝子が同定されました。同研究グループは一昨年も日本人特異的なLOADリスク遺伝子SHARPINを同定しており、特定の人種・民族におけるゲノム解析が重要であることを示しています。また成果は、日本人LOADのクリニカルシークエンスや個別化医療等、将来期待されるゲノム医療につながる知見であり、本研究の意義は大きいと考えられます。
これまでにも、日本人LOADのゲノム解析が行われてきましたが、解析数が少ないため成果が得られていませんでした。今後、解析データ数を増やしていくことで、日本人LOADの新たなレアバリアントの同定が期待されます。
なお、この研究成果の一部は、国立研究開発法人日本医療研究開発機構(AMED)、日本学術振興会科学研究費助成事業(KAKENHI)などの支援で実施されました。
論文情報
掲載誌:
Molecular Psychiatry
著者:
Daichi Shigemizu, Yuya Asanomi, Shintaro Akiyama, Risa Mitsumori, Shumpei Niida, Kouichi Ozaki
論文タイトル:
Whole-genome sequencing reveals novel ethnicity-specific rare variants associated with Alzheimer’s disease
DOI: 10.1038/s41380-022-01483-0.
論文URL(Molecular Psychiatryのサイトへ移動します)
用語解説
※1 全ゲノムシークエンス解析
次世代型DNAシークエンサーを用い、約30億塩基あるヒトゲノム配列の全領域を網羅的かつ高速に解読する手法。ジェノタイピングアレイによるゲノム解析に比べて解析コストが高いものの、数万人に一人しか保有していないような低頻度な遺伝子変異であっても検出することが可能である。
※2 ミスセンス変異
一塩基置換遺伝子多型(一塩基置換変異)のうち、その遺伝子がコードするタンパク質において異なるアミノ酸残基への置換を伴う変異。
※3 ストップゲイン変異
一塩基置換遺伝子多型(一塩基置換変異)のうち、その遺伝子がコードするタンパク質への翻訳を止めてしまう変異。
※4 ゲノムワイド関連解析(Genome-Wide Association Study; GWAS)
ある疾患の患者とその疾患にかかっていない被験者の間に遺伝子多型の頻度に差があるかどうかを統計的に検定することで、ヒトゲノム配列の全領域を対象に疾患感受型遺伝子などを探索する解析手法。2002年に日本の理化学研究所から初めて報告された。
※5 ネクロトーシス
MLKL(Mixed lineage kinase domain-like)およびRIPK3(Receptor-interacting kinase 3)の活性化により起きるプログラムされた細胞死。アポトーシスとは異なり、ネクローシス(壊死)と同様に細胞膜が破裂し、細胞内容物が漏出する。AD患者の脳内ではネクロトーシスが活性化しており、発症との関わりが注目されている。
問い合わせ先
報道に関すること
国立長寿医療研究センター 総務部総務課 広報担当 里村亮
研究に関すること
国立長寿医療研究センター 研究所 メディカルゲノムセンター バイオインフォマティクス研究部 重水大智(しげみず だいち)