2018-07-13 京都大学iPS細胞研究所(CiRA),千葉大学再生治療学研究センター,日本医療研究開発機構
ポイント
- 従来法の静置培養(培養皿)では、大量の血小板注1)を作製することが困難であり、また、作製される血小板のほとんどが凝集の始まった活性化済みの血小板であり、輸血に必要な非活性型の血小板を得ることが難しかった。
- マウスの生体内観察により、血液の乱流(動きが不規則に絶えず変動している乱れた状態の流体)が巨核球注2)から血小板の生成を促進させることが分かった。
- 乱流を発生させる縦型培養装置を開発し、さらに乱流エネルギー注3)やせん断応力注4)などの物理パラメータ(変数)を適合させることによって、実際の輸血に必要な量の高品質の血小板作製をすることを可能とした。
- 可溶性因子であるIGFBP2、MIF、NRDCを検出し、血小板生成メカニズムの一端を解明した。
要旨
ヒトiPS細胞を使った生体外における血小板作製技術は、ドナーに依存する献血にとって代わる生産システムとして期待されています。しかし、iPS細胞由来の巨核球から作られる血小板の数は、これまでの生産方法では輸血に必要な量(1千億個以上)には届きませんでした。
今回、伊東幸敬研究生(京都大学CiRA、株式会社メガカリオン主任研究員)、中村壮特命助教(京都大学CiRA)および江藤浩之教授(京都大学CiRA、千葉大学再生治療学研究センター長)らは、自治医科大学、慶應義塾大学、名古屋大学、滋賀医科大学、宮崎大学、佐竹化学機械工業株式会社、メガカリオンとの共同研究を通じて、骨髄や血管内において発生する物理的な乱流が血小板生成の鍵であることを突き止め、必要な乱流条件を設定可能な縦型培養装置を開発しました。
この装置を用い、同定した物理パラメータを調整することによって、8Lスケール装置から大量に高品質の血小板(1千億個以上)を作製することに成功しました。さらに、乱流に伴い巨核球からIGFBP2、MIF、NRDCという可溶性因子が放出され、血小板生成を促進していることが分かりました。作製されたヒトiPS細胞由来の血小板を2種類の動物モデルに輸血すると、血小板は体内を循環し、止血などが正常に行われていることが確かめられました。
この研究成果は2018年7月12日午前11時(米国時間:日本時間7月13日午前0時)に米国科学誌「Cell」でオンライン公開されます。
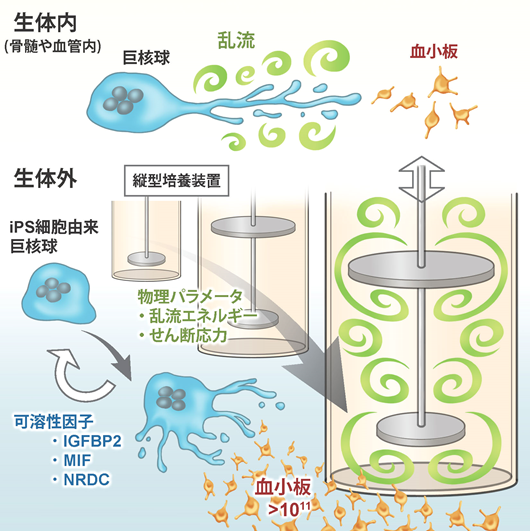
論文の概要図
骨髄や血管内の生体内において、乱流が発生しているときに巨核球から血小板が生成されて いることが分かった。それを応用して生体外で発生させる縦型培養装置を開発し、物理パラメータを適合 させることによって、1千億個以上の血小板を作製することに成功した。
研究の背景
輸血は最も身近な細胞治療の一つですが、輸血用血液は献血するドナーに依存し、近い将来日本を含む多くの国において需要に供給が追いつかないことが予想されています。そのため、献血にとって代わる新たな生産システムとして、ヒトiPS細胞を用いた血小板作製技術が期待されています。
江藤教授らのグループは、2010年にヒトiPS細胞から血小板が生産できることを発表しましたが、輸血に必要なスケールでの血小板作製技術を開発するため、血小板を生み出す巨核球に着目し※、2014年にヒトiPS細胞から自己複製が可能な巨核球を誘導することに成功し、生体外で凍結保存も可能な不死化巨核球株として作製する方法を確立しました(中村ら 2014)。しかし、ヒト生体を循環する血小板に近い高い機能を持つ千億個単位の血小板を、これまで生体外で作製することに世界中で成功した例はありませんでした。そこで新たな製造方法へのチャレンジを必要としていました。
※iPS細胞から直接血小板を生産する方法では、輸血に必要な量の血小板を生産するためにはヒトiPS細胞が70億個程度必要で、最終的に血小板を得るまでに26日程度必要でした。しかし、自己複製する巨核球を用いると、10mlの培養液で1ccあたり200-400万個の血小板を作製できたので、理論上250億個の巨核球を用いると5日もあれば1千億個の血小板を生産できると計算していました。しかしながら、実際には静置培養条件である培養皿を単純にスケールアップしたような横型の培養装置では血小板生産量はその通りにはいきませんでした。
研究結果
1)マウスの生体内観察により乱流が血小板生成を活性化させることを解明
本研究では、まず、巨核球から血小板が生成される際の理想的な物理的条件を探るため、2光子顕微鏡注5)と粒子画像流速測定法(PIV) 注6)を用いてマウスの生体内観察を行いました(図1)。
マウスの骨髄において血小板が生成される瞬間の巨核球の様子と血流を測定すると、血流の中で乱流が発生するときに巨核球から血小板が生成されていることが観測できました。また、巨核球から血小板が生成されていないときには巨核球細胞膜周囲には乱流が発生していないことも確かめられました。これらの結果より、乱流が発生する動的な流れが実際の血小板生成の鍵であると結論づけました。
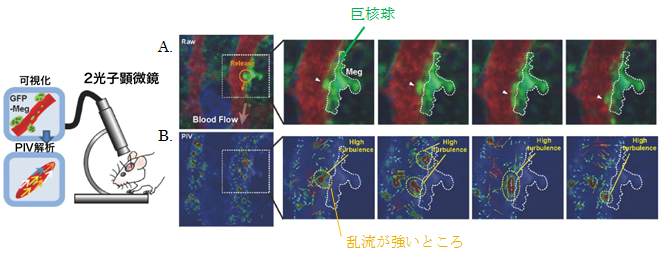
図1:マウスの生体内観察。生きたマウスの頭蓋骨の骨髄中の血流の動きをコマ送りで測定する。
(A) 2光子顕微鏡による可視化:
赤色の血管内で巨核球を緑色に蛍光させ、血小板の生成過程を可視化すると、血流に乗って巨核球の一部がちぎれて血小板が生成されていく様子が分かる(オレンジ色のマーク及び白色矢印)。(B)粒子画像流速測定法(PIV)解析:
(A)で可視化した血流の流量と流れの向きをPIV解析し、乱流を定性的に示すと(赤色は乱流が強く、青色は乱流が弱い)、乱流が強い領域において血小板が生成されていることが分かる(黄色マーク)。
2)乱流を発生させる縦型培養装置を開発し、さらに物理パラメータを適合させることによって、大量に高品質の血小板を作製することに成功
次に、生体外で血小板を効率よく大量に作製するため、乱流を発生させることのできる縦型培養装置を採用・開発しました。
0.3リットル、2.4リットル、8リットル容積の縦型円柱タイプのもので、ブレードの付いた中心の軸が最大300mm/sの速さで上下に運動します。0.3リットルの装置にはブレードは一つ、2.4リットル、8リットルの装置には楕円型のブレードが直角になる角度で二つ備わっています(下の写真は2.4リットルと8リットルの縦型培養装置)。

さらに、開発した縦型培養装置において、どのような物理的環境下で血小板がより多く作製されるのか検証するため、シミュレーションを行いました。
物理パラメータとして乱流エネルギー注3)、渦度注7)、せん断応力注4)、せん断歪速度注4)に着目し、0.3リットルと2.4リットルの装置における血小板産生量とこれらの物理パラメータの相関関係を調べました。その結果、血小板産生量に対して、縦型培養装置のスケールによらず、乱流エネルギーとせん断応力の最適領域が一致し、その他の物理パラメータ(渦度とせん断歪速度)は最適領域が一致しませんでした(図2)。
得られたデータをもとに、8リットルの縦型培養装置で乱流エネルギーとせん断応力を最適化させて血小板作製を行うと、血小板の産生量が約一千億(1×1011)個程度となることが異なるドナー由来の三つの巨核球細胞株 (Cl-7, N5-6, MK04)で確認できました(図3)。
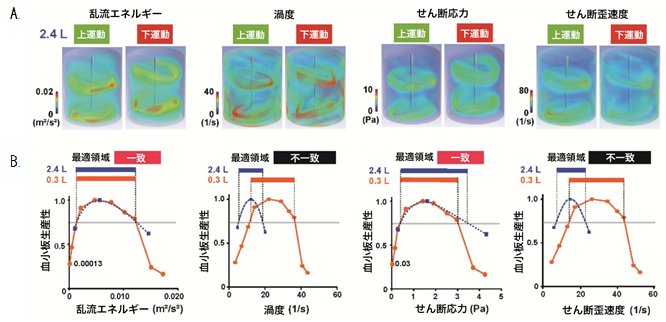
図2:縦型培養装置における物理パラメータ(シミュレーション結果)
(A)2.4リットルの縦型培養装置において中心軸を繰り返し上下運動させたときのシミュレーションの物理パラメータ(乱流エネルギー、渦度、せん断応力、せん断歪速度)を可視化した図。赤色がそれぞれの物理パラメータの数値が大きい部分を示す。
(B)(A)の物理パラメータと血小板生産性(血小板生産の最大値を1とする)との相関関係をグラフ化したもの。0.3リットルの縦型培養装置の場合のシミュレーション結果を併せてグラフ化すると、乱流エネルギーとせん断応力において、最適領域が一致した(閾値は乱流の無い培養装置の血小板生産性)。
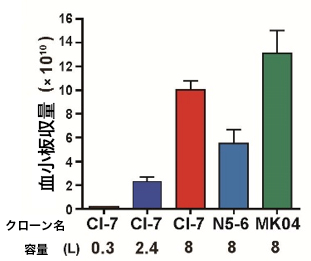
図3:血小板の収量比較
ドナーの異なるiPS細胞由来巨核球細胞株を三つ作り(クローン名:Cl-7、N5-6、MK04)、8リットルの縦型培養装置で乱流エネルギーとせん断応力を最適化して血小板を作製し、血小板収量を測定した。Cl-7については0.3リットル、2.4リットルの培養装置でも血小板作製を行い、その収量を比較した。
続いて、この培養装置で作製した血小板の機能を確認するため、縦型培養装置から血小板のみを分離・濃縮し、試験管内で血液凝固因子であるトロンビンおよびコラーゲンを添加したところ、血小板の凝集を確認しました。また、作製した血小板を二つの動物モデル(マウスとウサギ)に輸血し、献血由来の血小板の機能と比較したところ、両者ともに生体内を循環し、止血などが行われていることを確かめました。これらの結果から、作製した血小板の輸血用血小板としての機能が確かめられました。
3) 可溶性因子であるIGFBP2、MIF、NRDCを検出し、血小板生成メカニズムの一端を解明
本研究ではさらに、乱流によって効率よく巨核球から血小板が生成されるメカニズムを細胞レベルで調べました。まず、タンパク質マイクロアレイ注8)を用いて静置培養皿と縦型培養装置におけるサイトカイン注9)や酵素タンパクの放出量を調べ、乱流によって巨核球から多く放出される因子を6つ絞り込みました。次に、各候補因子の有無によって血小板生産性にどのような影響があるのかを独自に設計したフローチャンバー装置およびサイトメトリー解析注10)を用いて測定し、IGFBP2、MIF、NRDCという可溶性因子の存在が重要であることが分かりました(図4)。これらの結果から、乱流に伴い巨核球からIGFBP2、MIF、NRDCという可溶性因子が放出され、血小板生成を促進していることが分かりました。
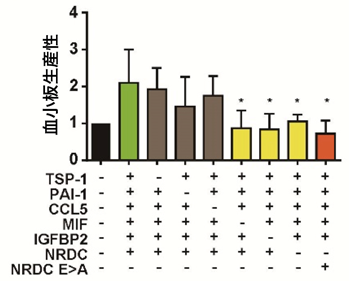
図4:候補因子の有無における血小板生産性
乱流によって巨核球から多く放出される6つの因子(TSP-1、PAI-1、CCL5、MIF、IGFBP2、NRDC)の有無(+あるいは-)による血小板生産性への影響を示す。どの因子も添加されないときの血小板生産性を1とする。IGFBP2、MIF、NRDCの因子が無いとき(黄色のグラフ)に生産性への影響が強いことがわかった。
本研究の意義と今後の展望
大量の血小板作製には乱流が鍵であることを本研究において突き止めました。これを応用し、臨床レベルで必要な1
千億個レベルでの血小板を作製することに成功しました。さらに、2種類の動物モデルを用いて作製した血小板の輸血を行い、血小板として機能していることを確認しました。これら一連の研究は、本研究グループが行っている血小板作製プロジェクトの臨床に向けた概念実証(POC: proof-of-concept)に当たります。
本研究の成果である、スケール変更可能な縦型培養装置の開発と血小板産生量に関わる二つの物理パラメータの同定は、今後、より大規模な血小板生産のための新たな培養装置の開発に大いに役立ちます。さらに、今回の血小板生成メカニズム一端の解明と生体外における血小板作製法の開発は、これからの血小板生成の研究、輸血医療、細胞治療や再生医療に影響をもたらすことが期待されます。
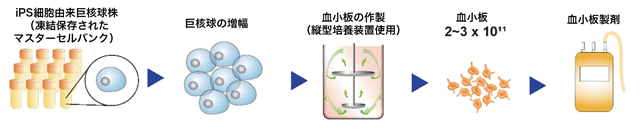
図5:血小板製造過程の確立
論文名と著者
- 論文名
- “Turbulence activates platelet biogenesis to enable clinical scale ex vivo production”
- ジャーナル名
- Cell
- 著者
- Yukitaka Ito1, 8,●, Sou Nakamura1,● , Naoshi Sugimoto1, Tomohiro Shigemori8, Yoshikazu Kato9, Mikiko Ohno2, Shinya Sakuma4, Keitaro Ito4, Hiroki Kumon4, Hidenori Hirose8, Haruki Okamoto8, Masayuki Nogawa3, Mio Iwasaki1, Shunsuke Kihara1, Kosuke Fujio1, Takuya Matsumoto1, Natsumi Higashi1, Kazuya Hashimoto1, Akira Sawaguchi7, Ken-ichi Harimoto1, Masato Nakagawa1, Takuya Yamamoto1, Makoto Handa3, Naohide Watanabe3, Eiichiro Nishi2, Fumihito Arai4, Satoshi Nishimura5, Koji Eto1, 6,*
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 滋賀医科大学 薬理学講座
- 慶應義塾大学 輸血・細胞療法センター
- 名古屋大学 マイクロ・ナノシステム工学専攻
- 自治医科大学 分子病態治療研究センター
- 千葉大学 再生治療学研究センター
- 宮崎大学医学部 解剖学講座
- 株式会社メガカリオン
- 佐竹化学機械工業株式會社 攪拌技術研究所
●:共同筆頭著者 *:責任著者
本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム 再生医療の実現化ハイウェイ
「iPS細胞技術を基盤とする血小板製剤の開発と臨床試験」 - AMED 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
- AMED 再生医療実用化研究事業「同種血小板輸血製剤の上市に向けた開発」
- 日本学術振興会 基盤研究
- 厚生労働省 革新的医薬品・医療機器・再生医療等製品実用化促進事業
用語説明
- 注1)血小板
- 血液に含まれる細胞成分であり、出血の際、血小板の活性化が起こって血小板どうしが凝集して傷口を塞ぐ働きをする。巨核球から分離して作られる。
- 注2)巨核球
- 造血幹細胞から作られる細胞で、血小板を生み出す細胞。巨核球は成熟すると核分裂はするが細胞分裂はしないという特殊な分裂を行い、大型で多核の細胞になる。
- 注3)乱流エネルギー
- 動きが不規則に絶えず変動している乱れた状態の流れを乱流と言う。乱流エネルギーとは流れの乱れの強さを表す。
- 注4)せん断応力・せん断歪速度
- 流体の平行方向をはさみ切るような作用をせん断と言う。せん断応力とは、せん断の物理量を力で示したもの。せん断歪速度は単位時間あたりの流体が変形する割合を表す
- 注5)2光子顕微鏡
- 蛍光分子にレーザー光を照射したときに、2つの光子が同時に吸収される2光子吸収過程を使った顕微鏡。組織の深部まで見ることができる
- 注6)粒子画像流速測定法(Particle Image Velocimetry, PIV)
- 血液の血流などの流体の粒子を生きたまま生体内で観測できる流体計測法。流体部分にレーザーシートを照射して可視化し、これをカメラで連続撮影する。カメラで撮影したフレーム間の微小時間を使い、粒子の変位や速度を測定できる
- 注7)渦度
- 流れの回転をベクトル量で示したもの。
- 注8)マイクロアレイ
- 一度に膨大な数のDNAやRNA、タンパク質を網羅的に検査することができる解析技術。
- 注9)サイトカイン
- さまざまな細胞から分泌され、特定の細胞の働きに作用するタンパク質。
- 注10)フローサイトメトリー解析
- 流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
大内田 美沙紀
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課

