生体内の暗闇に光を灯す新技術次世代型光がん治療として期待
2018-07-17 早稲田大学,防衛医科大学校,科学技術振興機構(JST)
ポイント
- 光でがんを治療する光線力学療法(Photodynamic therapy:PDT)では、腫瘍と光源の位置が少しでもずれると治療効果が得られないため、生体内の臓器や組織上に長期間安定に固定できる体内埋め込み型の発光デバイスの開発が望まれていた。
- 高分子ナノ薄膜と無線給電式LEDを組み合わせることでシールのように貼り付けられる発光デバイスを開発し、担がんモデルマウスへの体内埋め込み型の光がん治療に応用させ、腫瘍を消失させることに成功した。さらに、従来の1000分の1の光強度かつ緑色光による高い治療効果を世界に先駆けて実証した。
- 患者への負担が少ない次世代型がん治療法としての応用や、深部臓器がんへの適用が困難とされていたPDTの適用範囲の拡大が期待される。
早稲田大学 高等研究所の藤枝 俊宣 准教授、同 先進理工学研究科の山岸 健人 博士、同 理工学術院の武岡 真司 教授は、防衛医科大学校 生理学講座の守本 祐司 教授らの研究グループと共同で、生体組織表面にシールのように貼り付けられる体内埋め込み型の発光デバイスを開発しました。このデバイスを担がんモデルマウスの体内に移植することで光がん治療に応用し、腫瘍を消失させることに成功しました。
体内埋め込み型の発光デバイスの研究や開発は近年、盛んに行われており、厚さミリメートルの薄膜状デバイスが数多く報告されています。小型化した発光デバイスを体内の腫瘍直下に貼り付けて固定し、無線給電式に点灯できれば、従来法では困難だった体内深部の臓器にできたがんを治療できる新たな医療技術として大いに期待されています。しかし、腫瘍と光源の位置が少しでもずれると腫瘍に蓄積した光増感剤を効率よく励起できず、治療効果が得られないため、生体内の臓器や組織上で長期間安定に固定できる体内埋め込み型の発光デバイスの開発が望まれていました。
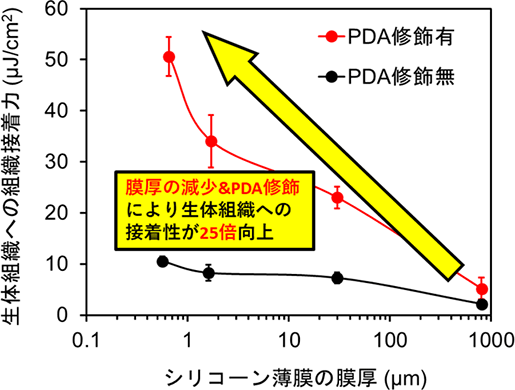
本研究グループは、柔軟性や伸縮性に優れるシリコーン製の高分子ナノ薄膜注1)(膜厚約600ナノメートル(※ナノメートルは100万分の1ミリメートル))の表面に生体模倣型接着分子であるポリドーパミン(Polydopamine:PDA)注2)をコーティングすることで、厚さミリメートルのシリコーン薄膜に対して生体組織への接着性を25倍向上させ、小型デバイスを縫合なしで生体内に2週間以上、安定に固定することに成功しました。また、無線給電式のLEDチップ(赤・緑)を担がんモデルマウス体内の腫瘍直下に固定し、無線給電アンテナを用いて10日間連続的に点灯させたところ、腫瘍を消失させることにも成功しました。
本研究では、光源を腫瘍の間近に設置できるので、従来型の光がん治療で用いられているレーザー光の1000分の1の光の強さのLEDでも顕著な腫瘍消失効果が得られました。さらに、これまで組織透過性の観点から「生体の窓」と呼ばれる近赤外光しか使われてこなかった光がん治療において、デバイスを体内埋め込み型にすることで、緑色光を用いた治療効率の高い光がん治療を世界に先駆けて実現しました。
無線給電式・埋め込み型光がん治療の臨床応用が実現すれば、負担が少ない次世代型がん治療法として、将来、患者に恩恵をもたらすと期待されます。
本研究は、早稲田大学 先進理工学研究科 修士課程の高橋 功 氏、京都大学 大学院医学研究科の桐野 泉 医師および東京大学 大学院医学系研究科の天野 日出 医師らと共同で行ったものです。
本研究成果は、2018年7月16日(英国時間)に英国科学誌「Nature Biomedical Engineering」のオンライン速報版で公開されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ「素材・デバイス・システム融合による革新的ナノエレクトロニクスの創成」(研究総括:桜井 貴康)の研究課題「移植用培養生体組織に搭載可能なナノエレクトロニクスの創成」(研究代表者:藤枝 俊宣)の支援を受けて行われました。
<研究の背景と経緯>
光線力学療法(Photodynamic therapy:PDT)注3)は、光増感剤が集まった病巣へ光を照射することにより発生する活性酸素でがんの細胞死を誘導するものです。日本では1990年代に保険承認され、病変選択的な優れたがん治療法として認められています。2000年に入ってから、出力の非常に弱い光源(従来の1/1000)を用いた「メトロノミックPDT(mPDT)」法が提唱され、従来のPDT法では難しかった体内深部の臓器にできたがん(たとえば肝がん、膵がん)を治療できる新たな医療技術として大いに期待されています。しかし、光強度の非常に弱いmPDTでは、光源の位置が少しでもずれると腫瘍への光照射が不十分となり、抗腫瘍効果が得られません。そのため、生体内の臓器や組織上で安定に固定でき、腫瘍に対して長時間安定的に光照射できる体内埋め込み型の発光デバイスの開発が望まれていました。
一方、生体内の組織や臓器表面は、粘膜や漿膜といった薄い膜に覆われていて滑りやすく、一般的に硬い電子素子を縫合術や医療用接着剤を使わず安定に固定することは困難と考えられてきました。そこで、硬くドライな電子機器と柔らかくウェットな生体組織を滑らかにつなぐ材料として高分子ナノ薄膜に着目し、生体内の臓器や組織上に数ミリメートルサイズの小型デバイスを縫合なしに長期間安定に固定する手法の実現を目指しました。
<研究の内容>
本研究では、生体内の臓器や組織表面にシールのように貼り付けるだけで固定できる体内埋め込み型の発光デバイスを開発し、mPDTへ応用することを目的としました。膜厚約600ナノメートルのシリコーンゴム製ナノ薄膜の表面に生体模倣型接着分子であるポリドーパミン(Polydopamine:PDA)を修飾することで生体組織への接着性が約25倍向上することを発見し(図1)、生体内においても小型の電子デバイスを縫合なしに2週間以上安定に生体組織上で固定させることに成功しました。この伸縮性と接着性に優れたナノ薄膜を用いて近距離無線通信(Near Field Communication:NFC注4))発光式LEDチップ(赤・緑)を生体内の組織や臓器表面上で固定することで、mPDTが抱える光源の「ずれ」の問題を解決し、完全埋め込み型のmPDTシステムを構築しました(図2)。
本研究では、背中の皮内に腫瘍細胞を移植した担がんモデルマウスの皮下に無線発光デバイスを貼り付け、固定しました(図3)。そして、光増感剤であるフォトフリンをマウスに静注注射した後、マウス飼育箱の下に設置した無線給電用アンテナ(図4)からLEDに電力を送り、埋植したデバイスを10日間連続的に点灯させました。その結果、光照射により治療された腫瘍が顕著に縮退し(図5)、緑色光を使用することで腫瘍を完全に消失させることにも成功しました。
本研究の特筆すべき点として、光源を腫瘍の間近に設置できるので、従来のPDTで用いられているレーザー光の1000分の1のLEDでも顕著な腫瘍縮退効果が得られ、さらに、これまで組織透過性の観点から「生体の窓」と呼ばれる近赤外光しか使われてこなかったPDTを埋め込み型デバイスにすることで、緑色光でも治療効率の高いPDTを世界に先駆けて実現しました。
<今後の展開>
生活水準を維持しつつ治癒あるいは生存期間延長を可能とさせる低侵襲がん治療法が求められている昨今において、生体に光増感剤を投与しながら腫瘍に対し低強度光を長時間かけて照射するmPDTは、その低侵襲性から次世代型PDTとして期待されています。本研究で開発した体内埋め込み型の発光デバイスは、移植する際に縫合を必要としないため、脳や肝臓、膵臓のような重要な血管や神経を巻き込む組織、構造的に脆弱な組織にも適用ができます。さらに、肝がんや膵がんといった深部臓器がんへの適用が困難とされていたPDTの適用範囲を拡げることができます。また、従来のPDTに比べて非常に弱い光(従来の1000分の1)で治療するmPDTでは、レーザー光照射に伴う組織温度の過剰上昇や周囲臓器の熱障害にともなう副作用は原理上起こりません。無線給電式・埋め込み型光がん治療の臨床応用が実現すれば、負担が少ない次世代型がん治療法として、将来、患者に恩恵をもたらすと期待されます。
<参考図>
![]()
図1 シリコーン薄膜の膜厚減少とPDA修飾による生体組織への接着力の増強効果
(Nat. Biomed. Eng.の論文中のFigure 2iを改変の上転載)
![]()
図2 本研究で開発した生体組織表面にシールのように貼り付けられる無線給電式発光デバイス
(Nat. Biomed. Eng.の論文中のFigure 1aを改変の上転載)
![]()
図3 生体模倣型接着分子ポリドーパミンを修飾したナノ薄膜による光源の固定
(Nat. Biomed. Eng.の論文中のFigure 1cを改変の上転載)
![]()
図4 本研究で使用したmPDT用無線給電システム
![]()
図5 埋め込み型発光デバイスによるmPDTの腫瘍縮退効果
(Nat. Biomed. Eng.の論文中のFigure 4hを改変の上転載)
<用語解説>
- 注1)高分子ナノ薄膜
- 数十~数百ナノメートルの厚さに対して、数平方センチメートル以上の面積を有する自己支持性高分子超薄膜。基板などの支持体が無くてもピンセットなどで取り扱うことが可能である。ポリ乳酸や多糖などの生分解性高分子を用いれば、臓器や組織用の創傷保護材(ナノ絆創膏)として利用できる。最近では、導電性高分子を用いた皮膚貼付型電極(電子ナノ絆創膏)を開発している参考文献1)。
- 注2)ポリドーパミン(Polydopamine:PDA)
- イガイ科の貝が分泌する接着たんぱく質の分子構造に倣いNorthwestern大学のMessersmithらの研究グループが人工的に合成した生体模倣型接着性高分子。さまざまな物質(金属、プラスチック、セラミックスなど)の表面に容易に修飾可能であることから、バイオマテリアルの分野において幅広く応用されている参考文献2)。
- 注3)光線力学療法(Photodynamic therapy:PDT)
- 光感受性物質(光増感剤)にその吸収波長の光を照射してやると、光化学反応によって活性酸素が生じる。光線力学療法は、この原理を利用してがん細胞の細胞死を誘導する治療法である。日本では、光増感剤としてポルフィマーナトリウムとタラポルフィンナトリウムが承認されており、食道がんや脳腫瘍の治療などに使用されている。
- 注4)近距離無線通信(NFC)
- 13.56MHzの周波数を利用して通信を行う近接型無線通信。「非接触通信」とも呼ばれる。FeliCa(ソニーが開発した非接触型ICカードの技術方式でSuica/Pasmoに採用されている)の通信方式などに用いられている。
<参考文献>
参考文献1)T. Fujie.“Development of free-standing polymer nanosheets for advanced medical and health-care applications” Polym. J. 48, 773-780 (2016).
参考文献2)Lee, H., Dellatore, S. M., Miller, W. M. & Messersmith, P. B. “Mussel-inspired surface chemistry for multifunctional coatings” Science 318, 426-430 (2007).
<論文情報>
タイトル:“Tissue-adhesive wirelessly powered optoelectronic device for metronomic photodynamic cancer therapy”
著者名:Kento Yamagishi, Izumi Kirino, Isao Takahashi, Hizuru Amano, Shinji Takeoka, Yuji Morimoto, Toshinori Fujie
<お問い合わせ先>
<研究に関すること>
(デバイス)
藤枝 俊宣(フジエ トシノリ)
早稲田大学 高等研究所 准教授
(医療)
守本 祐司(モリモト ユウジ)
防衛医科大学 校生理学講座 教授
<JST事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 戦略研究推進部
<報道担当>
早稲田大学 広報室 広報課
科学技術振興機構 広報課