2022-05-18 神奈川工科大学,慶應義塾大学,生命創成探究センター,生理学研究所,基礎生物学研究所
神奈川工科大学創造工学科広井賀子教授と、慶應義塾大学大学院理工学研究科大学院生中村隆之(研究当時)、同大学理工学部舟橋啓教授、山田貴大専任講師、東京大学大学院薬学系研究科岡部弘基助教、及び自然科学研究機構生命創成探究センターの富永真琴教授、野中茂紀准教授、同基礎生物学研究所亀井保博特任准教授、坂本丞特任助教、谷口篤史博士らのグループは、傷を塞ぐために移動中の細胞は、移動しない細胞より1度以上温度が高いことを、2つの原理の異なる計測方法で確かめることに成功しました。同時に、動いていない細胞を狙って赤外レーザーで1細胞ずつ温めると、温められた細胞は移動を開始することを示すデータを取得しました。この研究成果は、細胞という微小な空間において温度差が生じることを堅固に裏付けた上で、さらにその温度差が生理的な機能を持ちうることを示唆しています。この方法を応用することで、治りにくい傷を早く安全に治療する方法の開発が期待されます。
本研究成果は学術雑誌 Optics continuum にて5月3日(米国東部時間)に公開されました。
1.本研究のポイント
・傷周辺の細胞は傷から離れた位置にある細胞に比べ、温度が高いことを、測定原理の異なる二つの方法で確認した。
・この温度差が、細胞の活動によって結果として生じただけのものなのか、温度差の影響によってさらなる反応がもたらされるのかを確認するため、細胞のすぐ近くを赤外レーザーで温めたところ、細胞内の温度もレーザー照射に伴って上昇し、同時に細胞が変形、移動することが確認された。
2.研究背景
私たちの体は細胞という1ミリの1/10~1/100程度の大きさの小さな単位で作られています。長い間、このような小さな空間ごとに、区別された温度を維持することができるとは、物理学の常識の中で想像されたこともないことでした。
しかし近年、計測技術が進歩するにつれて、細胞ごとや、さらに細胞の中にある小さな器官などによって、温度が高かったり低かったりする証拠が次々と捉えられています。現在、それらの測定が正しいのかどうか、という議論を含め、そのような小さな空間ごとの異なる温度の役割が何であるか、注目を集めています。
そのような研究動向の中、本研究グループは、傷の修復過程における傷周辺細胞の活動に着目しました。人体の創傷治癒や炎症過程において、細胞の移動は重要な役割を担っています。特に真っ先に移動する細胞をリーダー細胞、その後に続く形で移動を行うフォロワー細胞の間に、温度差と温度差に伴う活動の違いがある可能性を検証するため、次のような実験を行いました。
3.研究内容・成果
グループは、傷が治る際の様子を模倣した細胞培養系、創傷治癒アッセイ系に着目しました。この培養技術では、培養されたシート状の細胞の一部に切り傷をつけることで、その傷が細胞移動によって埋まっていく様子を観察することができます。
この系に対し、リーダー細胞とフォロワー細胞の温度をそれぞれ計測し、また結果が測定法に由来する誤りでないことを明確にするため、有機ポリマーを利用した蛍光寿命イメージング顕微鏡法(※1)と、量子ナノドットを利用した蛍光波長シフト顕微分光法(※2)の、全く異なる二つの方法を用い計測を行いました。
その結果、傷を埋めるために真っ先に移動するリーダー細胞は、移動しないか、後に続いて移動するフォロワー細胞より、1〜10˚C温度が高いことをどちらの方法でも確かめることに成功しました。これにより、リーダー細胞がフォロワー細胞より温度が高い、という現象は、一つの手法に起因した誤差によってたまたまそのように観察されたのではなく、複数の異なる原理の手法で確認できる現象であることを明らかにしました。これは、細胞のような小さな空間ごとに温度差が存在する、という確かな証拠を一つ加える重要な結果です。
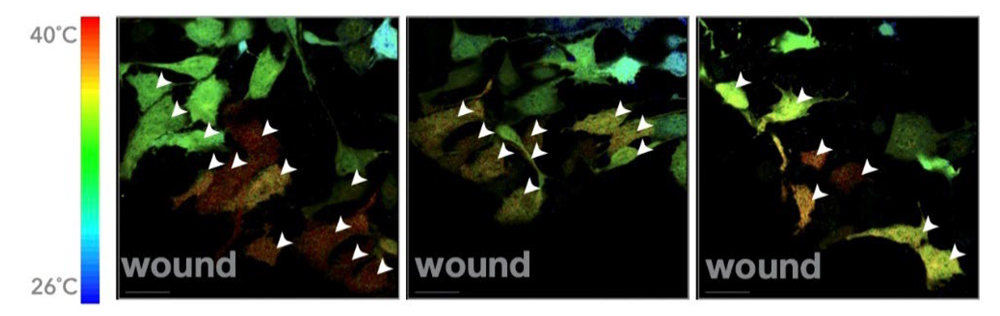 図1 蛍光寿命イメージング顕微鏡法により傷周辺の細胞間の温度の違いを測定した様子。写真の中で、温度が高い細胞は赤色、低い細胞は青色で示される。傷際の細胞は赤色で示され、他の部位の細胞より温度が高いこと、傷から遠ざかるにつれて細胞は青色に近づき、温度が低くなっていることが分かる。
図1 蛍光寿命イメージング顕微鏡法により傷周辺の細胞間の温度の違いを測定した様子。写真の中で、温度が高い細胞は赤色、低い細胞は青色で示される。傷際の細胞は赤色で示され、他の部位の細胞より温度が高いこと、傷から遠ざかるにつれて細胞は青色に近づき、温度が低くなっていることが分かる。
加えて、温度の違いが生理的にどのような意味があるかを探るため、細胞シートに傷を作る代わりに、細胞を痛めることなく温度の上昇を誘導することができる波長1480 nmの赤外レーザーを利用して、細胞のすぐ近くを照射したところ、細胞の内部がレーザー照射に伴って温度上昇することが確かめられると同時に、温められた細胞は、温度上昇と同じタイミングで変形・移動する様子が観察されました。
以上の結果から、細胞温度の上昇は、細胞の移動を開始させ、運動を維持させるという役割を担う可能性があることが明らかになりました。これは、生体内の微小な空間における温度差が、生理的な役割、すなわちこの場合であれば、傷を治そうと働きかける役割があることを示唆する点で大きな意義のある結果です。
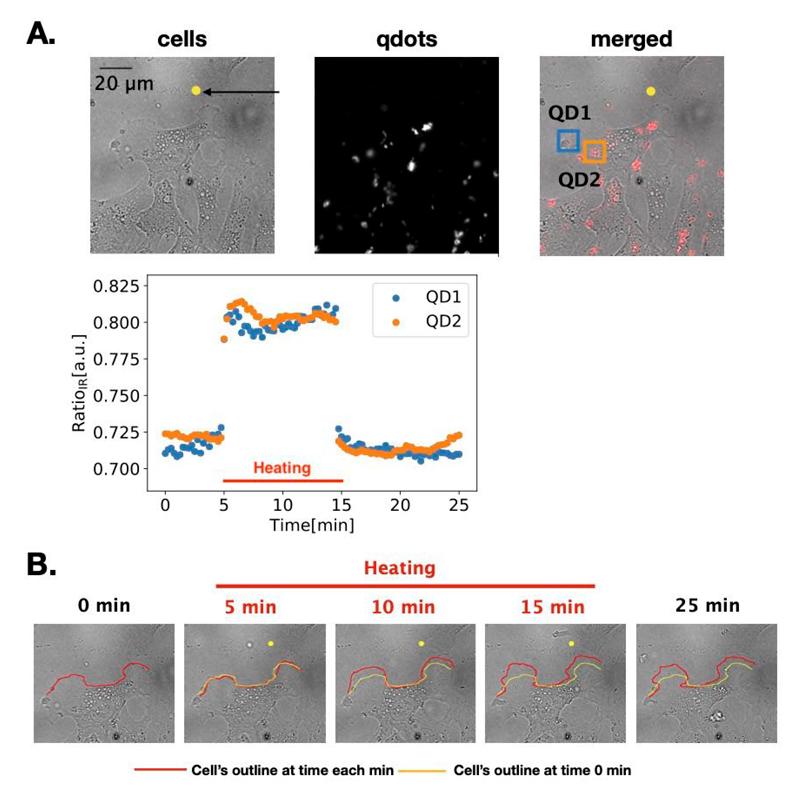
図2 量子ドットを用いて赤外レーザーによる温度上昇の様子を観察した結果。上段Aの写真の黄色い点が、赤外レーザーの照射位置。右側(merged)の写真の赤い点が量子ドット。グラフはレーザー照射前(~5分)、照射中(5~15分)、照射後(15分~)の、細胞内の量子ドット1(青)、2(オレンジ)の位置での温度変化を表す。Bの写真は同じ時刻における細胞形状の変化を撮影したもの。レーザー照射中のみ、レーザーに向かって細胞が動いている様子が見られる。
4.今後の展開
本研究により、傷を埋めようとする細胞は、同じ組織の中にある同種の動かない細胞に比べて温度が高いこと、また温度が上昇させられることがきっかけとなって、細胞の移動が始まり、温度が下がると移動が止まることが確認されました。
炎症を起こしている組織の温度が上昇し、それに伴い、組織修復のプロセスの一端を担う免疫細胞の一種について炎症部位への移動が促進されることを報告した論文が、本論文とほぼ同時に発表されています[1]。このことは、組織の炎症・修復のプロセスで、温度が修復を早めるためのシグナルとして利用されている可能性を別の視点からサポートしていると考えられます。
今後は、温度上昇によって細胞内部でどのような変化が起き、実際に移動や変形に結びついているのか、そのメカニズムの解明が待たれます。同時に、赤外レーザーをはじめとする、副作用の生じにくい方法で、温度変化を人体の深部にできた損傷や、老化に伴って治癒しにくくなった傷の修復誘導に応用することなどが考えられます。
※本研究はExCELLS課題研究(シーズ発掘)(18-205, 19-207, 20-205), 基礎生物学研究所共同利用 (17-524; 18-509; 19-346 :), JSPS科研費 (17H06258 及び 20H02586 )などの助成や支援を受けて行われました。
<原論文情報>
タイトル:Temperature elevation detection in migrating cells.
タイトル和訳:移動する細胞の温度上昇の検出
著者:中村隆之1、坂本丞2、岡部弘基3、谷口篤史2、山田貴大1、野中茂紀2, 4、亀井保博2、舟橋啓1、富永真琴4, 5 、広井賀子1, 6
1慶應義塾大学 2自然科学研究機構 基礎生物学研究所 3東京大学薬学研究科4自然科学研究機構 生命創成探究センター 5自然科学研究機構 生理学研究所 6神奈川工科大学創造工学部
掲載誌:Optics Continuum (DOI: 10.1364/OPTCON.453885)
<用語説明>
※1 蛍光寿命イメージング顕微鏡法: 蛍光色素が個々に持つ蛍光寿命を、顕微システムで測定する技術。今回は特に、共著者の一人である東京大学岡部弘基助教の開発した、哺乳動物体温付近に高い感受性のあるfluorescent polymeric thermometer (FPT) [2]を用い、撮像する細胞中に分散させ、構造中のポリマーが温度に依存して相転移することによる蛍光寿命の変化を擬似カラーで可視化している。
※2 蛍光波長シフト顕微分光法: 量子ドットを構成する半導体が、吸収した紫外線のエネルギーを半導体内の電子のギャップ移動を介して再び蛍光として放出する際、環境の温度に依存して放出する蛍光波長が変化する性質を利用し、変化を検出するのに十分な解像度の分光システムを搭載した共焦点蛍光顕微鏡または超解像度蛍光顕微鏡を用いて、個々の量子ドットの発する蛍光波長の変化から温度変化を検出する方法。今回は特に,細胞内の温度変化を検出するために広井らが開発した計算手法[3]をさらに改良し、多くの量子ドット間の温度を比較可能な手法で計測を行った。
[1] Khachaturyan, G., Holle, A.W., Ende, K. et al. Temperature-sensitive migration dynamics in neutrophil-differentiated HL-60 cells. Scientific Reports 12, 7053 (2022)
[2] Okabe, K., Inada, N., Gota, C. et al. Intracellular temperature mapping with a fluorescent polymeric thermometer and fluorescence lifetime imaging microscopy. Nat Commun 3, 705 (2012). https://doi.org/10.1038/ncomms1714
[3] Tanimoto, R., Hiraiwa, T., Nakai, Y. et al. Detection of Temperature Difference in Neuronal Cells. Scientific Reports 6, 22071 (2016). https://doi.org/10.1038/srep22071
※ご取材の際には、事前に下記までご一報くださいますようお願い申し上げます。
※本リリースは文部科学記者会、科学記者会、各社科学部等に送信させていただいております。
・研究内容についてのお問い合わせ先
神奈川工科大学 創造工学部 教授 広井 賀子(ひろい のりこ)
慶應義塾大学 理工学部 教授 舟橋 啓 (ふなはし あきら)
東京大学大学院 薬学系研究科 助教 岡部 弘基(おかべ こうき)
自然科学研究機構 生命創成探究センター/生理学研究所 教授 富永 真琴(とみなが まこと)
・本リリースの配信元
神奈川工科大学 研究推進機構 研究広報部門
慶應義塾広報室
自然科学研究機構
生命創成探究センター 研究戦略室
生理学研究所 研究力強化推進室
基礎生物学研究所 広報室


