2022-07-01 国立がん研究センター
発表のポイント
- 血液がんで繰り返し生じている様々な種類の遺伝子異常を網羅的に検出可能な遺伝子パネル検査を設計し、その有用性を検証しました。
- 前向きコホート研究を行い、初発・再発の血液がん患者176人の検体を用いて本遺伝子パネル検査の診断・治療法選択・予後予測に対する有用性を示しました。特に診断、次いで予後予測に対する有用性が高いことが明らかとなりました。
- 本報告は、国内で開発された血液がんの遺伝子パネル検査の有用性を初めて報告したものであり、日本における血液がん診療での包括的ゲノムプロファイリング(注1)の普及、および、ゲノム医療(注2)の基盤となることが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)は、大塚製薬株式会社(以下、大塚製薬)などと2020年に共同開発した血液がん(造血器腫瘍)に対する遺伝子パネル検査において、診断や治療法選択、予後予測に有用な遺伝子異常を検出するパネルを設計し、性能評価と実臨床における有用性を検証するため、国内主要施設と共同で初発・再発の血液がん患者さん176人の検体を用いて前向きコホート研究を実施しました。その結果、本遺伝子パネル検査の実臨床での有用性が示されました。本研究成果により、今後、血液がん診療における包括的ゲノムプロファイリングの普及とゲノム医療を推進するための基盤が構築されることが期待されます。研究結果は科学誌「Cancer Science」に2022年6月17日に掲載されました。
血液がん(白血病、悪性リンパ腫、多発性骨髄腫など)は10万人当たり年間約45人が発症する比較的高頻度に認められるがんで、20歳未満では全がんの約4-5割を占める最も多いがんです。血液がんでは様々な遺伝子異常が生じており、血液がんの発症や病態に関わり、治療標的にもなりうることが知られています。がん遺伝子パネル検査は一度に多数の遺伝子異常を検出することが可能な検査法で、固形がんを対象とした検査が既に保険適用されていますが、血液がんでは国内外ともに保険適用された検査はありません。固形がんと血液がんでは、認められる遺伝子異常の種類が大きく異なることや、血液がんのがん細胞は末梢血、骨髄、リンパ節など様々な組織に含まれるため検査に用いる試料が様々であること、また検査の目的が固形がんでは「治療法選択」が主であるのに対し、血液がんでは特徴的な遺伝子異常の有無により診断が変わったり、予後が変わることで治療方針が変わったりするため「治療法選択」だけではなく「診断」と「予後予測」も目的として検査を行う必要があること、などの理由で、固形がんとは異なる独自の開発が求められていました。
本研究は、国立がん研究センター中央病院 血液腫瘍科 福原傑外来医長、伊豆津宏二科長、研究所 分子腫瘍学分野 木暮泰寛研究員、分子腫瘍学分野 片岡圭亮分野長(慶應義塾大学医学部内科学教室(血液)教授)らの研究グループと、大塚製薬、京都大学大学院医学研究科腫瘍生物学講座 小川誠司教授らと共同で行いました。
背景
血液がんは非常に多くの種類の疾患を含んでいますが、がん細胞の形態だけではなく、がん細胞の持つタンパクや遺伝子異常など様々な情報をもとにして診断・分類を行います。近年の次世代シーケンサーの登場により、様々な発がんの分子メカニズムが明らかとなり、遺伝子異常は血液がんの発症・病態に非常に重要な役割を担っていることがわかってきました。特定の遺伝子異常に基づいた血液がんの診断や、予後の予測、遺伝子異常を標的とした治療薬の登場など、実臨床においてゲノム検査は重要かつ必須の検査となってきています。このような血液がんで臨床上有用であると考えられる遺伝子異常は、最新の分類においても250以上認められていますが、さらに新規の遺伝子異常が次々に報告されています。また、急性骨髄性白血病(AML)や骨髄異形成症候群(MDS)などの骨髄系腫瘍の一部ではRUNX1やDDX41といった遺伝子の生殖細胞系列異常(注3)が発症に関与していることが解明され、がん細胞だけではなく生殖細胞系列のゲノム検査の必要性も明らかとなってきました。
血液がんで生じている遺伝子異常には、変異(注4)、融合遺伝子(注5)/構造異常(注6)、コピー数異常(注7)など様々な種類があります。免疫グロブリン遺伝子(IGH)が関与する構造異常(IGH/BCL2など)は特定の病型において特徴的であり、診断や予後に関わります。また、血液がんに特徴的な融合遺伝子も多数報告されており、特に白血病では診断や予後、治療方針に大きく関与します。しかし、このような融合遺伝子/構造異常についての検査法は限られていました。そのため、血液がんにおいても網羅的に遺伝子異常を調べることができる検査法の確立が望まれています。
国立がん研究センターは、血液がんに対するゲノム医療の加速と保険適応を目指すために、他の国内主要施設、大塚製薬と共同研究コンソーシアムを形成し、血液がん遺伝子パネル検査の開発に取り組んでまいりました(国内初の造血器腫瘍を対象とする遺伝子パネル検査を開発)。
主な研究成果
本研究では、血液がん領域におけるがんゲノム医療の実現を目指すため、変異だけでなく、融合遺伝子/構造異常、コピー数異常も検出し、さらに、体細胞異常(注8)に加えて生殖細胞系列異常も検出可能な、血液がんに特化された遺伝子パネル検査を開発し、その実臨床での臨床的有用性を検証する前向きコホート研究を実施しました。
1.血液がん遺伝子パネル検査の設計
血液がんで繰り返し遺伝子異常が起きていることが報告されている452遺伝子の変異・融合遺伝子/構造異常・コピー数異常からなる体細胞異常および生殖細胞系列異常を網羅的に解析することが可能な遺伝子パネル検査を設計しました。
2.患者検体を用いた血液がん遺伝子パネル検査による包括的ゲノムプロファイリング検査の実施
前向きコホート研究を行い、176人188検体の患者検体(成人および小児から得られた初発および再発検体)を用いて、本遺伝子パネル検査による包括的ゲノムプロファイリングを行いました。97%の患者で1個以上の遺伝子異常が検出され、1人の患者につき中央値7個の遺伝子異常が検出されました。血液がんで高頻度に異常が認められる遺伝子異常の検出力は既存の遺伝子パネル検査と同等以上であり、本遺伝子パネル検査の高い性能が示されました。
3.本遺伝子パネルの性能と臨床上の有用性を確認
診断、治療法選択、および予後予測における有用性の観点から、検出された遺伝子異常を血液がんの疾患ごとに評価しました。その結果、診断、治療法選択、予後予測を行う上で臨床上有用であると考えられる遺伝子異常が、それぞれ82%、49%、58%の患者で検出され、遺伝子パネル検査は特に診断、次いで予後予測に有用であることが示されました。
具体的な研究内容
■血液がん遺伝子パネル検査の設計
今回、我々は様々な種類の遺伝子異常(変異、融合遺伝子/構造異常、コピー数異常)を検出することができるように、ターゲットキャプチャー法によるDNAパネル(注9)とRNAパネル(注10)を設計しました。このパネル検査には合計452個の遺伝子が含まれており、血液がんのドライバー遺伝子として造血器腫瘍ゲノム検査ガイドライン(注11)に記載されている遺伝子のほとんどを網羅しています。シーケンス解析はIllumina社の次世代シーケンサーを用いて行い、解析はGenomonパイプライン(注12)を用いました。
■患者検体を用いた血液がん遺伝子パネル検査による包括的ゲノムプロファイリング検査の実施
本遺伝子パネル検査の性能評価と、実臨床における包括的ゲノムプロファイリングの有用性を検証するために、当センター(中央病院および東病院)で治療を受けた血液がん患者(初発および再発の成人および小児患者)を対象に前向きコホート研究を行いました(図1)。合計で176人の患者(合計188検体)を解析しました。検体の種類では骨髄液や末梢血などの生細胞だけでなく、ホルマリン固定パラフィン包埋検体でも高率に解析可能であることが示されました。また採取法について、針生検で採取された比較的少量の検体でも高率に解析が可能であることも示されました。
97%の患者で1個以上のドライバー遺伝子の異常が検出され、1人の患者につき中央値7個の遺伝子異常が検出されました。遺伝子変異の中央値は4個でした。融合遺伝子/構造異常は全部で121個検出され、約半数の患者で1個以上の構造異常が検出されました(図2)。

図1 研究全体の流れ(A)と登録された血液がんの種類(B)。
©2016 DBCLS TogoTV / CC-BY-4.0
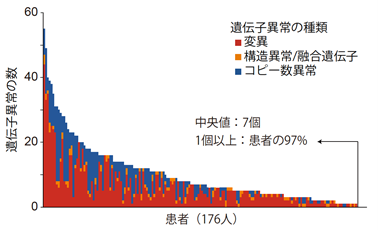
図2 患者ごとに検出された遺伝子異常の数
■免疫グロブリン遺伝子(IGH)再構成や稀な融合遺伝子の検出
今回の解析で51個の活性型構造異常が検出され、その半数以上はIGH遺伝子再構成でした。また一般にBCL6やMYCではIGH以外のパートナー遺伝子との活性型構造異常も認められますが、本解析ではそれらの構造異常を検出することも可能でした(図3)。さらに、頻度の低い異常であるPVT1-SUPT3HやGATA2/MECOM等も検出できることが示されました。既存の検査法であるFISH法との比較において感度・特異度はそれぞれ94%、100%と良好な結果が示されました。
融合遺伝子関連構造異常やinternal tandem duplication(ITD)/partial tandem duplication(PTD)(特殊な構造異常)は35個および8個検出されました。BCR-ABL1に加え、ALK、FGFR1、ROS1など治療標的になりうる融合遺伝子関連の構造異常も複数検出されました。FISH法やRT-PCR法などの既存の検査法との比較による感度・特異度は、融合遺伝子関連の構造異常、ITD/PTDいずれもすべて100%であり、本遺伝子パネル検査により正確に検出することが可能であることが示されました。
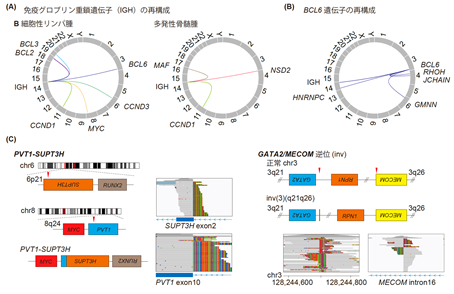
図3 活性型構造異常の検出
(A)免疫グロブリン遺伝子(IGH)再構成におけるパートナー遺伝子
(B)BCL6遺伝子再構成におけるパートナー遺伝子
(C)稀な構造異常の検出
■血液がんにおける疾患別の遺伝子異常の頻度の比較
続いて血液がんの疾患ごとにどのような遺伝子異常が高頻度に検出されたかを解析しました。疾患ごとにドライバー遺伝子のうちわけは大きく異なっていますが、それぞれの疾患ごとに特徴的な遺伝子を検出しました(図4)。また、それぞれの疾患でドライバー遺伝子が今までの報告と同等の頻度で検出されており、本遺伝子パネル検査が血液がん全般に対応していることが実際の検体を用いて示されました。
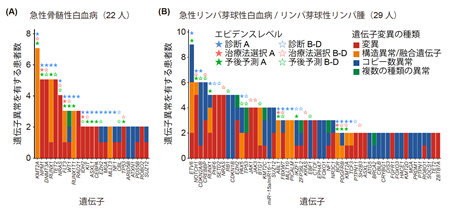
図4 血液がんの疾患ごとに高頻度に検出された遺伝子異常
急性骨髄性白血病(A)と
急性リンパ芽球性白血病/リンパ芽球性リンパ腫(B)の例
■生殖細胞系列の遺伝子異常の検出
生殖細胞系列の遺伝子異常は6人(3%)の患者で検出されました。そのうちの5人は遺伝性乳がんや卵巣がんの発症に関わるBRCA1/BRCA2の異常であり、うち3人は確認検査でも陽性が確認されました。また1人の急性骨髄性白血病(AML)患者はDDX41の生殖細胞系列の遺伝子異常を有しており、遺伝性血液がんであるDDX41遺伝子異常を有する骨髄系腫瘍に再分類されました。これらの結果から、本遺伝子パネル検査は生殖細胞系列の異常も十分に検出可能なことが示されました。
■診断、治療法選択、予後予測に関する有用性の検証
検出された遺伝子異常が臨床的に有用であるか、血液がんの疾患ごとに評価しました。造血器腫瘍ゲノム検査ガイドラインに基づいた評価により、診断、治療法選択、予後予測に有用な遺伝子異常が、それぞれ82%、49%、58%の患者で検出されました(図5)。また特に有用性が高い(A-B評価)と考えられる遺伝子異常はそれぞれ76%、12%、44%の患者に検出され、本遺伝子パネル検査は特に診断、次いで予後予測に有用であることが示されました。
急性骨髄性白血病(AML)では発症時の染色体異常・遺伝子異常によってリスク分類がなされ、それをもとに同種移植の適応が決定されます。本遺伝子パネル検査により、約01月03日の患者でリスク分類の変更がなされました。このことは急性骨髄性白血病(AML)においては本遺伝子パネル検査によってより適切な治療が提供可能になることが示されています。また、急性リンパ性白血病(ALL)においても、これまで診断が困難だったフィラデルフィア染色体様急性リンパ性白血病(ALL)であることを示すETV6-ABL1やATF7IP-PDGFRB融合遺伝子が検出されました。これらのフィラデルフィア染色体様急性リンパ性白血病(ALL)は予後不良というだけではなく、それぞれの融合遺伝子が治療標的として期待されています。このように遺伝子パネル検査による包括的ゲノムプロファイリングは発症時の白血病においても有用であることが示唆されます。
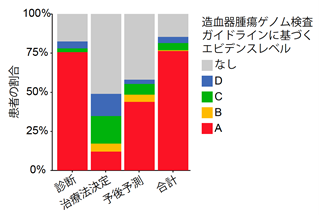
図5 臨床的な有用性(エビデンス)のある遺伝子異常を有する患者の割合
展望
現在、大塚製薬は、本遺伝子パネル検査が臨床現場で使用可能となることを目指して、承認申請の準備を進めています。本研究で得られた知見は日本における血液がん遺伝子パネル検査の普及およびプレシジョンメディシンの基盤となることが期待されます。我々は、今後もゲノム解析の技術革新を図り、また新薬開発を含め臨床研究を推進していくことで血液がんの治療成績向上に寄与できるよう取り組んでまいります。
発表論文
雑誌名
Cancer Science
タイトル
Feasibility and clinical utility of comprehensive genomic profiling of hematological malignancies.
著者
福原 傑、熊手(押川) 祐二、木暮 泰寛、新垣 清登、假屋園 大和、菊川 誉也、古屋 淳史、斎藤 優樹、田畑 真梨子、吉藤 康太、水野 洸太、前島(宮城) 亜希子、松下 弘道、杉山 正仲、小川 千登世、稲本 賢弘、福田 隆浩、菅野 雅人、山内 寛彦、南 陽介、平田 真、吉田 輝彦、河野 隆志、高阪 真路、間野 博行、白石 友一、小川 誠司、伊豆津 宏二、片岡 圭亮
掲載日
2022年6月17日
DOI番号
10.1111/cas.15427
URL
https://doi.org/10.1111/cas.15427(外部サイトにリンクします)
研究費
-
- 国立がん研究センター研究開発費
造血器腫瘍における個別化医療の実現を目指した遺伝子解析パネルの開発(30-A-1) - 大塚製薬との共同研究費
- 国立がん研究センター研究開発費
用語解説
(注1) 包括的ゲノムプロファイリング
主にがんの組織を用いて、1回の検査でがんに関連する多数(100以上)の遺伝子を同時に調べる検査のこと。がん遺伝子パネル検査は、包括的ゲノムプロファイリングに必要であり、がんゲノム医療を可能とする。
(注2) がんゲノム医療
がん細胞のゲノムを調べて、どの遺伝子に変化が起こっているのかを知り、それぞれの患者さんのがんがどのような性質のがんなのか、どのような治療法が適しているのかを選択する医療のこと。
(注3) 生殖細胞系列の異常
生まれつき持っている遺伝子に変化が起きていること。生まれ持った遺伝子の違いでがんになりやすい体質を持っている場合がある。がんになりやすい体質は遺伝性腫瘍として次の世代に受け継がれる可能性がある。
(注4) 変異
ゲノムDNAに生じる異常の一種で、1から十数塩基対程度の短い挿入・欠失や一塩基置換からなる。例:JAK2 p.V617F, NRAS p.G12Dなど
(注5) 融合遺伝子
がん細胞における構造異常により複数の遺伝子が連結されてできた異常遺伝子のこと。融合タンパクをコードするものが多い。例:BCR-ABL1, RUNX1-RUNX1T1など
(注6) 構造異常
ゲノムDNAに生じる異常のうち、長さが数十塩基対以上(典型的には数千から百万塩基対以上)のものや、染色体をまたいだ異常を指す。短い挿入・欠失や一塩基置換(変異)とは区別される。欠失、重複、逆位、転座に分類される。血液がんに特徴的な構造異常が多く知られている。例:FLT3-ITD, GATA2/MECOM, IGH/BCL2など
(注7) コピー数異常
正常では2コピー(父由来・母由来)あるゲノムDNAが、腫瘍において1コピー以下(欠失)、あるいは3コピー以上(増幅)となる異常。
(注8) 体細胞異常
生まれつきではなく、人が生きていく過程の中で一部の細胞で生じる遺伝子の変化。がん領域では、がん細胞で起きている遺伝子の変化のことを指す。通常、体細胞異常が積み重なることでがんが発症するため、がんの性質に関わり、治療の標的となりうる。次の世代に引き継がれることはない。
(注9) DNAパネル
DNAを試料として用いるがん遺伝子パネルのこと。検査の対象となるがん関連遺伝子のセットのことを「パネル」と呼ぶ。血液がんに特徴的な様々な種類の遺伝子異常(変異、構造異常、コピー数異常)を検出することができるように設計されている。
(注10) RNAパネル
RNAを使って解析するがん遺伝子パネルのこと。血液がんに特徴的な融合遺伝子はDNAパネルでは検出が難しいが、RNAパネルを用いると効率的に検出することができる。そのため、DNAパネルとRNAパネルを同時に解析することで血液がんの遺伝子異常を包括的に検査することができる。
(注11) 造血器腫瘍ゲノム検査ガイドライン
血液がんに対する包括的ゲノムプロファイリングが普及、実施される際の指針として日本血液学会が定めたガイドラインであり、定期的に情報の更新が行われている。新規に発見されたものも含め、血液がんの臨床上有用性が高いと思われるドライバー遺伝子異常がほぼ全て記載されている。血液がんの疾患ごとにその遺伝子異常の診断、治療法選択、および予後予測に関する有用性を評価してエビデンスレベル(A-D)が定められている。有用なバイオマーカーとしてガイドラインや大規模な臨床試験で証明されている、特に有用性が高いと考えられる遺伝子異常には高いエビデンスレベル(A-B)が付与される。
(注12) Genomonパイプライン
次世代シーケンスデータから、変異・構造異常・融合遺伝子検出を行うためのプログラムの集合体である。東京大学医科学研究所ヒトゲノム解析センター 宮野悟教授(当時)、白石友一助教(当時)らによって開発され、多くの実績を挙げている(https://github.com/Genomon-Project/)。
報道関係からのお問い合わせ先
国立がん研究センター 企画戦略局 広報企画室