2022-08-09 理化学研究所,近畿大学,東京大学
理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの笹川翔太研究員、中川英刀チームリーダー、近畿大学医学部外科学教室上部消化管部門の安田卓司主任教授、東京大学医学部附属病院22世紀医療センター免疫細胞治療学講座の垣見和宏特任教授らの共同研究グループは、食道がんの全ゲノムおよびRNA発現データから腫瘍ゲノムのコピー数異常[1]と腫瘍内の免疫動態を解析し、人工知能(AI)[2]を実現するための手法である機械学習[2]を用いて、術前化学療法の効果を予測することに成功しました。
本研究成果は、事前にがん化学療法の効果を予測するがん精密医療や、新しいがん免疫療法の開発に貢献すると期待できます。
今回、共同研究グループは、化学療法開始前に採取した141例の食道がん組織の全ゲノムシークエンス解析[3]およびRNAシークエンス解析[3]を行い、化学療法の効果との関連性を調べました。その結果、がん細胞のコピー数異常や腫瘍内の免疫細胞の動態が化学療法の効果と関連することが分かりました。さらに、喫煙などの臨床情報と免疫・ゲノム情報を統合し、機械学習によって化学療法の効果を予測するアルゴリズムを開発し、その高い診断精度を確認しました。また、マウス腫瘍モデルを用いて、化学療法の効果と最も強い関連が認められた免疫細胞の好中球[4]を除去すると、化学療法の効果が向上することも証明しました。
本研究は、医学系雑誌『Cell Reports Medicine』オンライン版(8月8日付:日本時間8月9日)に掲載されました。
背景
食道がんは、日本では年間に約26,000人が発症し、約11,000人が死亡、5年相対生存率は約40%の難治性がんです注)。病理学的には、扁平上皮がんと腺がんに分類されます。日本を含むアジアでは、ほとんどが扁平上皮がんで、その最大のリスク要因は喫煙や飲酒です。
日本における食道扁平上皮がんの標準治療は、複数の薬剤を組み合わせた化学療法[5]の後に切除手術を行う「術前化学療法+手術」です。食道がんは極めて進行が早く、全身の広範囲に転移を伴うことが多い悪性度の高い腫瘍で、術前から潜んでいるとされる全身の微小転移をどれだけ制御できたかが予後を大きく左右します。しかし、化学療法の効果は40~60%で、化学療法だけでがんが完全治癒・消失することもまれにはありますが、その効果は治療開始前に予測できません。そのため、2~3カ月にわたる術前治療期間中に効果が見られず、腫瘍が増大した場合は切除手術の機会を失うこともあり得ます。従って、化学療法の効果を事前に予測することが臨床上重要であり、これまでさまざまな情報を基にした予測が試みられてきました。しかし、予測の精度は高くなく、再現性も乏しいため、医療実装はなされていません。
一方、食道扁平上皮がんの全ゲノムの構造は既に解明されており、食道がんにおける腫瘍免疫[6]の重要性や免疫療法[6]の効果も報告されています。そして、乳がんや卵巣がんなどでは、ゲノム変異情報や腫瘍内での免疫細胞の働きに関する情報を組み合わせて、術前治療の効果予測が行われています。
そこで本研究では、食道扁平上皮がんのゲノム変異情報や、遺伝子発現から推測した免疫細胞の働きから、化学療法の効果を予測するアルゴリズムの開発を試みました。
研究手法と成果
まず、共同研究グループは、近畿大学病院において化学療法開始前に採取した121例の食道扁平上皮がん細胞の全ゲノムシークエンス解析を行い、がん細胞の遺伝子変異に関する網羅的な情報を取得しました。さらに、このデータと実際の化学療法の効果との関連を調べました。
食道扁平上皮がんで最も多い変異はTP53遺伝子(がん抑制遺伝子)の変異ですが、その有無と化学療法の効果には関連が見られませんでした。がん細胞で起こる遺伝子変異のパターンである変異シグニチャー[7]を調べたところ、喫煙によって起こる変異パターン(SBS29)との関連が見られ、喫煙量が多いと化学療法の効果が下がりました。がんのコピー数異常では、食道がんに多く観察されるがん関連遺伝子(CCND1、TP63/SOX2、FGFR1、CDKN2A)が位置する比較的小さな領域のコピー数異常と化学療法の効果には関連が見られませんでしたが、9番染色体短腕や12番染色体長腕などの大きな領域のコピー数異常には、化学療法の効果との関連が見られました。これらの領域には、NF-κBシグナルなどの炎症関連遺伝子が位置していることから、免疫との関連が考えられました。さらに、がん細胞で起きるコピー数異常のパターン(コピー数シグニチャー[8])を解析したところ、コピー数シグニチャーと化学療法の効果に有意な関連が見られました。
また、がん細胞に対する免疫細胞の働きを遺伝子発現の程度から推測し、化学療法の効果との関連を調べるため、121例の食道がん組織のRNA発現解析データを得て、がん組織内に浸潤した免疫細胞の活動性についても解析を行いました。このデータに対して、遺伝子発現の傾向を調べるためにGSEA[9]という解析を行ったところ、IFN-γなどのさまざまな炎症関連の遺伝子群の活性、つまりパスウェイ(遺伝子間の連続的な機能的連関)活性が、化学療法の効果が高い群で上昇していました。さらに詳細に免疫細胞の発現を見ると、食道がん組織に浸潤している免疫細胞に着目し、好中球、B細胞[4]、CD8+T細胞[4]、CD4+T細胞[4]がそれぞれ多く発現する四つの群に分類できました(図1上)。注目すべきことに、好中球の多い群では他の群に比べて化学療法の効果が低く、好中球が化学療法の効果と機能的に関連していると考えられました(図1下)。
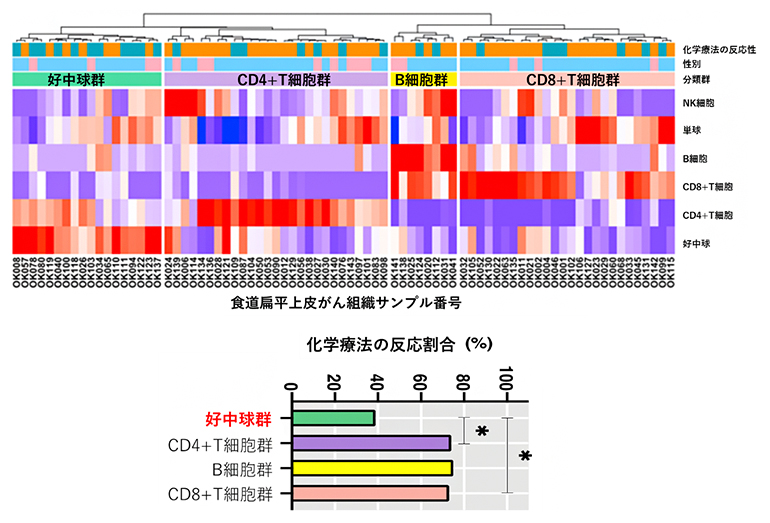
図1 食道がんの免疫分類
(上)食道がん組織のRNA発現データから免疫細胞の発現データを抽出して、四つの分類群(好中球が多い群、CD4+T細胞が多い群、B細胞が多い群、CD8+T細胞が多い群)を作成した。各細胞の色は赤いほど高発現、青いほど低発現であることを示す。
(下)好中球が多い群だけが、化学療法の反応性が低かった。
そこで、免疫機構が保たれたマウス扁平上皮がんモデルを作製し、好中球を除去すると化学療法の効果が大きく向上し、腫瘍の増殖が抑制されることを証明しました(図2)。
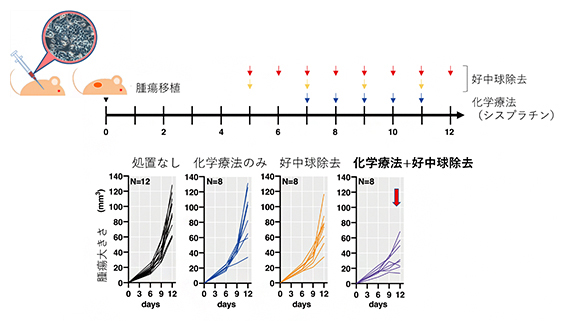
図2 マウス腫瘍モデルでの好中球除去と化学療法の相乗効果
(上)免疫機能が正常なマウスに扁平上皮がん細胞を移植し、シスプラチンを用いた化学療法(青矢印)または好中球に特異的な抗体による好中球除去療法(赤矢印と黄矢印による二つの操作)を行い、腫瘍の大きさを観察した。
(下)化学療法と好中球除去療法を併用した場合、腫瘍の増殖が大きく抑制された(右グラフ)。
次に、121例のゲノム変異情報と腫瘍免疫情報に、喫煙量、年齢、性別などの臨床情報を加えた、81項目の個々の症例の情報を統合し、機械学習によって化学療法の効果を予測するアルゴリズムを開発しました(図3)。この手法により、化学療法の効果に最も寄与する因子は、腫瘍内への好中球の浸潤と腫瘍細胞のコピー数シグニチャーであることが分かりました。また、開発したアルゴリズムの診断精度を調べるために、121例のほかに新たな20の食道扁平上皮がん症例についても同様の解析を行いました。その結果、診断法の有用性を示すAUC[10]=0.8(1に近いほど精度が高い)の値が得られ、診断精度の再現性が確認できました。
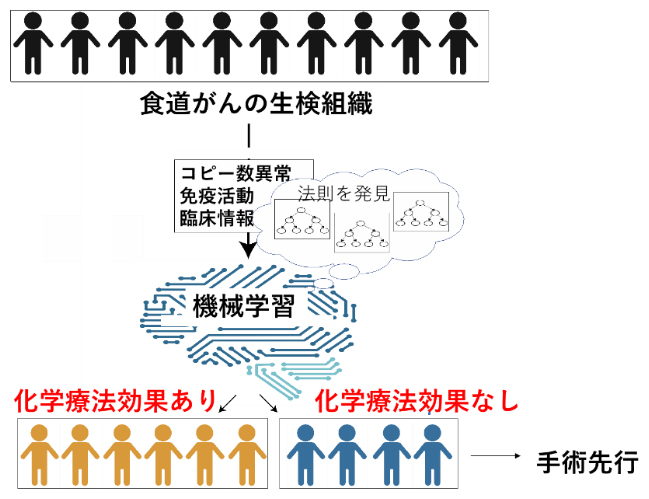
図3 ゲノム情報を用いた化学療法の効果予測
食道がん組織の全ゲノムシークエンスとRNAシークエンスにより、コピー数異常と腫瘍免疫の活動性を解析する。臨床情報も含めた機械学習により、化学療法の効果を事前に予測して層別化し、効果が期待できない患者については手術療法を先行する。
今後の期待
本研究により、食道扁平上皮がん組織のゲノム情報、免疫情報、性別・生活習慣などのさまざまな情報を組み合わせることで、食道がんの化学療法の効果予測が可能であることが証明されました。この研究手法は、食道がんのみならず他の腫瘍の化学療法の効果予測や精密医療にも応用できる可能性があります。臨床的には、術前化学療法の効果が期待できないと事前に診断できた症例は、手術療法を先行することができます。
また、化学療法の効果に、腫瘍免疫が密接に関連することが分かりました。食道がんに対する免疫細胞の活動についてさらに詳細な研究を進めることで、化学療法と免疫チェックポイント阻害剤[11]の併用療法、または新しい複合免疫治療の開発が期待できます。
補足説明
1.コピー数異常
正常な体細胞には同じ染色体が二つ(2コピー)あるが、がん細胞では、部分的にまたは染色体そのものが欠失したり、数コピーに増幅したりする。これをコピー数異常と呼ぶ。欠失した領域にはがん抑制遺伝子が、増幅した領域にはがん遺伝子が存在すると考えられている。
2.人工知能(AI)、機械学習
人工知能とは、機械に人間と同様の知能を実現させようとする取り組みやその技術を指す。機械学習は人工知能に内包されるもので、機械(コンピューター)が膨大なデータを自動で学習し、データの背景にあるルールやパターンを発見する手法。今回は、ランダムフォレストというディシジョンツリー(決定木)に基づいたアルゴリズムを用いており、重複を許すランダムサンプリングによって多数のディシジョンツリーを作成し、各ツリーの予測結果の多数決を採ることで最終予測値を決定する。
3.全ゲノムシークエンス解析、RNAシークエンス解析
個人やがん細胞の全ゲノム情報を解読し、塩基配列の違いや変化を同定することを全ゲノムシークエンス解析という。がん細胞の場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。RNAも、cDNA(相補的DNA)に変換した後に、RNAのほぼ全長にわたってシークエンス解析ができる。RNAシークエンス解析によって、遺伝子の発現の有無などを調べることができる。
4.好中球、B細胞、CD8+T細胞、CD4+T細胞
免疫に関わる白血球は、B細胞、T細胞、マクロファージ、好中球、好酸球、好塩基球などに分類される。B細胞は、異物に対する抗体を産出する。T細胞のうち、CD8+T細胞は腫瘍や感染細胞に直接的に作用する(細胞障害性T細胞)。CD4+T細胞はマクロファージなどから抗原提示を受けると増殖、活性化して、炎症を促すサイトカインを産出し、他の免疫細胞を活性化させる(ヘルパーT細胞)。好中球は強い貪食(どんしょく)能力を持ち、病原体を貪食する。さらには顆粒やサイトカインの放出によって感染部位へ他の免疫細胞を動員し、免疫応答を促進する。
5.複数の薬剤を組み合わせた化学療法
食道がんの場合、シスプラチンを代表とするプラチナ製剤と5-FU系(一般名フルオロラウシル)を含む、複数の細胞障害性抗がん剤の投与治療が、術前、術後、そして再発時に行われる。近年は、シスプラチン、5-FUにドセタキセルというタキサン系の抗がん剤を加えた強力な3剤併用化学療法が行われ、その有用性が臨床試験で明らかになった。それを受けて2022年2月、日本食道学会ガイドライン委員会より、切除可能進行食道がんの治療に際してはこのDCF3剤併用術前化学療法を行うことを強く推奨するとの速報コメントが発表された。
6.腫瘍免疫、免疫療法
腫瘍が生体内で異物として認識され、それを排除するように免疫細胞が反応することを腫瘍免疫という。この仕組みを生かし、がんを攻撃する免疫細胞を活性化させることによってがんの治療を試みる治療法を免疫療法という。
7.変異シグニチャー
がん細胞に発生するさまざまな変異は、その要因によって異なるパターンを示す。そのパターンを変異シグニチャーと呼ぶ。がん細胞の変異の一種である塩基置換は、DNAを構成する核酸塩基(A、T、C、G)の化学反応によって起こる。塩基置換のパターンや数は、DNAと反応する遺伝子毒性を持つ発がん物質の暴露と、変異を修復するための細胞内機構の適切な働きの有無によって決定される。喫煙による肺がんや紫外線による悪性黒色腫における塩基置換は、他のがんに比べて10倍以上多く、CがTに置き換わる(その相補としてGがAに置き換わる)パターンが非常に多くなる。
8.コピー数シグニチャー
コピー数異常のある領域の大きさや、コピー数異常の構造の特徴などの情報を組み合わせ、そのパターンを特徴化したもの。DNAへのダメージやその修復機構の有無、細胞周期異常と関連する10~20個のコピー数シグニチャーが報告されている。
9.GSEA
GSEAは、2群間で遺伝子発現が異なる遺伝子が特定の遺伝子セット(IFN-γに関わる遺伝子セットなど)に偏っているかどうかを調べる解析法。GSEAはGene Set Enrichment Analysisの略。
10.AUC
診断法がどのくらい有用なのかを解析する統計学的な手法であるROC曲線(Receiver Operatorating Characteristic curve)を作成したときに、グラフの曲線より下の部分の面積をAUCという。AUCは0から1までの値をとり、値が1に近いほど判別能が高いことを示す。AUCはArea under the curveの略。
11.免疫チェックポイント阻害剤
免疫のチェックポイントであるPD-1分子を抗体で抑制することで、腫瘍細胞への免疫抑制を解除し、免疫細胞が腫瘍細胞を排除できるように導く薬剤。
共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(カナガワ・ヒデワキ)
近畿大学医学部 外科学教室 上部消化管部門
主任教授 安田 卓司(ヤスダ・タクシ)
医学部講師 加藤 寛章(カトウ・ヒロアキ)
東京大学医学部附属病院 22世紀医療センター 免疫細胞治療学講座
特任教授 垣見 和宏(カキミ・カズヒロ)
特任講師 長岡 孝治(ナガオカ・コウジ)
研究支援
本研究は、日本医療研究開発機構次世代がん医療創生研究事業研究領域E「がんゲノム解析による新規免疫療法および複合免疫療法開発のためのシーズ探索(研究代表者:中川英刀)」による支援を受けて行われました。
原論文情報
Shota Sasagawa, Hiroaki Kato, Koji Nagaoka, Changbo Sun, Motohiro Imano, Takao Sato, Todd A. Johnson, Masashi Fujita, Kazuhiro Maejima, Yuki Okawa, Kazuhiro Kakimi, Takushi Yasuda, and Hidewaki Nakagawa, “Immuno-genomic Profiling of Biopsy Specimens Predicts Neoadjuvant Chemotherapy Response in Esophageal Squamous Cell Carcinoma”, Cell Reports Medicine, 10.1016/j.xcrm.2022.100705
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
近畿大学医学部 外科学教室 上部消化管部門
主任教授 安田 卓司(ヤスダ・タクシ)
東京大学医学部附属病院 22世紀医療センター 免疫細胞治療学講座
特任教授 垣見 和宏(カキミ・カズヒロ)
報道担当
理化学研究所 広報室 報道担当
近畿大学医学部・病院運営本部 総務広報課 担当:南川・石井
東京大学医学部附属病院
パブリック・リレーションセンター(担当:渡部、小岩井)