2023-03-07 東京大学医科学研究所
発表のポイント
- クライオ電子顕微鏡を用いて衝突リボソーム解消複合体(RQT複合体)と衝突リボソームの可視化に成功しました。
- RQT複合体がmRNAに引っ張り力を加え、リボソームの小さなサブユニットの構造変化を不安定化させ、最終的にサブユニットを解離させることを世界で初めて明らかにしました。
- 本成果は、品質管理機構の破綻が原因とされる神経変性疾患などの発症機序の理解や新規治療戦略の開発につながることが期待されます。
発表概要
東京大学 医科学研究所RNA制御学分野/大学院理学系研究科生物科学専攻/大学院新領域創成科学研究科メディカル情報生命専攻の稲田利文教授と東京大学 医科学研究所RNA制御学分野の松尾芳隆准教授、ミュンヘン大学Gene Centerの大学院生Katharina BestとRoland Beckmann教授のグループは、翻訳因子eIF5Aが非典型翻訳CATテイリング反応を促進することを世界で初めて解明しました。
翻訳停滞によってリボソームの交通渋滞が蓄積すると、細胞死や炎症応答さまざまなストレス応答が誘導されます。一方で過剰なストレス応答を防ぐために、細胞はリボソームの交通渋滞を解消する品質管理機構を備えています。品質管理因子であるHel2はリボソームの衝突(注1)を識別し、異常翻訳の目印としてユビキチンを付加します。このユビキチン化が目印となり、RQT(Ribosome Quality control Trigger) 複合体が停滞リボソームを強制的にサブユニット解離させることで交通渋滞を解消します。研究グループでは、これまで生化学的手法を用いて衝突リボソームにK63型のユビキチン鎖が形成され、それをRQT複合体が識別し、ATP 加水分解依存に衝突リボソームを解消することを発見しました。一方で、ATP加水分解依存に、衝突リボソームを各サブユニトに解離させる分子機構は十分に理解されていませんでした。
今回研究グループでは、クライオ電子顕微鏡(注2)を用いて衝突リボソーム解消複合体(RQT複合体)と衝突リボソームの可視化に成功しました。その結果、RQT複合体がmRNAに引っ張り力を加え、リボソームの小さなサブユニットの構造変化を不安定化させ、最終的にサブユニットを解離させることを、世界で初めて明らかにしました。
本成果は、品質管理機構の破綻が原因とされる神経変性疾患などの発症機序の理解や新規治療戦略の開発につながることが期待されます。
本研究成果は2月17日、米国科学誌「Nature Communications」に掲載されました。

発表内容
<研究の背景>
細胞内において一定の頻度で産生される異常なmRNA上をリボソームが翻訳すると、タンパク質の元となるペプチド鎖が正しく合成されず、細胞に悪影響を示します。しかし、我々の体に異常が見られないのは、翻訳品質管理機構が異常性を認識・解消しているからです。品質管理機構の一つであるRQC(Ribosome-associated Quality Control)は、リボソームの異常な翻訳停滞を認識し、合成途中の新生ペプチド鎖の分解を誘導することが知られています(図1)。最近では、神経疾患患者においてRQC関連因子の異常が複数確認されています。

図1 翻訳品質管理機構RQCの分子機構
異常翻訳による衝突リボソームの形成、②衝突リボソームセンサーHel2による衝突リボソームの認識と、リボソームタンパク質uS10のK63型ポリユビキチン化、③RQT(RQC-Trigger)複合体によるリボソームのサブユニット解離、④60Sサブユニットに結合したLTN1による新生ペプチド鎖のユビキチン化、⑤プロテアソーム系による異常タンパク質の分解、⑥LTN1機能欠損下では、特殊なタグ配列(CAT-tail)がNEMFによって異常タンパク質のC末端に付加されることで、凝集もしくは分解を起こす、という分子機構が明らかになっています。
RQCのセンサータンパク質であるHel2は、異常翻訳の実体である衝突リボソームを認識し、翻訳異常の目印として停滞リボソームにユビキチン(注3)を付加します(図1)。ユビキチン化されたリボソームは、RQT(Ribosome Quality control Trigger)複合体に認識され、強制的なサブユニット解離が誘導されます(図1)。その後、途中まで合成された新生ペプチド鎖はユビキチン-プロテアソーム系(注4)によって分解されます(図1)。近年、衝突リボソームの蓄積がHel2とは異なるセンサータンパク質によって認識され、アポトーシス(注5)や自己免疫応答(注6)などのさまざまな細胞応答を誘導・促進します。そのため、リボソームの交通渋滞を解消する品質管理機構は、不良タンパク質の産生を防ぐだけでなく、過剰なストレス応答を抑える役目を担っています。一方で、品質管理機構の誘導起点となる停滞リボソームを解消する分子機構には不明な点が多く残されていました。
<研究の内容>
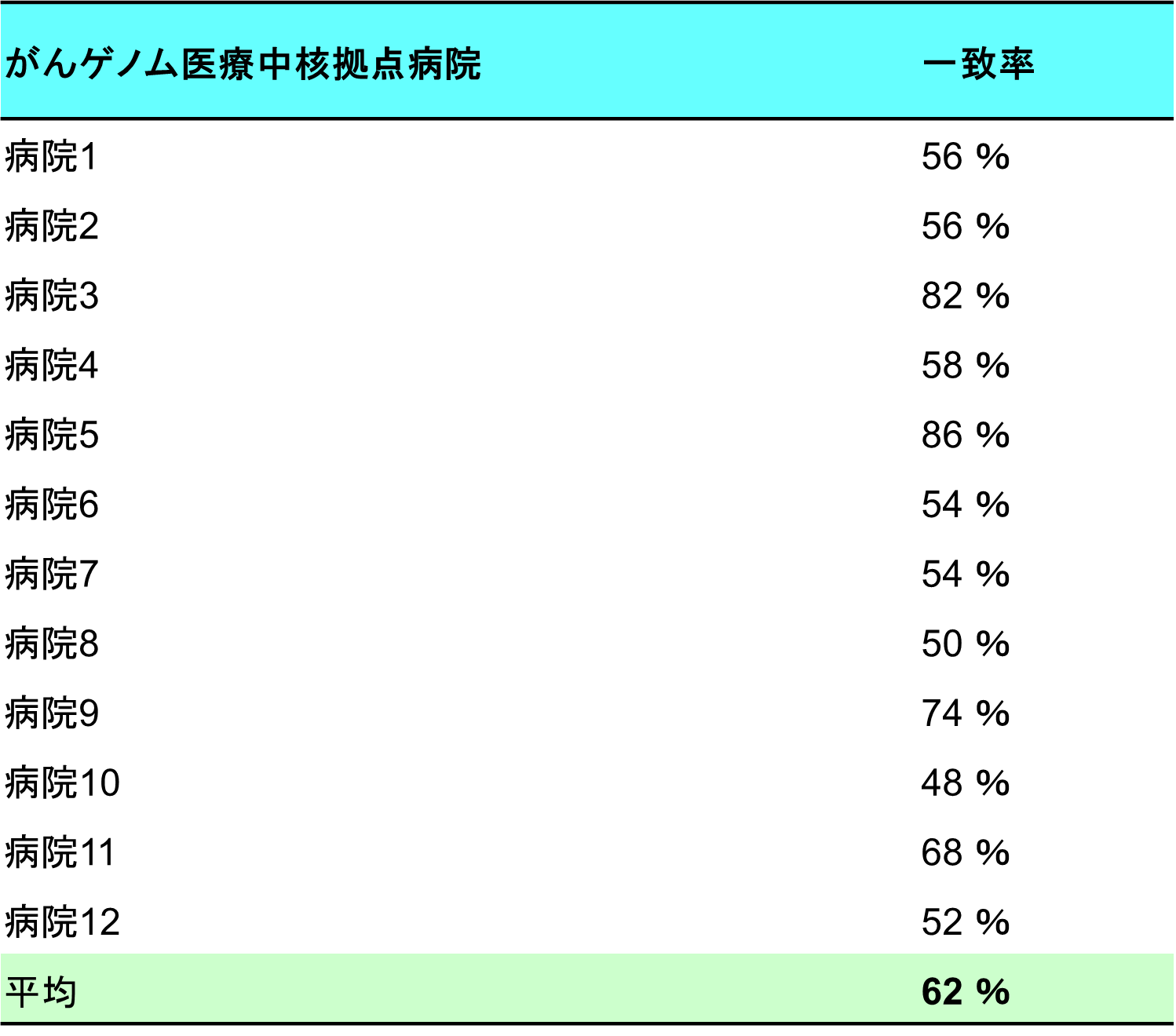
本研究では、試験管内で翻訳停滞によるリボソームの衝突と衝突リボソームのユビキチン鎖の付加を再現しました。さらに、衝突リボソームに結合したRQT複合体の構造を明らかにしました。RQTが先頭の停滞したリボソームの 40S サブユニットに結合し、2つの構造(C1状態とC2状態)を切り替えることが明らかになりました(図2)。

図2 衝突リボソームとRQT複合体の2つ構造と構造間の遷移モデル
(A) RQT-80S複合体のC1状態とC2状態の比較。(左)C1内の破線は、40S ヘッドの位置を示しています。C2内の破線は、40Sサブユニトの旋回運動の回転方向と結果として得られる正味の回転角度を示します。(右) Slh1が結合した80S複合体(C1とC2)を比較した模式図。(B)mRNA 侵入部位上の Slh1 ヘリカーゼ カセットの相対位置に焦点を当てた拡大図。矢印は、3′-5-ヘリカーゼであるSlh1によって mRNA が引っ張られる方向を示します。NTC、CTC = Slh1のN末端およびC末端ATP加水分解カセット領域。
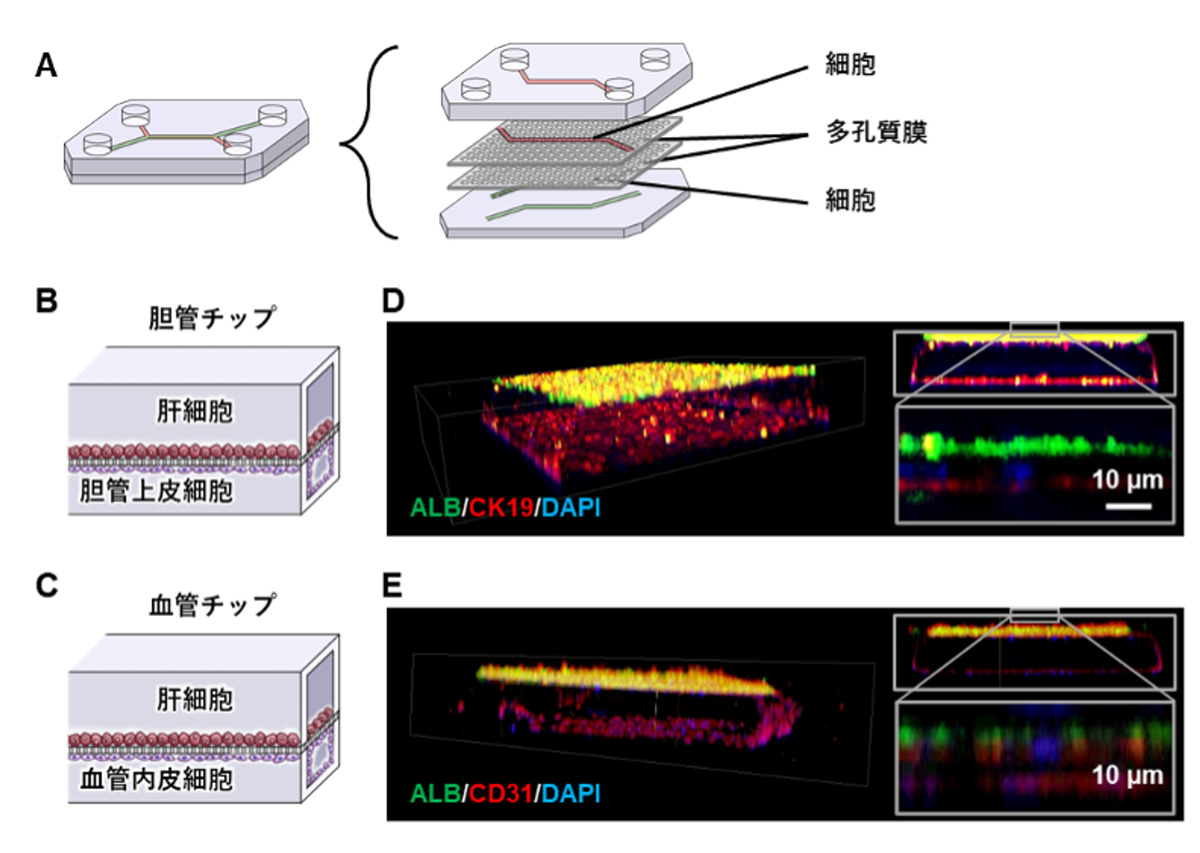
C1からC2への遷移は、転位反応における40Sの動きと逆になっており、この動きが、RQT依存の解離メカニズムの鍵となる可能性が考えられます。ATPase欠損変異Slh1を含むRQT複合体や、3’側にはみ出したmRNAを欠く衝突リボソームでは、RQTによる衝突リボソームの解離反応が起きず、C2状態も存在しませんでした。このことから、C2状態を獲得するには、mRNAに対するATP依存性ヘリカーゼ活性が発生する必要があり、この状態への移行は先頭の停止リボソームの解離反応に重要であると結論しました。これらの結果から、RQTのSki2様ヘリカーゼ1(Slh1)サブユニットがmRNAに引っ張り力を加え、リボソームの小さなサブユニットの構造変化を不安定化させ、最終的にサブユニットの解離を引き起こすことを提案します(図3)。

図3 RQT を介した衝突リボソームの解離モデル
後続のリボソームの失速とその後の衝突の後、Hel2は衝突界面を認識し、uS10をユビキチン化します。 RQT は、ポリユビキチン化された先頭の停滞リボソームに結合し、停滞リボソームから出てくるアクセス可能な 3′-mRNA に結合します。 mRNAを引っ張る力 (青い矢印) は、停滞リボソームの40Sサブユニットの頭部領域の回転と不安定化を引き起こします。最終的に先頭の停滞リボソームのサブユニット間のくさびとして機能するように、後続のリボソームを駆動する可能性があります。赤い十字は、異常mRNA(青)による翻訳停滞を示します。緑の円はユビキチンを示します。
<社会的意義・今後の予定>
品質管理機構RQCに関与する因子の欠損や機能不全が、ALSを含む神経変性疾患などのさまざまな疾患の原因になることが報告されています。本成果は、品質管理機構の破綻が原因とされる神経変性疾患などの発症機序の理解や新規治療戦略の開発につながることが期待されます。
発表者
東京大学大学院医科学研究所
稲田 利文(教授)<基礎医科学部門RNA制御学分野/大学院理学系研究科生物科学専攻/
大学院新領域創成科学研究科メディカル情報生命専攻 RNA制御学分野>
ドイツミュンヘン大学Gene Center
Roland Beckmann(教授)
Katharina Best(博士課程大学院生)
論文情報
〈雑誌〉 「Nature Communications」(2月17日付けオンライン版)
〈題名〉Structural basis for clearing of ribosome collisions by the RQT complex
〈著者〉Katharina Best, Ken Ikeuchi, Lukas Kater, Daniel Best, Joanna Musial, Yoshitaka Matsuo, Otto Berninghausen, Thomas Becker, Toshifumi Inada* and Roland Beckmann*
*共同責任著者
〈DOI〉 doi.org/10.1038/s41467-023-36230-8
〈URL〉 https://doi.org/10.1038/s41467-023-36230-8
研究助成
本研究は、日本医療研究開発機構(AMED-CREST 課題番号:JP 20gm1110010、研究代表者:稲田利文)、日本学術振興会科学研究費助成事業(課題番号:19H05281,21H05277,22H00401、稲田利文;21H00267, 21H05710, 22H02606、松尾芳隆)、科学技術振興機構(JST)さきがけ(課題番号:JPMJPR21EE、研究代表者:松尾芳隆)などの支援を受けて行われました。
用語解説
(注1)リボソームの衝突(衝突リボソーム)
リボソームはmRNAの持つ遺伝情報に従ってアミノ酸同士を結合させ、タンパク質を合成する装置。タンパク質とRNAから構成される巨大な複合体である。先頭のリボソームが停滞し、後続のリボソームが衝突して衝突リボソームが形成されると、品質管理RQCの標的となる。
(注2)クライオ電子顕微鏡
液体窒素(-196℃)等により極低温に冷却された試料に対して電子線を照射し、試料を透過した電子線を検出することにより試料の観察を行う顕微鏡。
(注3)ユビキチン
ユビキチンは76アミノ酸からなる低分子タンパク質である。ユビキチンが他のタンパク質のリジン残基に共有結合で付加されると、タンパク質の活性を制御したりプロテアソームによって認識され分解されたりする。
(注4)ユビキチン-プロテアソーム系
異常なタンパク質にユビキチンを付加し、それを目印に分解する系。プロテアソームは複数のタンパク質が集合して出来る複合体でタンパク質をアミノ酸へ分解する装置である。
(注5)アポトーシス
多細胞生物の細胞で増殖制御機構として管理・調節された、能動的な細胞死のことを指し、プログラム細胞死とも呼ばれる。
(注6)自然免疫応答
病原体感染初期の感染防御を担う免疫機構。
問合せ先
〈研究に関する問合せ〉
東京大学医科学研究所 RNA制御学分野
教授 稲田 利文(いなだ としふみ)
〈報道に関する問合せ〉
東京大学医科学研究所 国際学術連携室(広報)