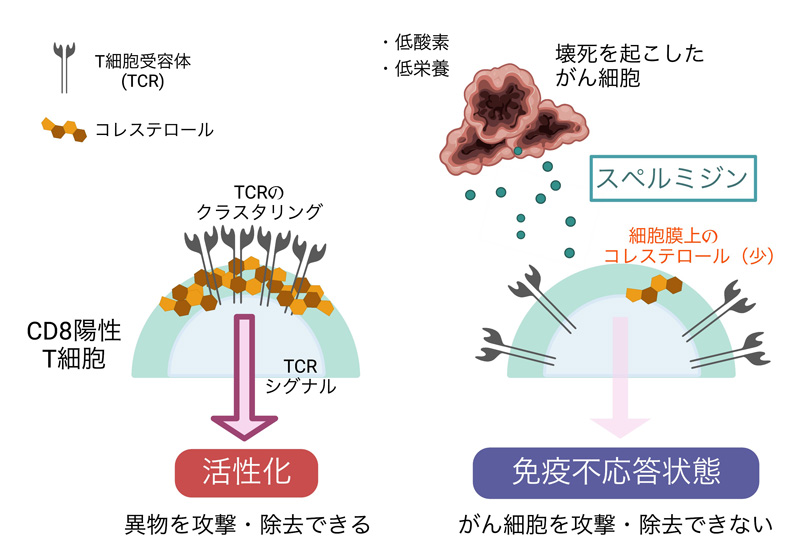
2023-06-07 京都大学 iPS細胞研究所
ポイント
- マウスを使った研究から、生体内に形成される異所性骨は、筋肉組織中に存在する間葉系間質細胞注1)から作られることが分かっていた。
- 今回の研究から、間葉系間質細胞は神経堤細胞注2)から作られることが示唆された。
- 発生上の起源細胞が分かったことで、今後、これまで以上に科学的に正確な異所性骨研究が可能となる。
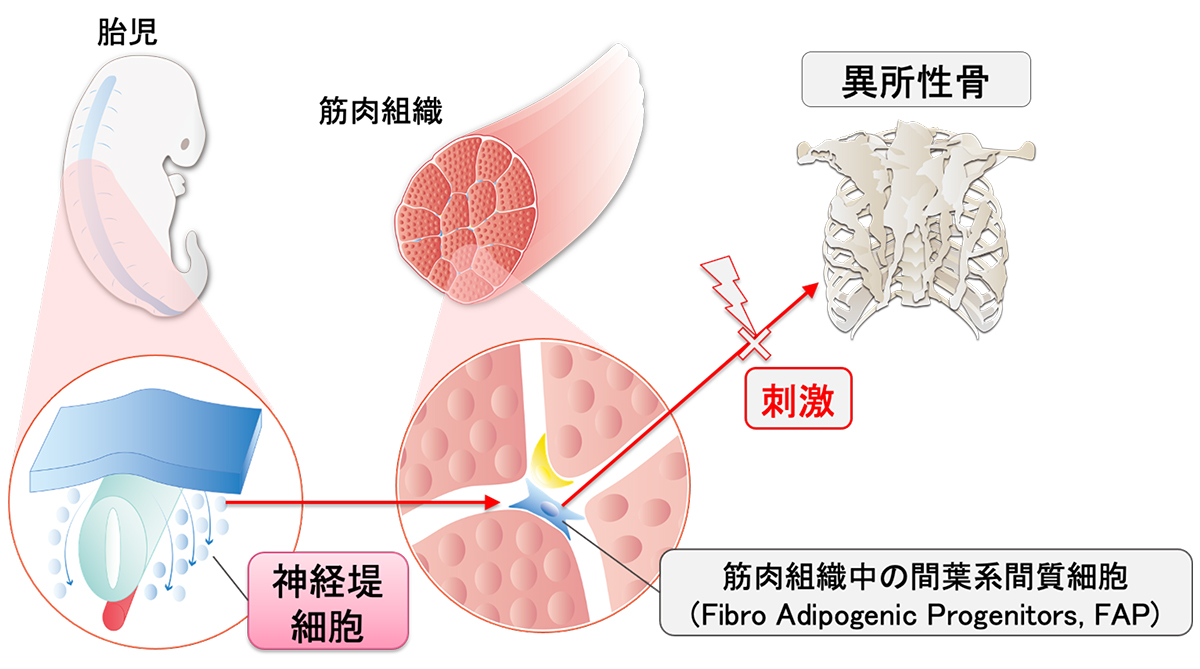
概念図 異所性骨の発生上の起源細胞は神経堤細胞である
1. 要旨
趙成珠研究員(CiRA臨床応用研究部門、現在は重慶医科大学生命科学研究所 准教授)および池谷真准教授(CiRA同部門)らの研究グループは、神経堤細胞という発生期に一時的に出現する細胞から異所性骨が作られることを示唆する研究成果を発表しました。この結果は、今後、iPS細胞を使った異所性骨研究に役立つと考えられます。
この論文は、2023年5月29日に「Genes & Diseases」に掲載されました。
2. 研究の背景
培養細胞を用いて病態を正確に知るためには、生体の中で病態の原因となる細胞、あるいはその細胞とよく似た性質の細胞を用いて病態を再現することが重要です。体のほぼ全ての細胞になることのできるiPS細胞を使って再現を行う場合には、受精卵から病態の原因となる細胞がどのように形成されるのかを知る必要があります。
異所性骨化という、本来、骨が形成されない組織(骨格筋や腱靭帯など)に異所的に骨が形成される疾患があります。異所性骨は、外傷や外科手術後に偶発的に形成される場合のほかに、希少難病注3)の一つである進行性骨化性線維異形成症(fibrodysplasia ossificans progressive、以下FOP)注4)のように、遺伝子の変異が原因となって体内に形成される場合があります。
マウスを用いた実験から、異所性骨は、筋肉細胞からではなく、筋肉組織中に存在する間葉系間質細胞から形成されることが知られていました。しかし、この間葉系間質細胞の元となる細胞(発生上の起源細胞)については明らかになっていませんでした。今回、研究グループは、この間葉系間質細胞が神経堤細胞から作られることを示しました。この研究成果は、今後、異所性骨研究を進めるうえで重要な科学的基盤となります。
3. 研究結果
1)BMP-7で誘導される異所性骨は神経堤細胞に由来する
はじめに、神経堤細胞の子孫細胞注5)をLacZ注6)で標識できるモデルマウス(P0-Cre; floxed-LacZレポーターマウスとWnt1-Cre; floxed-LacZレポーターマウス)(Fig. 1A)を作製しました。次に、骨誘導因子として知られているBMP-7タンパク質注7)をこれらのマウスに投与することで、異所性骨の形成を誘導しました。その結果、14日後に異所性骨が形成されました(Fig. 1B)。この異所性骨部分の組織を取り出してX-gal染色注8)(生体内のLacZを染色で検出する)を行なったところ、異所性骨がX-gal陽性であることが分かりました(Fig. 1C)。さらに免疫染色法によって、異所性骨の大部分が、骨芽細胞注9)マーカーであるSP7と、神経堤細胞の子孫細胞であることを示すLacZの両陽性の細胞であることを確認しました(81.28% ± 4.05)(Fig. 1D、E)。これらの結果から、BMP7で誘導される異所性骨は神経堤細胞から作られることが示唆されました。
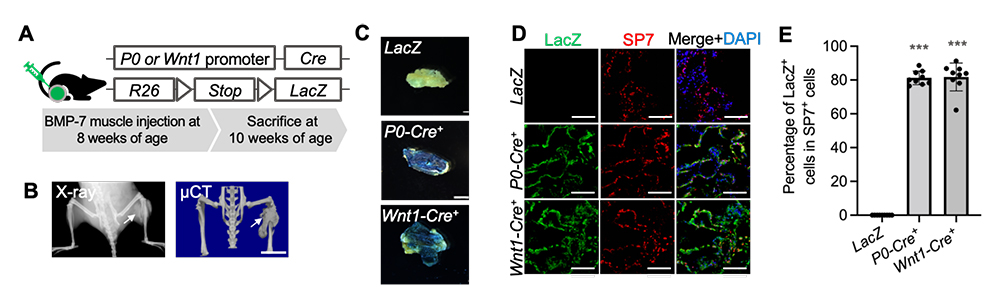 Fig. 1 BMP-7で誘導される異所性骨は神経堤細胞に由来する
Fig. 1 BMP-7で誘導される異所性骨は神経堤細胞に由来する
A. レポーターマウスの模式図とBMP-7タンパク質の投与スケジュール。
B. 異所性骨形成後のマウスのX線写真とµCT写真。
C. 異所性骨部分を取り出した後、X-gal染色した標本。
D. 異所性骨部分をLacZ抗体とSP7抗体で抗体染色した切片標本。
E. SP7陽性細胞中のLacZ陽性細胞の割合。
2)神経堤細胞にFOP変異をもつマウスは異所性骨を形成する
次に、希少難病であるFOPで形成される異所性骨においても、同様に神経堤細胞から形成されるかどうかを確かめました。まず、FOPの変異遺伝子注10)を神経堤細胞で発現するようにしたFOPモデルマウス(P0-CreマウスとRosa26-loxP-stop-loxP (LSL)-rtTA3マウスとCol1a1-tetO-FOP-ACVR1マウスを交配した多重変異マウス) を作製しました(Fig. 2A)。次に、FOPで異所性骨を誘引する刺激として知られるヘビ毒のカルディオトキシン注11)を投与したところ、異所性骨が誘導されました(Fig. 2B)。この異所性骨組織に対して、骨芽細胞マーカーであるSP7と、神経堤細胞の子孫細胞であることを示すVenus注12)(GFP抗体で検出可能)の免疫染色を行った結果、大部分の細胞が両陽性でした(79.13% ± 7.33)(Fig. 2C、D)。この結果から、神経堤細胞にFOP変異があると、FOP病態を発症することが分かりました。
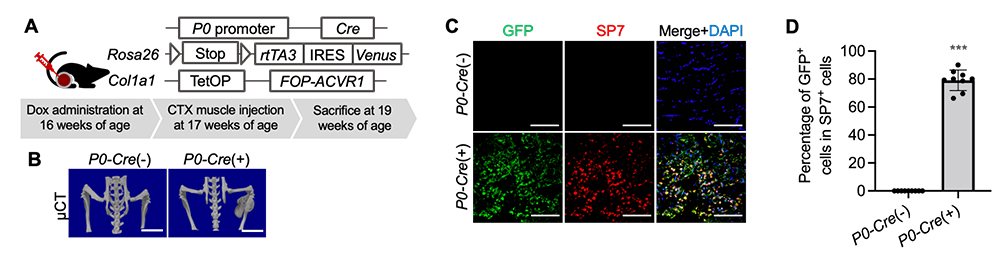
Fig. 2 神経堤細胞にFOP変異をもつマウスは異所性骨を形成する
A. 神経堤細胞でFOP変異遺伝子を発現するようにしたFOPモデルマウスの模式図と
カルディオトキシン(CTX)の投与スケジュール。
B. 異所性骨形成後のマウスのµCT写真。P0-Cre(+)がFOPモデルマウス、P0-Cre(-)が変異遺伝子をもたない対照マウス。
C. 異所性骨部分をGFP抗体とSP7抗体で抗体染色した切片標本。
D. SP7陽性細胞中のGFP陽性細胞の割合。
3)筋肉組織中に存在する間葉系間質細胞は神経堤細胞に由来する
これまでの研究から、筋肉組織に生じる異所性骨の起源は、筋肉細胞ではなく、筋肉組織に存在する間葉系間質細胞であることは示されていました。しかし、この間葉系間質細胞が神経堤細胞から作られるかどうかはこれまでに示されていませんでした。そこで、神経堤細胞の子孫細胞をLacZで標識することができるモデルマウス(P0-cre; floxed-LacZレポーターマウスとWnt1-cre; floxed-LacZレポーターマウス)(Fig. 1A)を用いて検証しました。間葉系間質細胞が存在する場所に免疫染色を行い、神経堤細胞の子孫細胞であることを示すLacZと、筋肉組織に存在する間葉系間質細胞のマーカーであるPDGFRαとCOL6を調べたところ、共染色される細胞が観察されました(Fig. 3A、B)。また、このマウスにBMP-7を注射し、 14 日後の組織を解析すると、増殖した細胞もLacZとPDGFRαを共発現していることが分かりました。また、神経堤細胞でFOPの変異遺伝子を発現するFOPモデルマウス(Fig. 2A)でも、神経堤の子孫細胞(GFP陽性)がPDGFRαを共発現していることが分かりました(Fig. 3C)。 このことから、神経堤細胞から筋肉組織中の間葉系間質細胞が作られ、これが異所性骨の原因細胞になることが示されました(概念図)。
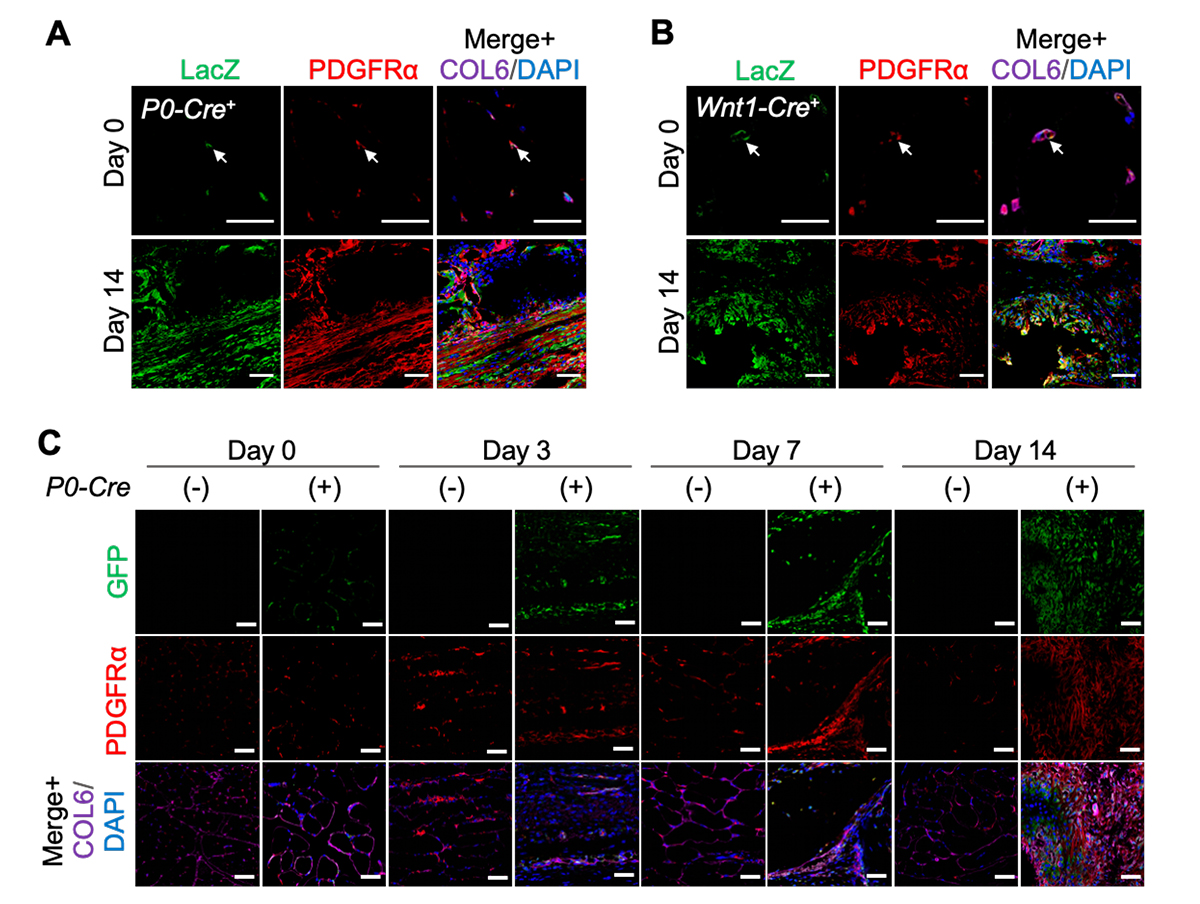 Fig. 3 筋肉組織中に存在する間葉系間質細胞は神経堤細胞に由来する
Fig. 3 筋肉組織中に存在する間葉系間質細胞は神経堤細胞に由来する
A. 神経堤細胞の子孫細胞をLacZで標識するモデルマウス(P0-Cre+)の筋肉組織を、筋肉組織中の間葉系間質細胞のマーカーであるPDGFRα抗体とCOL6抗体で染色した切片写真。異所性骨形成前(Day 0)と異所性骨形成後(Day 14)。
B. 神経堤細胞の子孫細胞をLacZで標識するモデルマウス(Wnt1-Cre+)の筋肉組織を、筋肉組織中の間葉系間質細胞のマーカーであるPDGFRα抗体とCOL6抗体で染色した切片写真。異所性骨形成前(Day 0)と異所性骨形成後(Day 14)。
C. 神経堤細胞でFOPの変異遺伝子を発現するFOPモデルマウス(P0-Cre (+))の筋肉組織を、筋肉組織中の間葉系間質細胞のマーカーであるPDGFRα抗体とCOL6抗体で染色した切片写真。GFP抗体は神経堤細胞の子孫細胞を標識するVenusタンパク質を検出する。異所性骨形成前(Day 0)と異所性骨形成期(Day 3、7)と異所性骨形成後(Day 14)。
4. まとめと今後の展望
今回、生体の異所性骨の原因細胞である筋肉組織中の間葉系間質細胞は、神経堤細胞の子孫細胞であることが示されました。これにより、iPS細胞から神経堤細胞を経由して作製した間葉系間質細胞を使って異所性骨を研究することは、科学的に適切であるということが示されました。この細胞に着目して研究をすることで、新しい治療法が開発される可能性があります。
また、筋肉組織内に存在する間葉系間質細胞は、筋肉の恒常性注13)や再生に寄与することが知られています。今回の研究グループの研究成果は、異所性骨化の研究だけでなく、間葉系間質細胞が原因で生じる骨格筋関連疾患の治療法開発にもつながる成果です。
5. 論文名と著者
- 論文名
Myelin protein zero (P0)- and Wnt1-Cre marked muscle resident neural crest-derived mesenchymal progenitor cells give rise to heterotopic ossification in mouse models - ジャーナル名
Genes & Diseases - 著者
Chengzhu Zhao1,2, Yoshiko Inada1, Kazuya Sekiguchi1,3, Kyosuke Hino1,4, Megumi Nishio1,
Yasuhiro Yamada5, Shuichi Matsuda3, Junya Toguchida1,3,6, Makoto Ikeya1*
*責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 重慶医科大学 生命科学研究所
- 京都大学 大学院医学研究科 整形外科学
- 住友ファーマ株式会社
- 東京大学 医科学研究所
- 京都大学 医生物学研究所
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本学術振興会 科研費(#16K15662, #19K16540, #21K06855)
- iPS細胞研究基金(200154400002)
- 日本医療研究開発機構(AMED)
「再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点」
「難治性疾患実用化研究事業」 - 鈴木謙三記念医科学応用研究財団
7. 用語説明
注1)筋肉組織中に存在する間葉系間質細胞
英語では”fibro-adipogenic progenitors(FAP)”(日本語に訳すと「線維脂肪生成前駆細胞」)と呼ばれる。間葉系幹細胞(mesenchymal stem cells, MSC)とよく似た性質をもち、筋肉組織の恒常性維持機能の一部を担う。
注2)神経堤細胞
発生の途中で一時的に現れる細胞で、色素細胞、末梢神経、グリアなど、さまざまな細胞に分化する。第四の胚葉とも呼ばれる。
注3)希少疾患
患者数の少ない疾患の総称。希少難病、稀少疾患ともいう。対義語はコモンディジーズ。
注4)進行性骨化性線維異形成症
英語では”fibrodysplasia ossificans progressive(FOP)”と呼ばれる。筋肉や腱、靭帯などの軟部組織の中に異所性骨とよばれる骨組織が形成される病気で、200万人に1人程度の割合、本邦内には約80名の患者さんがいるといわれている希少難病の一つである。これまでの研究により、この病気は骨形成をつかさどる増殖因子であるBMP注6)の受容体の一つであるACVR1遺伝子に突然変異が生じて変異型ACVR1(FOP-ACVR1)へと変化し、BMPシグナルを過剰に伝えることで異所性骨が誘導されることが分かっている。
注5)子孫細胞
ある細胞から分裂してできた細胞のこと。系譜細胞ともいう。ヒトの全ての細胞は、受精卵の子孫細胞である。
注6)LacZ
大腸菌の遺伝子の一つ。翻訳産物はβ-ガラクトシダーゼと呼ばれる加水分解酵素。基質であるX-galを加えると、LacZが発現している細胞だけを青色に染めることができるため、古くからレポーター遺伝子の一つとして使用されている。
注7)BMP-7タンパク質
骨形成を誘導する分泌性シグナル伝達分子ファミリーであるBMP(骨形成タンパク質、Bone morphogenetic protein)タンパク質の一つ。BMP-7は、OP-1(osteogenic protein-1、骨形成タンパク質1)としても知られる。
注8)X-gal染色
β-ガラクトシダーゼの基質の一つで、加水分解されると青色になる。特定の細胞でLacZ遺伝子を発現するように遺伝子操作したマウスの標本を、X-gal染色すると、その特定の細胞のみが青色で染まる。この性質を利用して、特定の細胞とそれ以外の細胞を識別することができる。
注9)骨芽細胞
英語では”osteoblast”と呼ばれる。骨組織において骨形成を行う細胞であり、成長すると骨細胞になる。
注10)FOPの変異遺伝子
FOPの原因遺伝子は、BMPのI型受容体の一つであるACVR1遺伝子である。この遺伝子に突然変異が生じて、BMPシグナルを過剰に伝えることで異所性骨の形成が誘導される。
注11)カルディオトキシン
コブラ毒の主成分。PKCを特異的に阻害する。骨格筋を脱分極させることで、壊死を引き起こす。
注12)Venus
オワンクラゲがもつ緑色蛍光タンパク質GFP(Green Fluorescent Protein、緑色蛍光タンパク質)を改良して作製された黄色蛍光タンパク質。GFPよりも光が強く、またタンパク質が作られてから蛍光を発するまでの時間が短いという特徴をもつ。
注13)恒常性
体内環境を常に一定の状態に保とうとする働きのこと。英語で”homeostasis(ホメオスタシス)”という。