2023-11-24 京都工芸繊維大学,基礎生物学研究所
1.発表概要
国立大学法人京都工芸繊維大学 応用生物学系 井沢真吾 准教授、同大学大学院工芸科学研究科博士前期課程 安東稜子氏、大学共同利用機関法人 自然科学研究機構 基礎生物学研究所 鎌田芳彰 助教らの研究グループは、これまで大きな謎とされてきた「酵母のエタノール耐性」について、鍵となるメカニズムを解明しました。本研究で得られた知見は、日本酒や焼酎、ワインの醸造技術改良やバイオエタノールの生産コスト低減に貢献することが期待されます。
なお、この研究成果は、2023年11月16日付けの米国学術誌Journal of Biological Chemistry オンライン版 (https://doi.org/10.1016/j.jbc.2023.105472) に掲載されました。
アルコール発酵によって糖からエタノールを産生する酵母(学名 Saccharomyces cerevisiae)は、日本酒やワインなどの酒類醸造やパン作り、バイオエタノール製造などに利用される最も身近な有用微生物です。一方、高濃度のエタノールはタンパク質の変性や細胞増殖の阻害を引き起こす毒物でもあり、消毒などにも利用されています。エタノールを産生する酵母は他の生物と比べて高いエタノール耐性を示しますが、そのメカニズムは不明であり、これまで大きな謎とされてきました。同研究グループは、エタノールの毒性に対して酵母が耐性を獲得する上で、熱ショックタンパク質(HSP, heat shock protein)のHsp104とHsp70を主要構成因子とするバイシャペロンシステム(下図)が不可欠であることを明らかにしました。
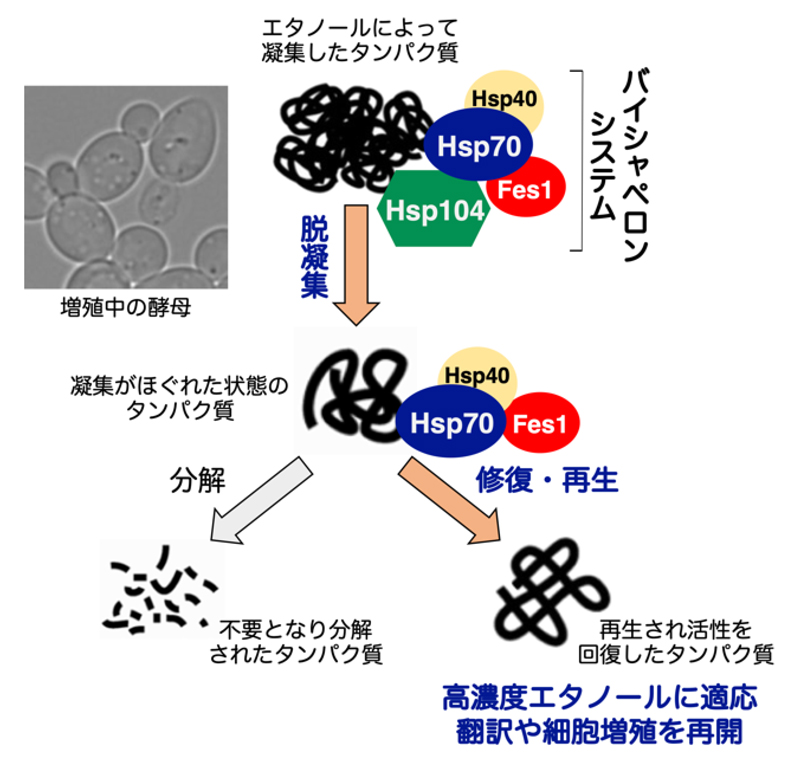 図 バイシャペロンシステムとエタノール耐性
図 バイシャペロンシステムとエタノール耐性
シャペロンは細胞内でタンパク質が正しい立体構造を維持するのをサポートするタンパク質であり、その多くは熱ショックタンパク質の仲間です。ストレスなどによって立体構造が崩れてからまった状態になった凝集タンパク質は、Hsp70によってHsp104のもとに運ばれます。その「からまり」がHsp104によって解かれると(脱凝集)、Hsp70によって正しい立体構造へと修復されたり(リフォールディング)、あるいはタンパク質分解酵素によって分解・排除されたりします(プロテオリシス)。このように、二つのシャペロン(Hsp70とHsp104)が重要な働きをするバイシャペロンシステム(bi- はふたつを意味する接頭語)は、細胞内タンパク質の品質管理や恒常性の維持において重要な役割を担うと考えられています。
高濃度のエタノールにさらされた酵母細胞内では、一部のタンパク質が変性・凝集し、タンパク質を合成する活性(翻訳活性)が抑制され細胞増殖が停止してしまいます。そのような苦境下であっても、酵母はバイシャペロンシステムの活性を上昇させることで、凝集して活性を失ったDed1注1などの重要因子を修復・再生し、翻訳活性や細胞増殖を回復・再開することが今回明らかとなりました。一方、バイシャペロンシステムが活性化しない場合や、同システムが機能しないfes1∆hsp104∆変異株などでは翻訳活性や細胞増殖を回復できないことが確認され、酵母がエタノールの毒性に対するレジリエンス(回復力・耐久力)注2を発揮して耐性を獲得する上で、バイシャペロンシステムが不可欠であることが初めて明らかとなりました。
今回の発見は、長年の謎とされてきた酵母のエタノール耐性機構の解明に迫る大きな手がかりであり、エタノール耐性をさらに向上させる上でも重要な情報となっています。今回得られた知見を活用すれば、お酒やバイオエタノールの製造効率を飛躍的に向上させることや優良酵母の育種が可能になると考えられるため、様々な波及効果が期待されます。
本研究は文部科学省・科学研究費補助金制度JP20H02900と大隅基礎科学創成財団の助成を受けて行ったものです。
2.発表内容
【研究の背景】
アルコール発酵を行う酵母は優れた発酵力とともに高いエタノール耐性を有しています。パスツール以来、アルコール発酵の詳細な分子機構が解明されてきたのに対し、エタノールの毒性に対する耐性獲得メカニズムはいまだに解明されておらず謎に包まれたままです。
高濃度のエタノール(10% v/v)は酵母にとってもストレスとなり、タンパク質合成の活性(翻訳活性)やプロテアソーム注3によるタンパク質分解活性を阻害し、一部のタンパク質の変性・凝集を引き起こすことが確認されています(参考論文1~3)。また、変性・凝集したタンパク質は、INQ(IntraNuclear Quality control compartment)などのdeposition sites(DS)注4やストレス顆粒(stress granules, SG) 注5 に蓄積するため、GFP注6などで可視化し蛍光顕微鏡で観察することが可能です(参考論文2)。
一方、酵母は高濃度エタノールストレスに適応することが可能であり、ワインや日本酒の醸造過程では14〜20%という非常に高い濃度のエタノールを産生します。また、プロテアソームなどの一部の機能については、低濃度のエタノール(6% v/v)で前処理することによって耐性が向上し、高濃度エタノールによる阻害を防ぐことが可能です(参考論文2,3)。
研究グループは、酵母の細胞増殖や発酵力に深く関係する翻訳活性において、エタノール耐性が獲得されるのか研究を行いました。
【研究内容】
翻訳活性におけるエタノール耐性の獲得
10%エタノールで直接酵母細胞を処理した場合にはポリソーム(翻訳装置リボソームの集合体)の形成が阻害され、翻訳活性が抑制されることを確認しました。一方、6%エタノールで前処理した細胞は、10%エタノールにさらされた直後は翻訳活性が阻害されたものの、徐々にポリソームの形成が復活し通常レベルまで回復することを見出しました(図1)。また、翻訳が抑制された際に形成されるSGについても、6%エタノールで前処理した細胞では10%エタノール下で形成されたSGが徐々に消失することが観察されました。さらに、細胞増殖の再開なども認められ、前処理した細胞では10%エタノール下で翻訳活性が回復することが確認されました。これらの結果から、翻訳活性においても酵母は高濃度エタノールに対するレジリエンス(回復力・耐久力)を発揮し、耐性を獲得することが初めて明らかになりました。
Ded1を介したエタノールストレス下における翻訳活性の制御
真核生物の翻訳活性を抑制する仕組みとしては、翻訳開始因子eIF2alphaのリン酸化がよく知られています。そこで、高濃度エタノールによって翻訳活性が抑制されている際や、耐性獲得によって翻訳活性が回復した際のeIF2alphaのリン酸化レベルを検討したところ、有意な変化は認められませんでした。この結果は、エタノールストレス下での翻訳活性の制御はeIF2alphaのリン酸化を介したものではないことを示しています。
次に、翻訳開始段階に着目して解析を行いました。翻訳の開始に際して各mRNA上の開始コドン注7(5´-AUG-3´)を見つけるためには、RNAヘリカーゼという酵素(eIF4AとDed1)でmRNAの二次構造をほどく必要があります(図2)。ある種のストレス下では、Ded1がRNAから解離してSGに凝集し、翻訳開始が阻害されることが報告されていました。そこで、eIF4AとDed1の細胞内局在をGFPで検討したところ、eIF4Aの局在はとくに変化しませんでしたが、Ded1は10%エタノール下でSGに凝集しました。また、6%エタノールで前処理した細胞では、10%エタノール下でDed1が一旦凝集するものの、徐々に細胞質全体に拡散し通常の局在に戻る様子が観察されました(図3)。これらの結果は、エタノールによる翻訳抑制の一因がDed1の凝集・失活であり、その凝集解消が翻訳活性の回復に必要だということを示しています。
耐性獲得におけるバイシャペロンシステムの重要性
凝集したタンパク質を修復・分解するためには、ある程度ほぐれた状態まで脱凝集する必要があります。酵母ではHsp70などの分子シャペロンによって凝集タンパク質が脱凝集酵素Hsp104に運ばれ、ほぐれた状態へと脱凝集されます。ほぐれた変性タンパク質はHsp70によって正しい立体構造へと修復・再生され、活性・機能を回復します(リフォールディング)。そのため、Hsp104とHsp70および関連因子はタンパク質の品質管理において重要な働きを担っており、バイシャペロンシステム(bi-chaperone system)とよばれています。なお、Hsp104はストレス下でSGやDSに局在化するため、10%エタノールで直接処理した酵母細胞では、変性したDed1とHsp104が共局在して顆粒を形成することが観察されました。
そこで、エタノールへの適応・耐性獲得の際には、Ded1がバイシャペロンシステムによって脱凝集・再生されるのではないかという仮説を立て、くわしく解析を行いました。遺伝子破壊株fes1∆hsp104∆はHsp104とともにHsp70の活性を維持するために必要なヌクレオチド交換因子(NEF)のFes1を欠損しているため、バイシャペロンシステムが十分に機能しなくなった変異株です。野生株との比較を行ったところ、fes1∆hsp104∆株ではエタノールに対する耐性を獲得できず、翻訳活性や細胞増殖が回復しませんでした。また、fes1∆hsp104∆株ではDed1の凝集体も消失せず、長期間Ded1が機能を失った状態だと考えられました(図3)。実際に、野生株では凝集して不溶化したDed1が再可溶化して再生されるのに対し、fes1∆hsp104∆株では再生が不十分であり、Ded1の機能が回復していないことが確認されました。なお、野生株とfes1∆hsp104∆株でDed1の発現レベルに大きな違いはなく、エタノール処理によっても変化しませんでした。また、細胞内の凝集タンパク質レベルがfes1∆hsp104∆株では野生株よりも高く、エタノールによって変性し機能を失ったタンパク質をうまく修復・再生できていないことが確認されています(参考文献2)。
まとめと今後の展望
以上の研究から、高濃度エタノールストレスはDed1を変性・凝集させることで翻訳活性を抑制しますが、酵母はバイシャペロンシステムを介してDed1を修復・再生することで翻訳活性や細胞増殖を回復し、エタノールへの適応を果たすことが明らかとなりました。バイシャペロンシステムはDed1以外の因子の修復・再生にも関与することや、fes1∆hsp104∆株がエタノール耐性を獲得できなかったことから、酵母がエタノールストレスに対するレジリエンスを発揮する上でバイシャペロンシステムは不可欠だと言えます。バイシャペロンシステムの強化などを通じて、酒類やバイオエタノールの生産効率が飛躍的に改善されることも期待されます。
【原著論文情報】
Ryoko Ando, Yu Ishikawa, Yoshiaki Kamada, and Shingo Izawa (2023) Contribution of the yeast bi-chaperone system in the restoration of the RNA helicase Ded1 and translational activity under severe ethanol stress. J. Biol. Chem. https://doi.org/10.1016/j.jbc.2023.105472.
【参考論文】
1. Sae Kato, Masashi Yoshida, and Shingo Izawa (2019) Btn2 is involved in the clearance of denatured proteins caused by severe ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res., 19(8): foz079.
2. Masashi Yoshida, Sae Kato, Shizu Fukuda, and Shingo Izawa (2021) Acquired resistance to severe ethanol stress on protein quality control in Saccharomyces cerevisiae. Appl. Environ. Microbiol., 87(6): e02353-20.
3. Vo Thi Anh Nguyet, Noboru Furutani, Ryoko Ando, and Shingo Izawa (2022) Acquired resistance to severe ethanol stress-induced inhibition of proteasomal proteolysis in Saccharomyces cerevisiae. Biochim. Biophys. Acta Gen. Subj., 1866:130241.
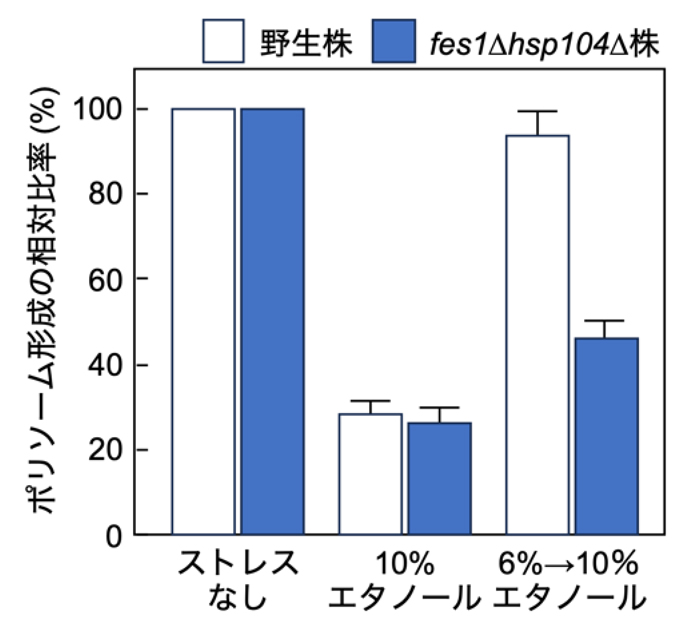
図1. 酵母の翻訳活性を反映するポリソームの形成状況
10%エタノールストレス下では翻訳活性や細胞増殖が阻害されますが、6%エタノールで前処理した野生株は高濃度エタノールに対する耐性を獲得し、10%エタノール下でも徐々にポリソームが形成され翻訳活性や細胞増殖を回復させることが可能です。しかし、fes1∆hsp104∆株では、6%エタノールで前処理しても翻訳活性は回復せず、高濃度エタノールに適応できないことが明らかとなりました。
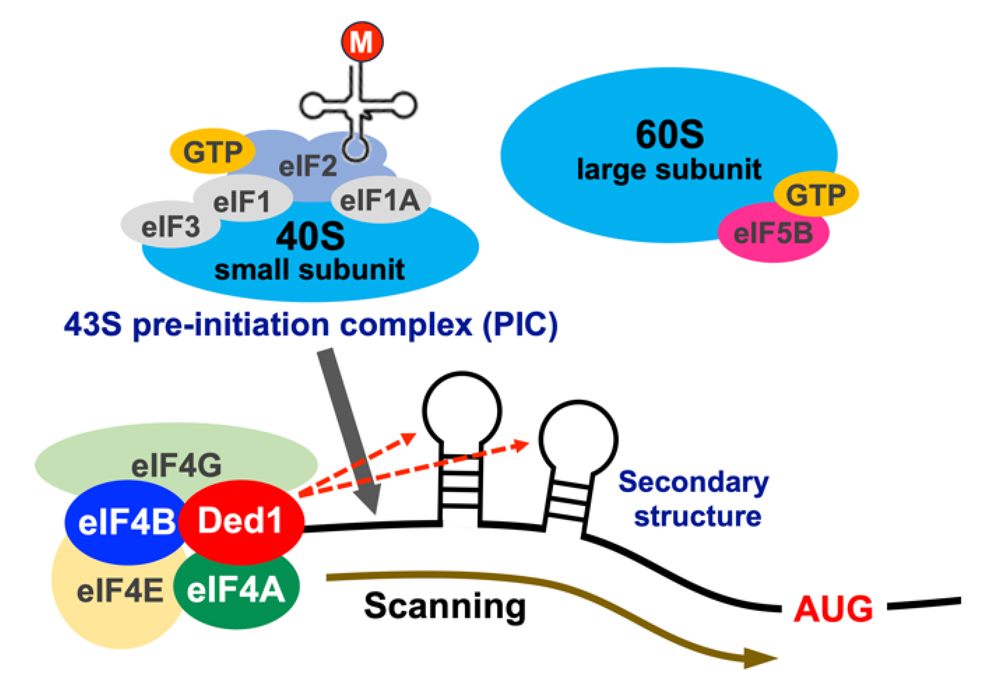
図2. 翻訳開始段階とRNAヘリカーゼDed1
細胞増殖に必要なmRNA(housekeeping mRNA)の多くは開始コドン(AUG)上流にステム・ループ構造(二次構造)を持つため、翻訳を開始するにはeIF4AやDed1などのRNA helicaseによって二次構造をほどく必要があります。二次構造がなくなると、40S リボソーム小サブユニットなどからなるPICがscanningをして最初の開始コドンを見つけ、 60S リボソーム大サブユニットを呼び込むことで翻訳が開始されます。高濃度エタノールはDed1やeIF4BをmRNAから解離させ凝集体を形成させるため、housekeeping mRNAの翻訳が抑制され、細胞増殖も停止してしまいます。
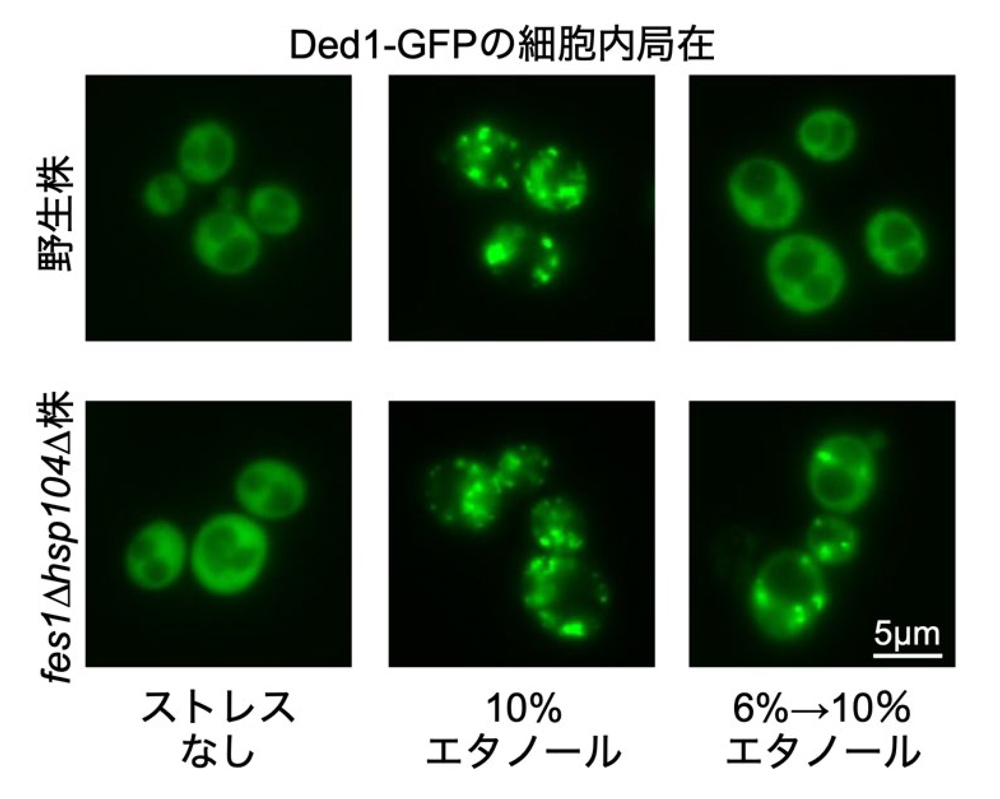
図3. エタノールによるDed1の凝集と失活
10%エタノールストレス下ではDed1が凝集・失活して、翻訳活性や細胞増殖が阻害されます。一方、6%エタノールで前処理した野生株はバイシャペロンシステムを活性化し、10%エタノール下でも徐々にDed1を修復し機能を回復します。しかし、fes1∆hsp104∆株では、6%エタノールで前処理してもDed1は凝集したままであり、高濃度エタノールへの適応にバイシャペロンシステムが必要であることが明らかとなりました。
3.用語解説
注1Ded1
RNAの二次構造をほどく活性を持つタンパク質(RNA helicase)の一つ。翻訳開始因子と結合しており、翻訳開始の妨げとなるmRNAの二次構造を取り除く。
注2レジリエンス(resilience)
ストレスなどの困難な問題や危機的な状況に遭遇しても、すぐに立ち直る生物の能力を指す。もともとは物体の弾性を意味する言葉だが、生物の能力や心の回復力(生物学的・精神的な強さの指標の一つ)を説明する言葉としても使われるようになった。
注3プロテアソーム(proteasome)
タンパク質分解を担う巨大な酵素複合体であり、細胞内タンパク質の恒常性維持において中心的な役割を担う。主にユビキチン化されたタンパク質を選択的に分解する。
注4Deposition sites(DS)
変性・凝集したタンパク質が集められる細胞内の集積場。集積することにより、変性タンパク質の毒性の拡散を防ぎ、効率的な脱凝集・再生を行なうことができるとされている。
注5ストレス顆粒(stress granules, SGs)
翻訳抑制によって生じた非翻訳状態のmRNAや翻訳開始因子をはじめとするタンパク質が、液-液相分離現象によって集合して生じる直径200 nm程度の細胞内顆粒。
注6GFP
青色の光を吸収して緑色の蛍光を発する緑色蛍光タンパク質。注目するタンパク質に融合することで、そのタンパク質が細胞内のどこに局在するのかを蛍光顕微鏡で可視化することができる。下村脩博士によってオワンクラゲから発見され、その貢献に対して2008年ノーベル化学賞が贈られた。
注7開始コドン
翻訳装置(リボソーム)による翻訳の開始地点となるmRNA上の塩基配列であり、真核生物ではメチオニン(アミノ酸の一種)をコードする配列AUGが通常用いられる。
4.問合せ先
<研究に関すること>
・京都工芸繊維大学 応用生物学系 准教授 井沢 真吾
・基礎生物学研究所 分野横断研究ユニット 助教 鎌田 芳彰
<報道に関すること>
・京都工芸繊維大学 総務企画課 広報係
・基礎生物学研究所 広報室