2023-12-01 理化学研究所,台湾中央研究院,台湾大学,フィリップ大学マールブルク,大阪大学,東北大学,京都大学
理化学研究所(理研) 放射光科学研究センター 生命系放射光利用システム開発チームの別所 義隆 客員研究員(台湾中央研究院 生物化學研究所 客座教授(研究当時兼務))、台湾中央研究院・生物化學研究所の蔡 明道 特聘研究員、台湾大学のManuel Maestre-Reyna(マヌエル・マエストレ・レイナ)助理教授、フィリップ大学マールブルクのLars-Oliver Essen(ラーズ・オリバー・エッセン)教授、大阪大学大学院 基礎工学研究科 物質創成専攻の山元 淳平 准教授、東北大学 多元物質科学研究所の南後 恵理子 教授、京都大学大学院 医学研究科 分子細胞情報学の岩田 想 教授らの国際共同研究グループは、X線自由電子レーザー(XFEL)[1]施設「SACLA[2]」と「SwissFEL[3]」を用いた時分割結晶構造解析[4]によって、紫外線によって損傷したDNAを修復する光回復酵素の動的構造を解明しました。
光回復酵素は青色光が当たるとDNA修復を始めますが、修復の最中の酵素およびDNAの立体構造は不明でした。本研究では、酵素の活性中心であるフラビン補酵素FAD[5]からの電子移動を引き金としたDNA修復反応と、修復されたDNAが酵素から離脱する様子を、ピコ秒(1ピコ秒は1兆分の1秒)からマイクロ秒(1マイクロ秒は100万分の1秒)のスケールで明らかにしました。
本研究は、疾患の原因にもなるDNA損傷の修復過程に関する理解を深め、立体構造に基づくより合理的な人工酵素や薬剤の設計に寄与するものです。
本研究は、科学雑誌『Science』オンライン版(2023年11月30日付:日本時間12月1日)に掲載されました。
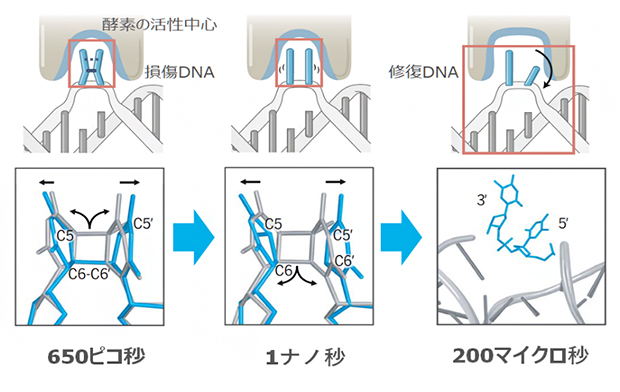
本研究で明らかになった光回復酵素の反応の様子
背景
紫外線がDNAに当たると、ピリミジン塩基(シトシンまたはチミン)が連続した箇所でピリミジン二量体という構造ができることがあります。なかでもシクロブタン型ピリミジン二量体(CPD)は、ピリミジン塩基のC5およびC6炭素が、隣接するピリミジン塩基のC5’およびC6’炭素に共有結合しており、細胞内で紫外線によって発生する代表的な損傷DNAです。このような損傷が生じると、DNA複製や転写の妨げとなり、細胞死や突然変異、がん化など、細胞にさまざまな弊害をもたらします。
DNA光回復酵素は、紫外線曝露により生じるCPDを修復する酵素です(図1)。この酵素は、反応に青色の光を必要とします。まず、酵素の反応中心にあるフラビン補酵素(FAD)がフォトン(光子)を捉えると、近傍のアミノ酸残基から電子を受け取って酸化型(FADox)から還元型(FADH–)に変化し、酵素によるDNA修復の準備が完了します。この反応は、光還元反応と呼ばれています。DNAはCPD部位で二重らせん構造が変形しており、DNA光回復酵素がそれを見つけてCPDを活性中心に収納します。この状態で酵素のFADH–が新たなフォトンを捉えて、電子をCPDに転移することでDNAが修復されます。このような反応経路は明らかになっていたものの、損傷DNAが修復される最中のDNAおよびタンパク質の立体構造は分かっていませんでした。この点を解明するために、反応中間体の原子レベル分解能での立体構造決定を試みました。
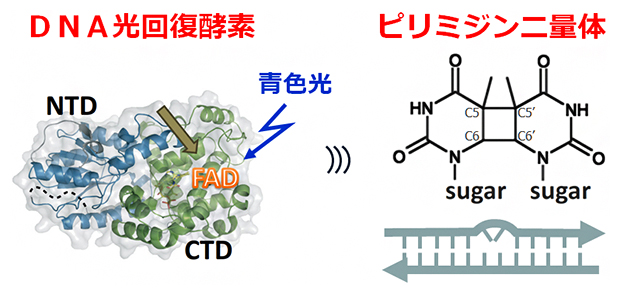
図1 光回復酵素による紫外線損傷DNAの修復
左)DNA光回復酵素の立体構造。DNA光回復酵素に青色光が当たると、反応中心のFAD(矢印)が酸化型(FADox)から還元型(FADH–)に変化する。NTD、CTDはそれぞれタンパク質のN端ドメイン、C端ドメインを示す。
右)シクロブタン型ピリミジン二量体(CPD)の構造式(上)とDNA損傷のイメージ(下)。DNAの塩基配列の中にCPDができると、DNAの塩基対構造がゆがみ、複製や転写が妨げられる。
研究手法と成果
国際共同研究グループは、還元状態の古細菌のDNA光回復酵素のタンパク質を、CPDを持つDNAと暗所嫌気下で混ぜて結晶化し、反応直前の酵素―DNA複合体の結晶を準備しました。この結晶に反応のトリガーとなる青色光を当て、ピコ秒からサブミリ秒(1万分の1秒)の時間差でSACLAまたはSwissFELのビームラインからX線自由電子レーザーを照射し、回折光を検出しました。回折光から得られる数万のイメージデータから、タンパク質と修復DNAの立体構造を決定し、反応開始後の時間が異なるスナップショットを集めました。
光回復酵素によるCPD修復は、青色光を照射して100ピコ秒後から始まっていました。FADH–からCPDへの電子移動により、酵素活性中心にあるアルギニン(R256)側鎖の立体位置が変わり、電子を受け取ったCPDを安定化させていました。その後、反応開始650ピコ秒後にCPDのC5-C5’結合が開裂し、反応開始1ナノ秒後にC6-C6’も同様に開裂することで、2塩基のピリミジンへと修復される様子を観察できました。反応に使用された電子は、フラビン補酵素に逆転移し、FADH–を再生することで次の修復反応に備えます。その後、酵素活性中心が反応前の状態へ戻ると、修復された二つのピリミジン塩基は、順番に回転して酵素活性中心から離れ、DNAの二重らせん構造が回復します。これには反応開始後200マイクロ秒と比較的長い時間を要し、連続した酵素反応の律速になっていることが見いだされました(図2)。このように、DNA光回復酵素が損傷DNAを修復する際の全ての原子メカニズムを、リアルタイムで解明しました。
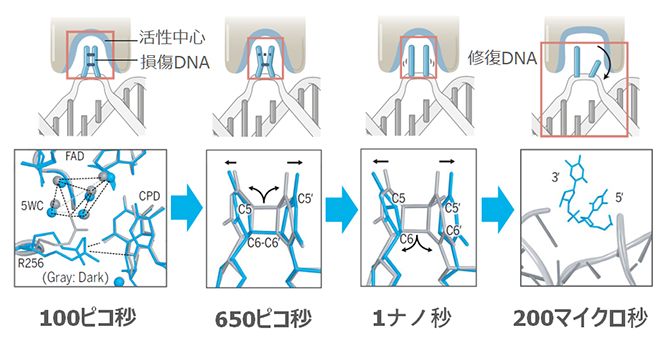
図2 XFEL時分解構造解析により明らかになった光回復酵素のDNA修復反応
上段が反応の模式図、下段が模式図の赤枠内を分子の立体構造で示したもの。時間は反応開始後の時間を示す。
今後の期待
光回復酵素は原核生物から真核生物まで幅広い種で保有されている基本的なDNA修復酵素です。本研究は、この酵素の反応における中間体の性質や構造を経時的に詳細に解析することで、基礎化学の理解に大きく貢献するものです。
ピリミジン二量体は、皮膚がんの一種メラノーマの原因となる可能性が示唆されています。今回の研究は光回復酵素による損傷DNAの修復過程を完全に解明しました。これにより、DNA修復活性がより高い人工酵素の作成など応用研究への道も開けました。
また、原子レベルで酵素反応の全過程を直接調べることが可能となり、新たな酵素学への扉を開きました。今後、酵素の真の活性状態である反応中間体の構造に基づいて、合理的に触媒や薬剤を設計するための第一歩となるものです。
補足説明
1.X線自由電子レーザー(XFEL)
近年の加速器技術の発展によって実現したX線領域のパルスレーザー。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的な波長の制限はない。SPring-8などの従来の放射光源と比較して、10億倍も高い輝度のX線がフェムト秒(1,000兆分の1秒)スケールの時間幅を持つパルス光として出射される。この高い輝度を生かしてマイクロメートルサイズの小さな結晶を用いたタンパク質の原子分解能の構造解析やX線領域の非線形光学現象の解明などの用途に用いられている。
2.SACLA
理研と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。高い空間コヒーレンス、短いパルス幅、高いピーク輝度を備えたX線領域のレーザーを発生させる。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLA(サクラ)と命名された。2011年6月に最初のX線レーザーを発振、2012年3月から共用運転が開始され、利用実験が始まった。大きさが諸外国の同様の施設と比べて数分の1とコンパクトであるにもかかわらず、0.1nm以下という世界最短クラスの波長のレーザー生成能力を持つ。
3.SwissFEL
スイス北部のパウル・シェラー研究所(Paul Scherrer Institute: PSI)に設置された比較的に新しいXFEL施設。2019年より運用が開始された。日本のSACLAは、LCLS(米国)、European-XFEL(欧州)、SwissFEL(スイス)、PAL-XFEL(韓国)、上海XFEL(中国)とともに6極連携を進め、国際的な研究協力体制を強化している。
4.時分割結晶構造解析
結晶中の分子の微細な動きを高い時間分解能で観察する手法。本研究では、室温で微結晶を連続的にX線自由電子レーザーのX線照射ポイントまで流し、これに酵素の構造変化を引き起こす青色レーザー光を照射する装置を組み合わせてデータを取ることで、光回復酵素と損傷DNAの構造変化を観察した。Time-resolved serial femtosecond crystallography(TR-SFX)法の訳語。
5.FAD
フラビンアデニンジヌクレオチド(Flavin Adenine Dinucleotide)の略称。ビタミンB2(リボフラビン)にオルトリン酸2分子とアデノシン1分子が結合した化合物で、多くの酸化還元酵素の補酵素として重要である。アデノシンが結合しないフラビンモノヌクレオチド(FMN)とともに、フラビン補酵素と呼ばれる。両者は、微生物から高等動物まで広く生命基本原材料として細胞内反応に使われている。酸化型と還元型があり、それぞれFADox、FADH–と示した。
国際共同研究グループ
理化学研究所 放射光科学研究センター 生命系放射光利用システム開発チーム
客員研究員 別所 義隆(ベッショ・ヨシタカ)
(台湾中央研究院・生物化學研究所 客座教授(研究当時兼務))
台湾中央研究院・生物化學研究所
特聘研究員 蔡 明道(Ming-Daw Tsai)
台湾大学
助理教授 Manuel Maestre-Reyna(マヌエル・マエストレ・レイナ)
フィリップ大学マールブルク(ドイツ)
教授 Lars-Oliver Essen(ラーズ・オリバー・エッセン)
大阪大学 大学院基礎工学研究科 物質創成専攻
准教授 山元 淳平(ヤマモト・ジュンペイ)
東北大学 多元物質科学研究所
教授 南後 恵理子(ナンゴ・エリコ)
(理化学研究所 放射光科学研究センター 分子動画研究チーム チームリーダー)
京都大学 大学院医学研究科 分子細胞情報学
教授 岩田 想(イワタ・ソウ)
(理化学研究所 放射光科学研究センター SACLA利用技術開拓グループ グループディレクター)
上記機関のほか、パウル・シェラー研究所(スイス)、欧州シンクロトロン放射光研究所(フランス)、ハンブルク大学(ドイツ)、オハイオ州立大学(米国)、高輝度光科学研究センター、グルノーブル・アルプ大学(フランス)、パリ=サクレー大学(フランス)、サンニオ大学(イタリア)の研究者らが参加。
研究支援
本研究は、主に日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用(領域代表者:岩田想)」、同公募研究「(6-4)光回復酵素によるDNA修復過程の分子動画撮影(研究代表者:山元淳平)」、同基盤研究(C)「非天然官能基ポスト標識技術による微小マイクロ結晶構造解析法の開発と応用(研究代表者:別所義隆)」、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)、科学技術振興機構(JST)創発的研究支援事業(FOREST)「DNA修復反応の動的構造解析基盤の創出(研究代表者:山元淳平)」による助成を受けて行われました。
原論文情報
Manuel Maestre-Reyna*, Po-Hsun Wang, Eriko Nango, Yuhei Hosokawa, Martin Saft, Antonia Furrer, Cheng-Han Yang, Eka Putra Gusti Ngurah Putu, Wen-Jin Wu, Hans-Joachim Emmerich, Nicolas Caramello, Sophie Franz-Badur, Chao Yang, Sylvain Engilberge, Maximilian Wranik, Hannah Louise Glover, Tobias Weinert, Hsiang-Yi Wu, Cheng-Chung Lee, Wei-Cheng Huang, Kai-Fa Huang, Yao-Kai Chang, Jiahn-Haur Liao, Jui-Hung Weng, Wael Gad, Chiung-Wen Chang, Allan H. Pang, Kai-Chun Yang, Wei-Ting Lin, Yu-Chen Chang, Dardan Gashi, Emma Beale, Dmitry Ozerov, Karol Nass, Gregor Knopp, Philip J. M. Johnson, Claudio Cirelli, Chris Milne, Camila Bacellar, Michihiro Sugahara, Shigeki Owada, Yasumasa Joti, Ayumi Yamashita, Rie Tanaka, Tomoyuki Tanaka, Fangjia Luo, Kensuke Tono, Wiktoria Zarzycka, Pavel Müller, Maisa Alkheder Alahmad, Filipp Bezold, Valerie Fuchs, Petra Gnau, Stephan Kiontke, Lukas Korf, Viktoria Reithofer, Christian Joshua Rosner, Elisa Marie Seiler, Mohamed Watad, Laura Werel, Roberta Spadaccini, Junpei Yamamoto, So Iwata, Dongping Zhong, Joerg Standfuss, Antoine Royant, Yoshitaka Bessho*, Lars-Oliver Essen*, Ming-Daw Tsai*, “Visualizing the DNA repair process by a photolyase at atomic resolution”, Science, 10.1126/science.add7795
発表者
理化学研究所
放射光科学研究センター 生命系放射光利用システム開発チーム
客員研究員 別所 義隆(ベッショ・ヨシタカ)
(台湾中央研究院・生物化學研究所 客座教授(研究当時兼務))
台湾中央研究院・生物化學研究所
特聘研究員 蔡 明道(Ming-Daw Tsai)
台湾大学
助理教授 Manuel Maestre-Reyna(マヌエル・マエストレ・レイナ)
フィリップ大学マールブルク
教授 Lars-Oliver Essen (ラーズ・オリバー・エッセン)
大阪大学 大学院基礎工学研究科 物質創成専攻
准教授 山元 淳平(ヤマモト・ジュンペイ)
東北大学 多元物質科学研究所
教授 南後 恵理子(ナンゴ・エリコ)
京都大学 大学院医学研究科 分子細胞情報学
教授 岩田 想(イワタ・ソウ)
報道担当
理化学研究所 広報室 報道担当
大阪大学 基礎工学研究科 庶務係
東北大学 多元物質科学研究所広報情報室
京都大学 渉外部広報課 国際広報室