2024-03-25 理化学研究所,東京慈恵会医科大学
理化学研究所(理研)生命医科学研究センター 細胞機能変換技術研究チームの許 雅麗 国際プログラム・アソシエイト、秦 咸陽 研究員、鈴木 治和 チームリーダー、東京慈恵会医科大学 臨床検査医学講座の古谷 裕 講師らの国際共同研究グループは、トウモロコシ由来のコーンオリゴペプチド[1]には高脂肪食による肥満や非アルコール性脂肪性肝炎(NASH)[2]を改善する効果があることを発見しました。
本研究成果は、生活習慣病に関連する肥満や脂肪肝を予防・改善する機能性食品の開発に貢献すると期待できます。
国際共同研究グループは、早期と後期段階の非アルコール性脂肪性肝疾患(NAFLD)[2]病態モデルマウスを用いて、コーンオリゴペプチドの経口投与による体重の減少、肝臓への脂質蓄積と酸化の改善、炎症・細胞障害・線維化形成の抑制などの肝保護作用を見いだしました。さらに、プロテオーム解析[3]を用いて、コーンオリゴペプチドの分子標的としてサーチュインシグナル経路[4]を同定しました。特に、コーンオリゴペプチドは、ミトコンドリアSirt3/5の遺伝子発現を選択的に抑制することを明らかにしました。
本研究は、科学雑誌『Journal of Agricultural and Food Chemistry』オンライン版(3月15日付)に掲載されました。
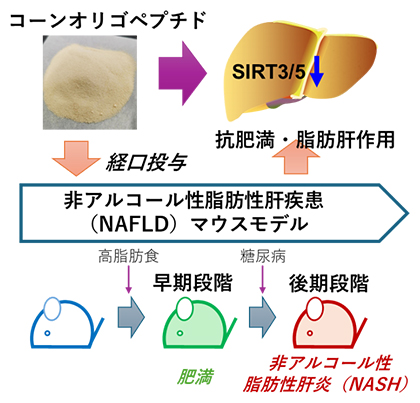
モデルマウスを使ったコーンオリゴペプチドの抗肥満・脂肪肝作用の研究
背景
医療技術の進歩により、がん全体の死亡率が低下しつつある中、肝がんは逆に死亡率が増加しています注1)。その原因の一つとして、抗肝炎ウイルス治療法の進展によりウイルス肝炎関連肝がんが減少しているのに対し、NAFLDなどのメタボリックシンドローム[5]による肝がんが増加していることが挙げられます注2)。日本において肥満者の割合は男性約33%、女性約22%とされます注3)。NAFLDは肥満との関連が強いことが報告され、肥満人口の増加に伴ってNAFLDの有病率が増加しているものと考えられます。NAFLDは単純性脂肪肝とNASHに分けられ、NASHの病状が改善されなければ肝線維化や肝がんに進行することがあります。現在NASHに対する有効な治療法は確立されておらず、栄養学的アプローチを用いて積極的に介入する栄養療法の重要度が高く、原因に応じた長期経口摂取可能かつ安全性・特異性の高い栄養療法が必要です。
トウモロコシのデンプンを取り除いたコーングルテンミールには必須アミノ酸や栄養素が多く含まれています。ただし、コーングルテンミールはヒトの消化器で吸収しにくいといわれています。コーンオリゴペプチドは、コーングルテンミールを特定の消化酵素によって分解して得られる短鎖のペプチドであり、血圧降下、アルコール代謝促進、肝臓保護、疲労緩和、筋肉増強など、多彩な機能を有することが報告されています。国際共同研究グループはこれまでに、活性酸素[6]産生能が高い病原性カンジダ菌と肝細胞の共培養から、コーンオリゴペプチドが肝細胞死の誘導を抑制することを見いだしました注4)。本研究では、マウスモデルを使い、コーンオリゴペプチドの経口投与によって、高脂肪食による肥満やNASHの病態進展が抑制されるかを検討しました。
注1)Sung H, Ferlay J, Siegel R, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3):209-49. doi: 10.3322/caac.21660
注2)Starley BQ, Calcagno CJ, Harrison SA. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection. Hepatology. 2010; 51(5):1820-32. doi: 10.1002/hep.23594
注3)厚生労働省令和元年国民健康・栄養調査報告
注4)Shrestha R, Shrestha R, Qin XY, et al. Fungus-derived hydroxyl radicals kill hepatic cells by enhancing nuclear transglutaminase. Sci Rep. 2017; 7(1):4746. doi: 10.1038/s41598-017-04630-8
研究手法と成果
国際共同研究グループは、早期段階のNAFLD病態モデルとして13週間の高脂肪食飼育による肥満マウスを作製しました。高脂肪食飼育の最後の2週間には、コーンオリゴペプチド(500mg/kg)を1日1回経口投与しました。対照群には生理食塩水を投与しました。その結果、コーンオリゴペプチドを与えた群では肥満マウスの体重増加が有意に抑制されました。生化学検査の結果、血清コレステロール値[7](図1A)や血清アラニンアミノ基転移酵素などの肝障害マーカーの増加も、コーンオリゴペプチドによって有意に抑制されました。肝組織を用いた遺伝子発現解析では、脂質代謝関連遺伝子(Srebp1a、Srebp1c、Cpt1、Gpat1)、小胞体ストレス関連遺伝子(Chop、Grp78)や酸化ストレス[8]関連遺伝子(HO-1、Nqo1、Sod2、Nox2、Nox4)の発現がコーンオリゴペプチドによって有意に抑制されたことが分かりました。また、肝臓の様子を組織染色法で調べたところ、コーンオリゴペプチドによってF4/80陽性マクロファージなどの炎症性細胞浸潤、DNA損傷や活性酸素の産生(図1B)の減少が見られました。これらの結果から、肥満マウスにコーンオリゴペプチドを投与することで、肝臓内での脂肪の蓄積が抑えられ、酸化ストレスが減少したことが示唆されます。
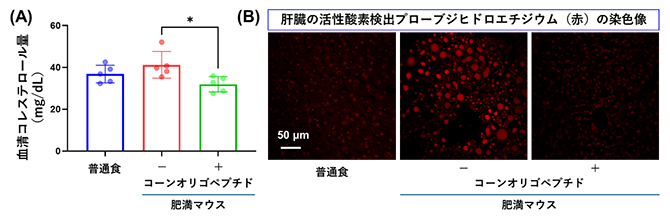
図1 肥満マウスにおけるコーンオリゴペプチドの肝保護作用
(A)血清コレステロール量。コーンオリゴペプチドによって肥満マウスの血清コレステロール量が有意に減少した。
(B)肥満マウスの肝組織の蛍光免疫染色像。活性酸素を検出するプローブであるジヒドロエチジウムを赤色で蛍光染色した。
次に、後期段階のNAFLD、すなわちNASHの病態モデルとして、生後2日のマウスに、ストレプトゾトシン[9]を投与し糖尿病マウスを誘導し、4週齢から高脂肪食で5週間飼育しNASH病態マウスを作製しました。高脂肪食飼育の最後の3週間には、コーンオリゴペプチド(500mg/kg)を1日1回経口投与しました。対照群では、生理食塩水を投与しました。その結果、コーンオリゴペプチドはNASHマウスの体重増加や肝組織中炎症関連分子Mcp1の遺伝子発現を有意に抑制しました(図2A)。興味深いことに、肝線維化の指標となる肝星(かんほし)細胞[10]の活性化やコラーゲンの産生(図2B)もコーンオリゴペプチドによって抑制されました。
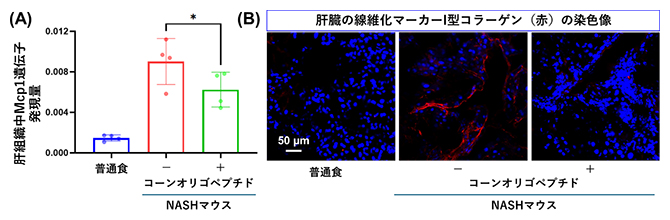
図2 NASHマウスにおけるコーンオリゴペプチドの肝保護作用
(A)肝組織中炎症マーカーMcp1遺伝子の発現量。コーンオリゴペプチドによってNASHマウスの肝組織中のMcp1遺伝子発現量が有意に減少した。
(B)NASHマウスの肝組織の蛍光免疫染色像。細胞の核をDAPI(青色)で、肝線維化マーカーⅠ型コラーゲンを赤色で蛍光染色しそれぞれ観察した。コーンオリゴペプチドによってNASHマウスの肝臓中のⅠ型コラーゲン量が減少した。
最後に、プロテオーム解析によって、コーンオリゴペプチドの標的分子を探索しました。肥満マウスの肝組織から、コーンオリゴペプチド投与によって発現が変化したタンパク質を抽出し、IPA(Ingenuity Pathway Analysis)[11]データベースを用いて調べた結果、サーチュインシグナル経路に関わるタンパク質群が有意に含まれていることが分かりました。さらに、哺乳類で存在する7種類のサーチュイン遺伝子(Sirt1~7)の発現を調べたところ、コーンオリゴペプチドを投与した肥満マウスとNASHマウスでは、肝組織中のミトコンドリアでSirt3およびSirt5遺伝子の発現が選択的に抑制されていました。コーンオリゴペプチドは、ミトコンドリアSirt3/5を介して、好気呼吸の最終段階である電子伝達系の活性を制御していると考えられます。
今後の期待
本研究では、NAFLD病態マウスにおいて、コーンオリゴペプチドが高脂肪食による肝臓への脂質蓄積と酸化や炎症・細胞障害を軽減して、NASHによる肝発がんの原因と考えられている肝線維化を改善することが分かりました。また、その分子メカニズムは、ミトコンドリアSirt3/5の遺伝子発現の制御に由来することが示唆されました。
食事療法は、食品の持つ栄養的機能や生体調節機能により、肝機能を改善するアプローチとして期待されています。一方で、NASHなどの生活習慣病に関して、食事療法は運動療法と共に、その効果のみならず長期においては遵守性(無理なく継続できるか)や安全性が問題になっています。今後は、コーンオリゴペプチドの機能性成分を分析することにより、より安全性と有効性の高い摂取が可能な次世代栄養食品(サプリメント)の開発が期待されます。
補足説明
1.オリゴペプチド
アミノ酸が10個以下のペプチド。摂取した食物のタンパク質は胃液・膵液(すいえき)・腸液などのタンパク質分解酵素により低分子のペプチドとアミノ酸に消化分解され、腸壁から吸収される。オリゴペプチドは、タンパク質を合成するほか、ホルモンや酵素、抗体、神経伝達物質などの多彩な生理活性物質としての役割を持っている。
2.非アルコール性脂肪性肝炎(NASH)、非アルコール性脂肪性肝疾患(NAFLD)
明らかな飲酒歴がないにもかかわらず、アルコール性肝障害に類似した肝障害を非アルコール性脂肪性肝疾患(NAFLD: nonalcoholic fatty liver disease)と呼ぶ。NAFLDは、さらに単純性脂肪肝と非アルコール性脂肪性肝炎(NASH: nonalcoholic steatohepatitis)に分類される。脂肪肝とは、肝臓の細胞の30%以上に中性脂肪のしずくがたまった状態をいう。NASHは、脂肪食による遊離脂肪酸が原因で起こるとされ、線維化、大滴性の脂肪滴、壊死・炎症所見、肝細胞の風船様膨化、核空胞化、脂肪肉芽腫、胞体内凝集傾向などが見られる。最近、患者への偏見を考慮するために、”metabolic”(代謝性)という用語を含めて、NAFLDはMASLD(metabolic dysfunction-associated steatotic liver disease)へ、NASHはMASH(metabolic dysfunction-associated steatohepatitis)への名称変更の動向がある。
3.プロテオーム解析
タンパク質(プロテイン)の発現量を網羅的に解析する技術。タンパク質は鎖状につながったアミノ酸が立体構造をとることでできあがっているため、アミノ酸配列を解読することにより、タンパク質を同定できる。この原理を利用して、試料中のタンパク質を断片化して質量分析計により質量数を測定することで、どんなタンパク質がどれくらいの量、試料中に存在しているのかを知ることができる。
4.サーチュインシグナル経路
細胞のエネルギー代謝、ミトコンドリア機能、細胞周期制御、DNA修復、炎症反応、およびアポトーシスなどの生理的プロセスに重要な役割を果たす経路。サーチュインタンパク質をコードする遺伝子は、老化や寿命の制御に重要な役割を果たすとされており、「長寿遺伝子」とも呼ばれている。細菌から哺乳類まで、多くの生物に備わっている。ヒトを含む哺乳類では7種類が見つかっており、SIRT1~7と命名されている。
5.メタボリックシンドローム
内臓性脂肪症候群のこと。内臓肥満に高血圧、高血糖、脂質代謝異常が組み合わさり、心臓病や脳卒中などの動脈硬化性疾患や肝炎を招きやすい生活習慣病。
6.活性酸素
普通の酸素に比べて著しく反応性が増した、原子状態の酸素や電子状態が不安定な酸素分子をいう。生体内では白血球の殺菌作用など多くの生理現象に関与する。細胞を直接的あるいは間接的に傷つけ、老化の一因を作る。
7.血清コレステロール値
血清中にリポタンパク質として溶けているコレステロールの濃度(成人で200mg/dl前後)。低すぎても、高すぎても良くないことが疫学調査などから明らかにされている。この数値が高いと、動脈硬化、心筋梗塞、脳梗塞などを起こす危険性も高くなる。
8.酸化ストレス
生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシルラジカルを代表とする活性酸素が産生される。これらがタンパク質や脂質、あるいは核酸と反応し、生体にダメージを与える。
9.ストレプトゾトシン
天然由来の有機化合物であり、特に哺乳類の膵臓(すいぞう)のβ細胞への毒性を持つ。動物実験用試薬として、膵島β細胞を特異的に破壊してインスリン産生を減少させ、動物モデルで高血糖を誘発することができる。また、膵臓がんなどに対する抗がん剤としても使用される。
10.肝星(かんほし)細胞
肝臓はヒトの内臓では最大の臓器であり、代謝や解毒など多様な機能を持つ。心臓からの肝動脈と、小腸などを経由した静脈(門脈)が肝内に入り、類洞(るいどう)と呼ばれる毛細血管で混じり合った血液が肝静脈を通って流出する。肝星細胞は類洞内皮細胞と肝細胞の間に存在し、ビタミンAを貯蔵したり、コラーゲン線維を産生したりする。
11.IPA(Ingenuity Pathway Analysis)
トランスクリプトーム解析などで得られたデータを基に、発現が変動した遺伝子がどのパスウェイに多く含まれているかを調べることをパスウェイ解析と呼ぶ。本研究では、インテグニティ社が提供するパスウェイ解析ツールIPAを用いた。
国際共同研究グループ
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
研究員 秦 咸陽(シン・カンヨウ/Qin Xian-Yang)
国際プログラム・アソシエイト 許 雅麗(キョ・ガレイ/Xu Yali)
研究パートタイマーⅡ ミシラ リチャ(Mishra Hricha)
脳神経科学研究センター 生体物質分析支援ユニット
専門技術員 安藤 れい子(アンドウ・レイコ)
東京慈恵会医科大学 臨床検査医学講座
講師 古谷 裕(フルタニ・ユタカ)
南京大学(中国)
教授 虞 文魁(Yu Wenkui)
研究員 蘇 婷(Su Ting)
食品発酵工業研究院(中国)
院長 蔡 木易(Cai Muyi)
主任研究員 魯 軍(Lu Jun)
研究支援
本研究の一部は、日本医療研究開発機構(AMED)肝炎等克服実用化研究事業「がん幹細胞遺伝子の発現動態の追跡を基軸とした肝がんの病態解明と創薬研究(JP23fk0210100h0003、研究代表者:秦咸陽)」、同医療分野国際科学技術共同研究開発推進事業「肝がんに対するMYCN/NCYM標的治療薬の開発(JP23jm0210092s0103、研究代表者:筆宝義隆)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「脂肪肝を背景にしたエンドトキシン過剰反応における膜脂質構造と分子間接着因子の関与(20K07349、研究代表者:秦咸陽)」、東京生化学研究会研究助成金「トランスオミックスによる肝線維化・発がんの病態解明(研究代表者:秦咸陽)」による助成を受けて行われました。また、理研脳神経科学研究センター生体物質分析支援ユニットの技術支援を受けて行われました。
原論文情報
Xu Y, Su T, Hricha M, Ando R, Furutani Y, Lu J, Cai M, Suzuki H, Yu W, Qin XY, “Corn oligopeptide alleviates nonalcoholic fatty liver disease by regulating sirtuin signaling pathway”, Journal of Agricultural and Food Chemistry, 10.1021/acs.jafc.3c09058
発表者
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
研究員 秦 咸陽(シン・カンヨウ/Qin Xian-Yang)
国際プログラム・アソシエイト 許 雅麗(キョ・ガレイ/Xu Yali)
東京慈恵会医科大学 臨床検査医学講座
講師 古谷 裕(フルタニ・ユタカ)
報道担当
理化学研究所 広報室 報道担当
学校法人慈恵大学 法人事務局 経営企画部広報課