2024-05-21 東京大学
発表のポイント
- 生体内での人工的な化学合成に繋がる、生体寛容性のルイス酸触媒を開発した。
- 長年の課題だった、タンパク質や生体小分子中のアミンやチオールなどのルイス塩基性官能基による被毒を克服し、生体内でのルイス酸触媒開発に道筋を付けた。
- 近年、盛んに研究されている生体内での物質生産や医療応用の幅が広がることが期待される。

生体寛容性の獲得を志向したキラルルイス酸触媒
発表概要
東京大学大学院理学系研究科の小林修教授、北之園拓助教らによる研究グループは、フラスコ内で行われてきた有機合成技術を生体内で実現することに向けた重要なステップとして、ルイス酸触媒の新たな可能性を切り拓くことに成功した。
現代有機化学において、ルイス酸触媒はそのユニークな反応性と選択性を制御する能力から、非常に重要な役割を果たしている。しかし、古典的なルイス酸は湿気に敏感で水の存在下では分解してしまうという問題があった。さらにルイス酸は、生体内ではタンパク質や生体小分子中のアミンやチオールなどのルイス塩基性官能基によって容易に被毒されてしまう。こうした機能不全は、ルイス酸触媒の潜在的な応用性を下げる要因となっていた。
本研究では、キラルルイス酸(注1)骨格の設計と有機金属構造体MOF(注2)技術によって、これら課題の克服を目指した。これまで生体内での触媒開発は主に、被毒に比較的耐性のある貴金属触媒をベースに展開されてきたが、今回、タンパク質存在下でルイス酸触媒を機能させることに成功した。
発表内容
研究の背景
近年、天然に存在する化学反応ネットワークを人為的に改変・再設計し、物質生産や医療への応用を目指す研究が注目を集めている。天然には存在しない触媒能を細胞内へと導入することは、自然界には存在しない物質生産や反応制御の仕組みを人工的に創製することができるため、画期的な応用に繋がることが期待されている。そこで、様々な反応基質に対して多種多様な反応を起こすことができる金属触媒反応が、国内外で活発に検討されている。しかしながらこれら触媒は、生体毒性を引き起こさないこと、水系環境での耐性を持つことが必須であり、加えてタンパク質やグルタチオン(注3)など様々な生体分子と配位することで触媒活性が失われてしまう問題を克服する必要があった。そこで例えば、金属を含まないタンパク質の疎水性ポケット内部に金属触媒を移植することで人工金属酵素を創製する研究が国内外で広く行われている。しかし強ルイス酸触媒はルイス塩基(注4)と強く結合するため被毒を抑えることは難しく、導入可能な金属触媒反応が限られていた。
研究の内容
本研究では、キラルルイス酸骨格の精緻な設計とMOF技術をこれら諸問題の解決策として提案した。MOFはその高い表面積、多孔性、高度に調整可能な孔構造、そして柔軟な機能性により、ガス貯蔵、センサー、生物医学イメージング、薬物送達、そして触媒といった広範な応用が検討されている。このような点からMOFは潜在的に生体内へ導入が可能であると判断できる。その多孔性はサイズの大きい生体分子を排除し、原料のみを狙って反応させることができる“隔離された”反応環境を提供できると考えた。また適切なキラルルイス酸骨格を設計することで、金属イオンの漏出を抑制して立体選択的な分子変換を企図した。
自己組織化により合成されたMOFはエポキシドの不斉開環反応に対して高い触媒活性を示し、水中で立体選択的にアミノアルコールを得ることができる。キラルルイス酸骨格を構成する金属塩として当研究室で過去に開発されたドデシル硫酸スカンジウム(注5)を用いており、このアニオン部位がMOFの安定化に寄与していることが示唆されている。疎水性原料を用いているにも拘わらず、有機溶媒中では反応活性や立体選択性が大きく低下してしまう、非常に興味深い特徴を有している。生体寛容性の指標を得るべく、タンパク質共存下での検討を行った(図1)。比較のためにMOF触媒のキラルルイス酸骨格を切り出した小分子を用意したが、これは界面活性剤として機能しミセル(注6)を形成してその疎水性コアで反応が進行する。特に、タカジアスターゼ(注7)の共存下、ミセル触媒では被毒を受けて一切反応が進行しないのに対して、MOF触媒を用いると高立体選択的に反応が進行することを見出した。これはMOF触媒が想定された通りの被毒耐性を有することを意味している。
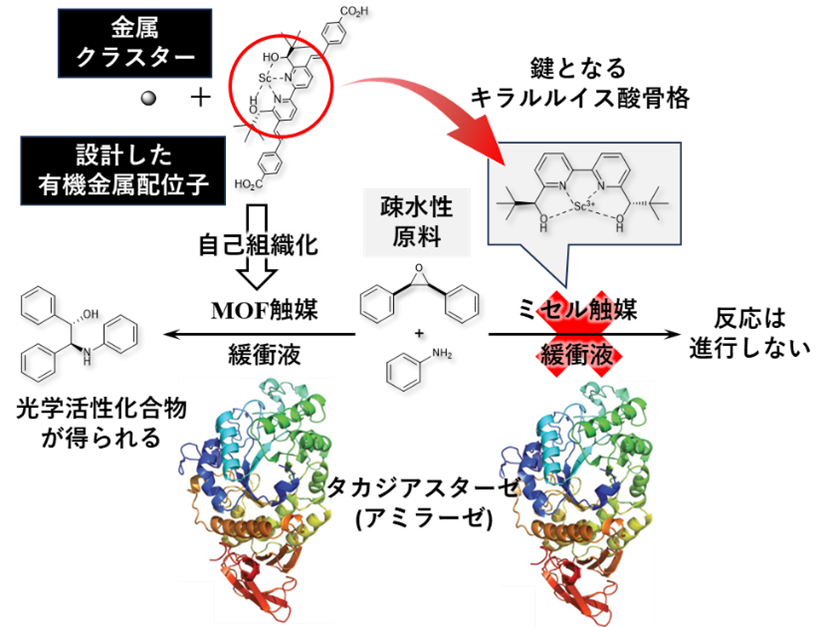
図1:タンパク質による被毒耐性実験
今回開発したMOF触媒と化学的に同じ骨格を有するミセル触媒との比較
今後の展望
本研究成果は、生体内化学反応ネットワークにキラルルイス酸触媒を組み込むための重要な技術基盤と考えられる。今後はこの新規プラットフォームの更なる深化を摸索し、酵素反応とのカスケード反応プロセスを実現することで、様々な応用に寄与することが期待される。
論文情報
- 雑誌名
Chemical Science論文タイトル
Nanoscale and Chiral Metal–Organic Framework for Asymmetric Reactions in Water: Bridging Lewis Acid Catalysis to Biological Systems著者
Watchara Srimontree, Taku Kitanosono,* Yasuhiro Yamashita and Shū Kobayashi*DOI番号
10.1039/d4sc01343c
研究助成
本研究は、新学術領域研究「高分子を活用するユビキチン選択的認識・標識法の開発(課題番号:JP19H05288)」、及び科研費基盤研究S「水を中心とする有機化学=アクア有機化学の構築(課題番号:JP22H04972)」の支援により実施されました。
用語解説
注1 キラルルイス酸触媒
カルボニル化合物等の電子豊富な化合物の非共有電子対を受け取ることで、反応性を飛躍的に向上させることのできる触媒で、主にカチオン性の金属錯体が用いられる。特に、金属錯体の配位子としてキラル化合物を用いることで触媒活性種の立体環境を制御し、不斉反応が可能となる。このように僅かなキラル源を用いてアキラルな分子から光学活性分子を合成することは触媒的不斉合成と呼ばれ、現代有機化学の重要な技術の一つ。
注2 有機金属構造体MOF
剛直な有機配位子と金属クラスターとの間で錯体形成を行うことで得られる、周期性の高い結晶性化合物。
注3 グルタチオン
3つのアミノ酸(グルタミン酸、システイン、グリシン)から成るトリペプチド。ほぼ全ての好気性生物の細胞内に高濃度で存在しており、活性酸素種を還元するほか、チオール部位の求核性によって有毒な求電子体との抱合反応により、細胞を保護する。
注4 ルイス塩基
ルイス酸とは逆に、電子供与体のこと。ルイス酸と容易に反応する。タンパク質に含まれるチオールやアミンなどの官能基は強いルイス塩基として作用する。
注5 ドデシル硫酸スカンジウム
水中ではミセル(注6)を形成することで、疎水性原料を反応させることができる。当研究室で1998年に報告した、典型的なルイス酸-界面活性剤一体型触媒。今回の研究ではMOFの中に孤立して担持させることによって、ミセルではない新規利用法の開拓に成功した。
注6 ミセル
水溶液中で界面活性剤が一定の濃度以上になることで形成される、コロイド状の集合体。有機合成においては、有機溶媒を使用しない水中で、水には溶けない疎水性原料を反応させる際に用いる手法の一つ。
注7 タカジアスターゼ
1894年に高峰譲吉博士が麹菌より抽出に成功した。唾液や膵液に含まれるアミラーゼの別称。