2019-03-19 理化学研究所,慶應義塾大学医学部
理化学研究所脳神経科学研究センター発生神経生物研究チームの松浦徹研究員(現在、関西医科大学医学部実験病理学講座講師)と理化学研究所脳神経科学研究センター発生神経生物研究チーム、チームリーダー 兼 慶應義塾大学医学部薬理学教室客員教授の御子柴克彦の研究チームは、マウスの受精の際に受精卵内で放出されたカルシウムイオンが、ポジティブフィードバックにより、さらにカルシウムイオンを放出させることで、数時間もの間カルシウムイオン濃度の振動(カルシウム振動)を維持する新しい仕組みが存在することを明らかにしました。
ヒトを含むほとんどの哺乳動物種において、排卵された卵子は減数第二分裂中期で減数分裂を停止しているが、精子との受精により活性化し、発生を開始します。この卵子の活性化を引き起こすのが、カルシウム振動です。
受精によって卵の中のカルシウムイオン濃度は上昇・下降を繰り返し、これによって卵子の表層顆粒の放出、細胞分裂抑制因子の不活性化、第二極体放出、そして前核形成という卵活性化が引き起こされていきます。カルシウム振動は数時間にわたって維持され、カルシウム振動の持続時間と胚の発生には関係があることが知られており、カルシウム振動を維持することは胚の正常な発生に重要です。
研究チームは、まず卵内のカルシウムイオン濃度を上昇させる物質であるイノシトール 3 リン酸(IP3)とカルシウムイオンを可視化するための遺伝子導入可能な新しいセンサーを開発しました。
新しい IP3センサーはこれまでのものと比較して 10 倍の感度を持ち、受精卵内の微小な IP3 濃度変化を世界で初めて捉えることに成功しました。またこの IP3センサーと共に用いることのできるカルシウムセンサーも開発しています。
研究チームはこれらのセンサーを用いて受精卵内の IP3とカルシウムイオン濃度変化の測定を行い、カルシウムイオン濃度上昇によって IP3を産生するホスホリパーゼ C 酵素が活性化し、さらに IP3の産生を起こすことを明らかにしました。つまり、このカルシウム―ホスホリパーゼ C -IP3によるポジティブフィードバックによって、受精後の卵内に IP3が蓄積し、長時間のカルシウム振動を維持し、正常な胚の発生を促すことが分かりました(図 1)。
本研究成果は 2019 年 3 月 18 日(月)(英国時間)に、英科学誌「Scientific Reports」(オンライン版)に掲載されました。
ポイント
・受精卵内のカルシウムイオン濃度をコントロールするイノシトール 3 リン酸(IP3)とカルシウムイオンに対する新しい遺伝子導入型センサーを開発。
・受精卵の IP3によりカルシウムイオン濃度が上昇し、それによってさらに IP3が産生されるポジティブフィードバックによって、受精卵内の周期的なカルシウムイオン濃度上昇(カルシウム振動)が数時間維持され、胚の正常な発生を促す。
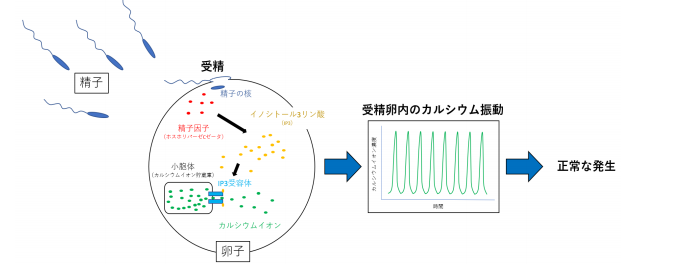
図 1. 受精によるカルシウム振動の誘発。精子と卵子が受精により融合すると、精子からは父親からの遺伝子を運ぶ精子の核に加えて、精子因子としてホスホリパーゼ C ゼータが、卵子の中に侵入する。ホスホリパーゼ C ゼータはイノシトール 3 リン酸(IP3)を産生し、IP3受容体に作用する。IP3受容体は卵内のカルシウムイオン貯蔵庫である小胞体から、カルシウムイオンを放出する。この一連の反応により、受精卵内では数時間にわたって、カルシウムイオン濃度が上昇下降を繰り返すカルシウム振動が起こり、卵子の活性化、正常な胚の発生を促す。
【背景】
カルシウムは、私たちの骨格を構成する主要元素であるとともに、細胞内において情報を伝達する物質として重要な働きをしています。細胞内には極微量のカルシウムイオンしかなく、カルシウムイオン濃度は通常、細胞外の 10,000 分の 1 程度に保たれています。しかしながら、細胞外から刺激が加わると、細胞中にある小胞体に蓄積されていたカルシウムイオンが放出され、細胞内のカルシウムイオン濃度は 1,000~10,000 倍にも増加します。
細胞外から刺激を受け取った細胞を詳しく観察すると、刺激に伴い細胞内のカルシウムイオン濃度が急激に上昇した後、緩やかに元の濃度に戻るスパイク状の時間変化(カルシウムスパイク)を引き起こします。また多くの細胞では、このカルシウムイオン濃度の変化が周期的に繰り返し引き起こされる現象が見られます。これらの現象は、カルシウム振動と呼ばれ、生命現象の始まりである受精後の卵子の活性化を引き起こすとともに、神経活動、ホルモンや消化酵素の放出や、免疫、遺伝子発現など広範な生理機能に関わっていると考えられています。
卵子が受精すると精子から卵子の中に精子の中にだけ存在する精子因子である酵素ホスホリパーゼ C ゼータが侵入し、イノシトール 3 リン酸(IP3)を産生します。この IP3が小胞体の表面に存在し、Ca2+の放出を調整するカルシウムチャネルである IP3受容体に作用(結合)することにより、受精卵内のカルシウムイオン濃度の振動を引き起こすことが提唱されており、これを精子因子仮説といいます。卵子は減数第二分裂中期で減数分裂を停止していますが、精子との受精により活性化し、発生を開始します。
受精卵内のカルシウムイオン濃度は上昇と下降を繰り返すカルシウム振動を起こします。カルシウム振動の仕組みとして 2 つの仮説が立てられています。①カルシウムイオン濃度の上昇を引き起こす IP3の濃度が周期的に変化することによって、カルシウム振動が引き起こされるという仮説。 ②IP3受容体の活性がカルシウムイオン濃度変化によっても制御されることから、周期的な IP3のスパイクがなくとも IP3受容体がカルシウム振動を作り出すことができるという仮説です。研究チームは 2006 年に遺伝子導入型の蛍光 IP3センサー、IRIS-1 を開発し、それを用いた観察により、体細胞では 2 番目の仮説である、周期的な IP3のスパイクがなくとも IP3受容体がカルシウム振動を作り出すことができるということを示すことができましたが(Matsu-ura et al. J CELL BIOL. 2006)、受精卵でのカルシウム振動の仕組みは明らかになっていませんでした。また体細胞でのカルシウム振動と比べて、受精卵でのカルシウム振動は長く続きますが、どのような仕組みで数時間もの間カルシウム振動が維持されるのかは明らかになっていませんでした。
【研究手法と成果】
(1)新しい IP3センサーとカルシウムセンサーの開発
受精卵内の IP3濃度を測定しようという試みはこれまでもなされていましたが、十分な感度がなく、明確な結果が得られていませんでした。研究チームは 2006 年に遺伝子導入型の蛍光 IP3センサー、IRIS-1 を開発していましたが、これを今回改良した IRIS-2.3 では、最大変化量を 2 倍、感度を 10 倍に増大させることに成功しました。IRIS-2.3 は IP3を感知することで、緑色蛍光タンパク質(EGFP)と赤色蛍光色素(HaloTag TMR)との間の蛍光エネルギー移動(FRET)の効率の変化が起こり、発する光の色が変化する仕組みになっています(図 2a)。また研究チームでは IRIS-2.3 と一緒に用いることのできる青色カルシウムセンサーDYC3.60 の開発も行いました。DYC3.60 はカルシウムイオンを感知することで、青色蛍光タンパク質(ECFP)の発する光を蛍光のクエンチャ― (cp173V-Y145W)が消光することで、発する光の強さが変化する仕組みになっています(図 2b)。
これらの新しい蛍光センサーを用いることにより世界で初めてマウスの受精卵で起こる IP3とカルシウムイオン濃度の変化を同時に、そして長時間にわたって観察することが可能となりました。
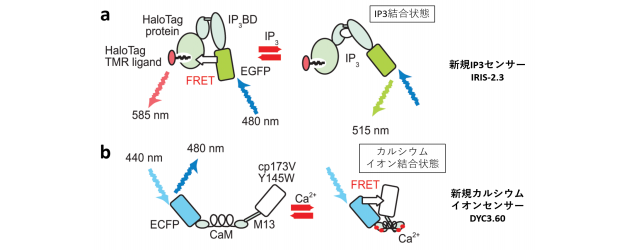
図 2. 遺伝子導入可能な新規 IP3 センサーと新規カルシウムイオンセンサーの開発。(a)IP3センサーは、受精卵内の IP3濃度が上がると、緑色蛍光タンパク質(EGFP)から赤色蛍光色素(HaloTag TMR)への蛍光エネルギー移動(FRET)効率が下がり、赤い光の強度が弱くなる。(b)カルシウムイオンセンサーはカルシウムイオンと結合すると、青色蛍光タンパク質(ECFP)から蛍光のクエンチャ―(cp173V Y145W)への蛍光エネルギー移動(FRET)効率が上がり、青い光の強度が弱くなる。
(2)受精直後の IP3濃度変化
精子因子仮説では、卵子が精子と出会うと精子から精子因子としてホスホリパーゼ C ゼータが侵入し、卵子内で IP3を産生、さらに IP3受容体からのカルシウムイオン放出を引き起こし、カルシウム振動が始まると推定されています。研究チームが新しい IP3センサー、IRIS-2.3 による観察を行ったところ、平均で 2.7 分カルシウムイオン濃度の上昇に先立って IP3濃度上昇が起こることが確認されました(図 3a)。
研究チームによるこの成果は精子因子仮説を証明するための最後の欠けていたパーツを補うものであり、精子因子仮説の正しさを示すことができました。またカルシウムイオン濃度の上昇によりホスホリパーゼ C ゼータを含むホスホリパーゼ C 酵素群が活性化し、さらなる IP3産生が促進される現象も観察されました(図 3a、c)。
(3)受精後のカルシウム振動の仕組み一度上昇した IP3濃度は、カルシウム振動中一定の濃度以上に保たれます(図 3b)。またカルシウム振動でカルシウムスパイクが起こると、それに遅れて IP3濃度が小さく上昇下降を繰り返す様子も観察されました(図 3b)。最初にカルシウム振動を引き起こすときには IP3濃度上昇が先んじますが、その後は常に IP3濃度変化はカルシウムイオン濃度変化を追いかける形で推移することから、カルシウム振動の維持には IP3濃度が一定以上に保たれることが重要と考えられます。このことから受精卵内で観察されるカルシウム振動も、体細胞のカルシウム振動と同じく、周期的な IP3 のスパイクがなくとも IP3受容体がカルシウム振動を作り出すことができるということが分かりました。加えてカルシウムスパイクが起こるごとにカルシウムイオン濃度の上昇によりホスホリパーゼ C が活性化し、さらなる IP3産生が促進されることから、カルシウム―ホスホリパーゼ C-IP3によるポジティブフィードバックによって、受精後の卵内に IP3が蓄積することが、長時間のカルシウム振動を維持することに繋がっていることが示唆されました(図 3c)。受精後のカルシウム振動の持続時間と胚の発生には密接なつながりがあることが分かっており、今回発見したカルシウム振動を持続させる仕組みは、胚の正常な発生に大きく貢献していると考えられます。
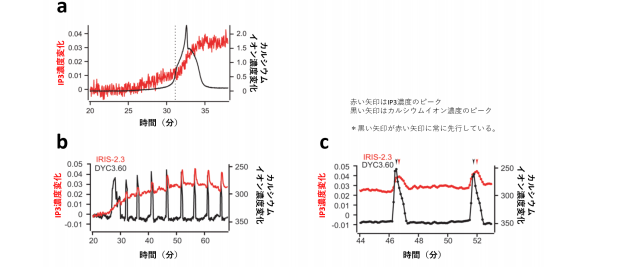
図 3. 受精卵での IP3とカルシウムイオンの変化。(a)受精直後に先に IP3濃度が上昇し、それによってカルシウムイオン濃度が上昇する。点線以降(カルシウムイオン濃度上昇以降)IP3濃度上昇速度が速まる。(b)カルシウム振動中は IP3濃度が高いまま維持される。またカルシウム振動スパイクごとに微小な IP3濃度上昇下降が観察される。(c)微小な IP3濃度変化はカルシウムイオン濃度の変化を追いかけるように起こる。これらはカルシウムイオン濃度上昇によって IP3を産生する酵素ホスホリパーゼ C の活性が変化するためであることが示唆された。 5/5
【今後の期待】
今回開発した感度の高い IP3センサー、IRIS-2.3 により、世界で初めて受精卵内の IP3濃度変化を観察することができました。このことから、今回の受精卵のように、ヒトの体の中ではこれまで考えられていたよりも低い濃度で IP3濃度変化が起こり、それによりカルシウムイオン濃度変化が誘発されていることが示唆されました。カルシウムイオン濃度変化はさまざまな細胞の機能発現に重要な役割を担っており、IRIS-2.3 を用いた観察により、これまでわからなかったカルシウムイオン濃度の制御の仕組みを神経細胞等の他の重要な細胞でも解き明かしていくことが期待されます。
また研究チームが開発した DYC3.60 は IRIS-2.3 と同時に遺伝子導入することにより、細胞や生物個体内での長時間の観察を行うことのできる技術として活用されていくことが期待できます。
論文情報
タイトル:Dual-FRET imaging of IP3 and Ca2+ revealed Ca2+-induced IP3 production maintains long lasting Ca2+ oscillations in fertilized mouse eggs
著者名:松浦徹1 , 白川英樹2 , 鈴木健一3 , 宮本章歳4 , 杉浦琴美5 , 道川貴章6 , 楠見明弘7 , 御子柴克彦1,8,9 (1 理化学研究所脳神経科学研究センター, 2 電気通信大学, 3 岐阜大学, 4 京都大学, 5 東京大学医科学研究所, 6 理化学研究所光量子工学研究センター, 7 沖縄科学技術大学院大学, 8 慶應義塾大学医学部、9 上海科技大学)
雑誌名:Scientific Reports(オンライン版)
(お問い合わせ先)
<研究内容について>
理化学研究所脳神経科学研究センター発生神経生物研究チーム、チームリーダー
慶應義塾大学医学部薬理学教室 客員教授
御子柴 克彦(みこしば かつひこ)
<報道について>
理化学研究所 広報室 報道担当
慶應義塾大学信濃町キャンパス 総務課


