2024-09-06 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの岡田 匡央 研究員(研究当時)、山﨑 哲 研究員、清水 佳奈子 上級研究員、藤井 眞一郎 チームリーダー(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)の研究チームは、マウスモデルを使った実験により、抗がん剤に対する耐性を持ったがん細胞変異によって生じた免疫原性の高いネオ抗原[1]は、通常のがん細胞に生じるネオ抗原よりも、免疫系に認識されやすい機能性が促進されていることを明らかにしました。
本研究成果により、抗がん剤耐性になった状態の難治性の腫瘍においてもネオ抗原を用いた免疫療法による治療効果が期待できます。
今回、研究チームはベムラフェニブ[2]耐性(薬剤耐性)ARID1A欠損腫瘍に対して免疫チェックポイント阻害剤(ICB)[3]を用いた免疫療法を行ったところ、免疫応答性が増え、さらに応答性の高いネオ抗原が増加していることを見いだしました。これらのネオ抗原を提示させた樹状細胞(DC)[4]療法とICBとの併用療法は抗腫瘍効果をより高めることを示しました。この結果は、薬剤耐性になった難治性がん細胞に対して免疫療法が有望な治療法となり得ることを示唆しています。
本研究は、科学雑誌『Cancer Research』オンライン版(9月4日付)に掲載されました。
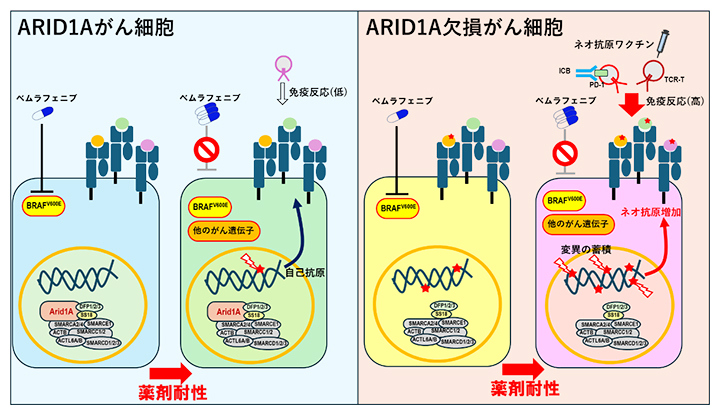
ARID1A欠損がん細胞における薬剤耐性に伴う免疫原性の高いネオ抗原の増加
背景
BRAF[5]の持続的活性変異は、しばしば黒色腫や大腸がんにおける腫瘍形成の主な原因となります。中でも典型的なBRAFV600E[5]変異は、最も頻度の高い発がん性変異であり、調節不能なマイトジェン活性化プロテインキナーゼ(MAPK)[6]増殖シグナルを引き起こします。この変異に対する選択的阻害剤であるベムラフェニブなどの抗がん剤は、進行期の悪性黒色腫(メラノーマ)の有効な治療法として、多くの患者の生存期間を延ばしましたが、メラノーマは薬剤耐性を獲得し再発することが知られています。さまざまな耐性メカニズムが臨床および実験結果によって同定されていますが、耐性を克服する効果的なアプローチはいまだ確立されていません。
抗PD-1抗体[3]の投与に代表される免疫チェックポイント阻害剤(ICB)療法は、T細胞[7]の抑制シグナルをブロックし、腫瘍を標的とするT細胞を再活性化します。一方、腫瘍の体細胞変異に由来するネオ抗原は、がん細胞特異的に発現し、非自己としてT細胞の免疫標的になるため、多くの臨床研究においてネオ抗原の数とICB療法に相関があることが明らかになっています。
ARID1A(AT-rich interactive domain 1a)は腫瘍抑制因子と見なされています。このため、ARID1Aの欠損が腫瘍を変化しやすくし、ICB療法に対する効果に関与していると考えられています。ARID1Aの欠損と腫瘍免疫療法の臨床結果を結び付けるメカニズムを理解することは、ARID1A変異腫瘍患者におけるICB療法の正確な予測につながり、また難治性の腫瘍に対する代替治療法の開発にも役立つと期待できます。
本研究では、メラノーマの代表的治療薬であるBRAF阻害剤に対してがん細胞が耐性になった場合において、遺伝子ARID1Aの発現に焦点を当てた免疫効果を研究しました。第一に、BRAFV600E変異株(親株)を樹立し、さらにARID1A欠損株と、それぞれに対するBRAFV600E阻害剤であるベムラフェニブ耐性(薬剤耐性)株を樹立しました。第二に、ARID1A欠損と薬剤耐性が抗PD-1抗体治療による抗腫瘍免疫応答に及ぼす影響を検討しました。第三に、薬剤耐性の間に新しく生成されたネオ抗原がワクチンによる免疫療法の標的として利用できるかどうかを検証しました。
研究手法と成果
研究チームはまず、hBRAFV600E改変マウスからBRAFV600E変異メラノーマ(以下、親株)を樹立し、ゲノム編集によるARID1A欠損BRAFV600E変異メラノーマ(以下、ARID1A欠損株)を作製しました(図1A)。これらの細胞をARID1A抗体とGAPDH[8]抗体を用いて処理し、ウエスタンブロット解析[9]を行ったところ、親株およびARID1A欠損株では、実際にARID1Aの欠損を確認し(図1B)、in vitro(試験管内)ではベムラフェニブに対して同様の感受性を示しました。さらに、親株およびARID1A欠損株を5マイクロモーラー(μM、1μMは100万分の1モーラ、1M=1mol/L)のベムラフェニブを含む培地で8週間培養することで、親株およびARID1A欠損株メラノーマのBRAF阻害剤耐性(薬剤耐性)がん細胞を樹立しました。
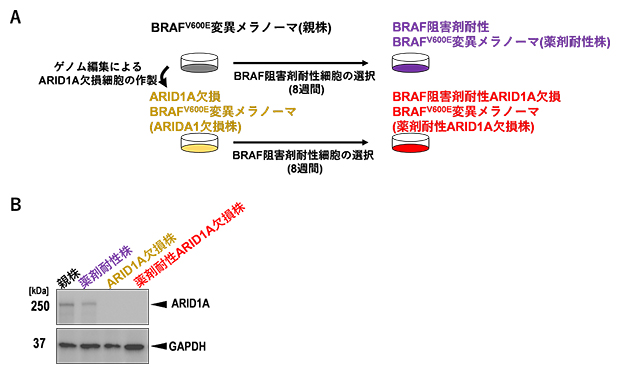
図1 親株および薬剤耐性ARID1A欠損株の樹立
(A)親株(BRAFV600E変異メラノーマ)およびARID1A欠損株(ARID1A欠損BRAFV600E変異メラノーマ)からBRAF阻害剤耐性(薬剤耐性)がん細胞を樹立するスキーム。親株およびARID1A欠損株を、5μMのベムラフェニブ下で8週間以上培養しながら選択し、薬剤耐性株(BRAF阻害剤耐性BRAFV600E変異メラノーマ)および薬剤耐性ARID1A欠損株(BRAF阻害剤耐性ARID1A欠損BRAFV600E変異メラノーマ)を樹立した。
(B)各メラノーマ細胞のARID1Aタンパク質発現を確認するためのウエスタンブロット解析。ゲノム編集による遺伝子ノックアウトを確認するため、細胞溶解液をARID1A抗体およびGAPDH抗体を用いて処理した。
次に、樹立した親株、薬剤耐性株、ARID1A欠損株、薬剤耐性ARID1A欠損株をマウスに投与した結果、ARID1A欠損株、薬剤耐性ARID1A欠損株の腫瘍増殖は、それぞれ親株、薬剤耐性株よりも速く増殖したことから、ARID1Aの腫瘍抑制的な役割が示唆されました(図2)。興味深いことに、抗PD-1抗体投与による持続的な抗腫瘍効果は、薬剤耐性ARID1A欠損株では観察されましたが、薬剤耐性株では観察されませんでした(図2)。また腫瘍浸潤リンパ球のフローサイトメトリー解析[10]から、薬剤耐性ARID1A欠損株は抗PD-1抗体の投与によりIFN-γおよびTNF-α産生CD8陽性(CD8+)T細胞[7]が増加することが示されました。
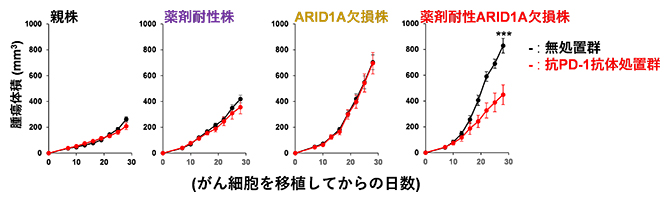
図2 抗PD-1抗体による抗腫瘍効果の4種類の株における比較
親株、薬剤耐性株、ARID1A欠損株、薬剤耐性ARID1A欠損株それぞれについて、マウスにがん細胞(5×105個/マウス)を皮下注射し、がん細胞投与後7、10、13、16日目に抗PD-1抗体を投与(抗PD-1抗体処置群)または非投与(無処置群)で腫瘍の増殖を測定した。
さらに、これら4種類の腫瘍の免疫原性(免疫の抗原の強さの程度)を比較しました。100グレイ(Gy)の放射線照射により不活化したがん細胞を静脈注射したマウスから、がん細胞投与後7日目に脾臓(ひぞう)を回収しCD8+T細胞を分離し、抗原特異的CD8+T細胞の誘導をELISpot(エリスポット)アッセイ[11]で解析しました(図3A)。刺激には、がん細胞と免疫反応を増強するPoly(I:C)[12]を投与したマウス由来の樹状細胞を用いました。その結果、薬剤耐性ARID1A欠損株を投与したマウスのサイトカインIFN-γ産生CD8+T細胞数が、他の3群よりも多いことが示されました(図3B)。すなわち、薬剤耐性ARID1A欠損株は、親株やARID1A欠損株と比較して高い免疫原性を示すことが明らかになりました。
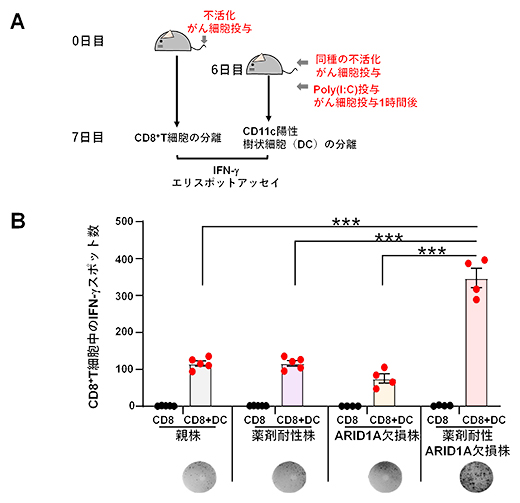
図3 薬剤耐性ARID1A欠損株における免疫応答の増強
(A)ELISpotアッセイのプロトコール。100Gyの放射線照射により不活化したがん細胞(1×106個/マウス)を静脈注射したマウスから、7日後にCD8+T細胞を脾臓から分離した。一方、試験開始6日目に無処理の別のマウスに同種の不活化したがん細胞(5×106個/マウス)を静脈注射し、1時間後にPoly(I:C)を投与した後、13時間後に脾臓からCD11c陽性樹状細胞(DC)を分離した。CD8+T細胞とDCを共培養して、IFN-γ産生CD8+T細胞を検出した。
(B)CD8+T細胞単独(CD8)およびCD8+T細胞とDC共培養(CD8+DC)におけるIFN-γスポット数。下段に各細胞株の代表的なスポット写真を示す。
ARID1Aの欠損は、患者のARID1A非変異腫瘍と比較して体細胞突然変異の蓄積を促進します。薬剤耐性を獲得した後のDNA変異について調べ、薬剤耐性ARID1A欠損株における特異的なミスセンス変異[13]の増加が明らかになりました(図4A)。これらのミスセンス変異における潜在的なネオ抗原を解析するため、変異ペプチド配列を調べるとともに、クラスⅠ分子(H-2KbとH-2Db)との親和性を予測しました(図4B)。その結果、高い親和性が予測されるネオ抗原は薬剤耐性ARID1A欠損株に集中し、がん細胞特有のネオ抗原の数も薬剤耐性ARID1A欠損株で最も多いことが分かりました。
また、薬剤耐性ARID1A欠損株の免疫原性ネオ抗原を特定し、選択するため、18個の変異ペプチドを合成し、スクリーニングにより薬剤耐性ARID1A欠損株特異的な免疫原性変異ペプチドを同定しました。この変異ペプチドによる免疫応答について、変異ペプチドを投与したマウスの脾臓細胞をin vitroで再刺激し、CD4+T細胞およびCD8+T細胞の活性化をサイトカイン(IFN-γ、TNF-α)の産生と活性化マーカー(PD-1、CD137)の発現で評価しました。その結果、薬剤耐性ARID1A欠損株特異的な免疫原性ネオ抗原が変異特異的な免疫応答を誘導することが示されました(図4C)。
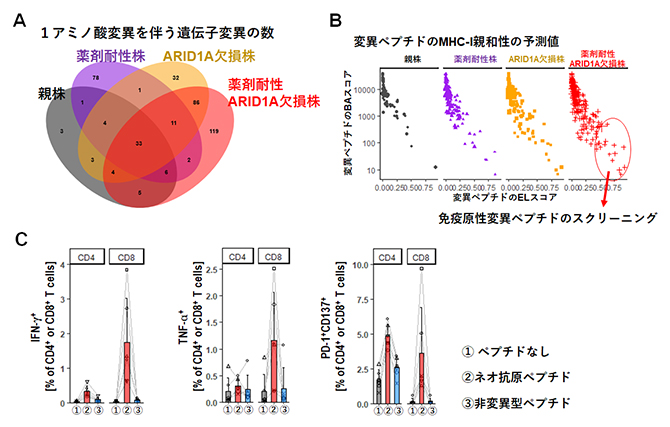
図4 ARID1A欠損株のベムラフェニブ耐性獲得後の変異およびネオ抗原
(A)各メラノーマ細胞株における1アミノ酸変異を伴う遺伝子変異数のベン図。
(B)変異ペプチドのMHC-Ⅰ親和性の予測値を分析するため、結合安定性の評価指標のELスコア(x軸)と、親和性予測値のBAスコア(y軸)をプロットした。薬剤耐性ARID1A欠損株の免疫原性ネオ抗原を選択するために丸で囲った18個の変異ペプチドをスクリーニングし、薬剤耐性ARID1A欠損株特異的な免疫原性変異ペプチドを同定した。
(C)薬剤耐性ARID1A欠損株特異的な免疫原性変異ペプチド(ネオ抗原ペプチド)を投与したマウスの脾臓細胞を、それぞれ6時間と24時間のin vitro再刺激後にサイトカイン産生と活性化マーカー発現の解析を行った。①灰色:DMSO(ペプチドなし)、②赤色(ネオ抗原ペプチド)、③青色(非変異型ペプチド)。
最後に、薬剤耐性ARID1A欠損株に新たに出現した免疫原性ネオ抗原がワクチン接種によって治療効果をもたらすかどうかを検討しました。薬剤耐性ARID1A欠損株を皮下注射したマウスに、薬剤耐性特異的ネオ抗原ワクチンを腫瘍投与後7日目、14日目の2回、投与しました。抗PD-1抗体との併用療法では、抗PD-1抗体を腫瘍投与後7日目、10日目、13日目、16日目の4回投与しました(図5A)。無処置のマウスと比較して薬剤耐性特異的ネオ抗原ワクチンを接種したマウスで腫瘍サイズの縮小が観察され、薬剤耐性特異的ネオ抗原ワクチンと抗PD-1抗体併用療法のマウスではより高い抗腫瘍効果が確認されました(図5B)。この結果と一致して、無処置のマウスと比較して薬剤耐性特異的ネオ抗原ワクチン接種のマウスで生存期間が延びており、併用療法のマウスではより生存期間が延びました(図5C)。以上の結果から、薬剤耐性ARID1A欠損株に新たに出現した薬剤耐性特異的ネオ抗原は、ワクチンによる抗腫瘍反応を誘導することが示唆されました。
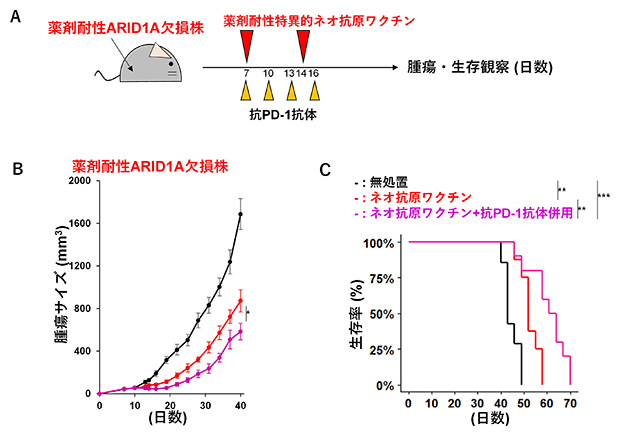
図5 薬剤耐性特異的ネオ抗原ワクチンによる抗腫瘍反応誘導
(A)薬剤耐性ARID1A欠損株に新たに出現した免疫原性ネオ抗原がワクチン接種によって治療効果をもたらすかどうかを検討するための実験スキーム。薬剤耐性ARID1A欠損株を皮下注射したマウスに、薬剤耐性特異的ネオ抗原ワクチンを腫瘍投与後7日目、14日目の2回投与あるいは抗PD-1抗体を腫瘍投与後7日目、10日目、13日目、16日目の4回投与を行う併用療法を実施した。
(B)無処置(黒)、ネオ抗原ワクチン(赤)、およびネオ抗原ワクチンと抗PD-1抗体併用療法(マゼンタ)のマウスにおける薬剤耐性ARID1A欠損株の腫瘍サイズ。
(C)(B)の各群のマウスにおける生存曲線。
今後の期待
本研究において、薬剤耐性ARID1A欠損株で抗PD-1抗体治療による抗腫瘍免疫応答が増強されることを観察しました。また薬剤耐性獲得の間に蓄積した体細胞変異に由来するネオ抗原は、ARID1A欠損株で高発現し、腫瘍の免疫原性を促進することを明らかにしました。そして、これらの新しく生成されたネオ抗原がワクチンによる免疫療法の標的として利用できる可能性が示されました。薬剤耐性後に新たに出現したネオ抗原を用いた免疫療法は、難治性腫瘍の有望な治療法になり得ると期待できます。
補足説明
1.ネオ抗原
タンパク質をコードする遺伝子に変異が入ると、アミノ酸の異なるタンパク質が発現するようになる。その一部のペプチド配列ががん細胞の表面に提示されると、免疫細胞が非自己と認識し、がん細胞を攻撃できるようになる。このように体細胞変異から新たに生じたより免疫系に認識されやすいがん細胞特有の抗原をネオ抗原と呼び、免疫原性が高く、免疫チェックポイント阻害剤の効果が期待できる。
2.ベムラフェニブ
悪性黒色腫の治療に使用される分子標的薬の一つ。異常な細胞分裂を促す変異BRAFタンパク質の働きを抑制してがん細胞の増殖を抑える。
3.免疫チェックポイント阻害剤(ICB)、抗PD-1抗体
免疫チェックポイント阻害剤(ICB)は、T細胞の活性化を抑制する負の共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称で、T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。ICBはImmune Checkpoint Blockadeの略。抗PD-1抗体はICBの一種である。
4.樹状細胞(DC)
樹状突起を持つ白血球。未感作T細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。DCはDendritic Cellの略。
5.BRAF、BRAFV600E
細胞分裂を調節するタンパク質リン酸化酵素。BRAF遺伝子の変異がさまざまながん腫で報告されているため、細胞のがん化に関係するとされている。BRAFV600E変異は、BRAFタンパク質の異常な活性化を引き起こし、細胞増殖が制御されずに進行し、がんの発生に寄与することが知られている。hBRAFV600E改変マウスは、ヒトのBRAFV600E変異を導入したマウス。
6.マイトジェン活性化プロテインキナーゼ(MAPK)
細胞の増殖、細胞周期、発生などのさまざまなシグナル伝達系で働く、タンパク質リン酸化酵素。ERK1/2など複数の種類がある。MAPKはMitogen-activated Protein Kinaseの略。
7.T細胞、CD8陽性(CD8+)T細胞
T細胞は胸腺という組織で分化、成熟したリンパ球の一種。獲得免疫をつかさどり、抗原提示細胞から抗原情報を受け取ることで、さまざまな機能を発揮する。T細胞の中でCD8陽性T細胞は、細胞表面にCD8と呼ばれる特徴的なタンパク質を発現するもので、活性化するとキラーT細胞に分化し、ウイルス感染細胞やがん細胞を殺傷する役割を果たす。
8.GAPDH
細胞のエネルギー生産に関わる重要なタンパク質。細胞の中で安定して存在しているため、他のタンパク質の量を比較する基準として使われる。
9.ウエスタンブロット解析
電気泳動によって分離したタンパク質を特殊な膜に転写した後、ある特定の抗体(本研究ではARID1A抗体とGAPDH抗体)を利用することで目的タンパク質(ARID1Aタンパク質とGAPDHタンパク質)の存在を検出もしくは定量する方法。
10.フローサイトメトリー解析
多数の細胞を水中で一列に並べて流しながらレーザーで細胞を検出し、計数、選別する技術。細胞表面にあるタンパク質の有無や種類により、細胞をふるい分けることができる。
11.ELISpot(エリスポット)アッセイ
単一細胞レベルで分泌されたサイトカイン産生細胞数などを検出できる方法で、がんや感染症、自己免疫疾患などの疾患において抗原特異的免疫応答を評価するのに用いられる。
12.Poly(I:C)
RNAと似た構造の物質で免疫反応を賦活させる物質。血液中の細胞に実験的に免疫反応を引き起こすことができるため、免疫応答に関する研究に使用されている。
13.ミスセンス変異
DNA配列の変化により、発現するタンパク質のアミノ酸が置換される変異。変異によって異常タンパク質が合成され、遺伝子をコードするDNAの塩基配列の一つが変化することにより、発現するタンパク質のアミノ酸が置換される。ミスセンス変異が起きた遺伝子により発現するアミノ酸残基が一つ置換され、異常タンパク質が合成されるため、疾患の原因になることがある。
原論文情報
Masahiro Okada, Satoru Yamasaki, Hiroshi Nakazato, Yuhya Hirahara, Takuya Ishibashi, Masami Kawamura, Kanako Shimizu, and Shin-ichiro Fujii, “ARID1A-Deficient Tumors Acquire Immunogenic Neoantigens During the Development of Resistance to Targeted Therapy”, Cancer Research, 10.1158/0008-5472.CAN-23-2846
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
研究員(研究当時)岡田 匡央(オカダ・マサヒロ)
研究員 山﨑 哲(ヤマサキ・サトル)
上級研究員 清水 佳奈子(シミズ・カナコ)
チームリーダー 藤井 眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
報道担当
理化学研究所 広報室 報道担当