2024-10-31 理化学研究所
理化学研究所(理研)生命医科学研究センター 疾患エピゲノム遺伝研究チームの井上 梓 チームリーダーらの研究チームは、マウスを用いて、胎児の発育に向けて着床前胚の中で遺伝子のオフスイッチが作られる仕組みを解明しました。
本研究成果は、不妊症や不育症の原因解明や新たな着床前診断法の開発など、将来的に生殖補助医療に貢献することが期待されます。
受精から赤ちゃんの誕生へと至る複雑な発生過程では、”発生関連遺伝子”と呼ばれる数千個の遺伝子群が特定の発生段階や器官で適材適所に活性化します。この仕組みには、器官形成が始まる前にいったん全ての発生関連遺伝子を「オフ」にしておき、必要な場面でのみ「オン」にするというシステムが鍵を握ります。このオフスイッチの分子実体は、DNAを核内に収納するヒストンタンパク質への化学修飾(ヒストン修飾[1])です。本研究では、最新のテクノロジーを用いて、オフスイッチが着床前の初期発生過程で作り上げられる様子を初めて捉え、その機構の一端を明らかにしました。
本研究は、科学雑誌『Nature Cell Biology』オンライン版(10月31日付:日本時間10月31日)に掲載されました。
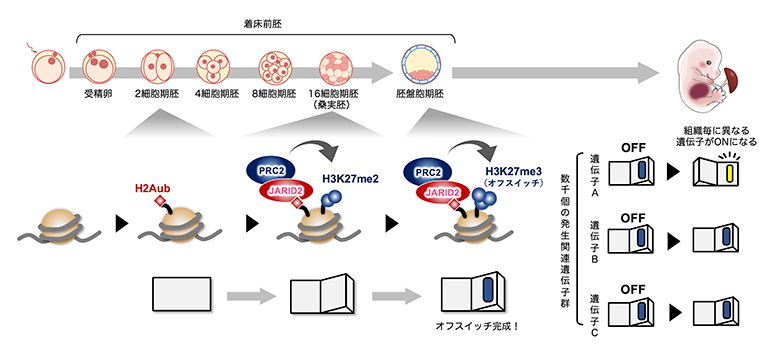
着床前の初期発生過程で段階的に作られるオフスイッチ
背景
卵子と精子が受精することで生命誕生に向けたプロセスが開始されます。一つの受精卵は2細胞、4細胞、…と分裂を繰り返し、哺乳類では、約100個の細胞から成る胚盤胞(はいばんほう)まで発生した後、着床に至ります。着床後にはさまざまな発生・分化シグナルに応じて器官が形成されます。
その過程では、特定の発生段階や特定の器官で数千個の重要な遺伝子(発生関連遺伝子群)が適材適所に活性化します。この巧妙な仕組みを働かせるためには、器官形成が始まる前にいったん全ての発生関連遺伝子をオフ状態にしておく必要があります。例えるなら、あらかじめ全ての部屋を消灯しておいて、使う部屋の電気だけをつけるイメージです。オフスイッチの分子本体は、DNAを核内に収納するヒストンタンパク質への化学修飾の一つ、H3K27(ヒストンH3の27番目リジン残基)のトリメチル化修飾(H3K27me3)[1]です。H3K27me3が適切に確立されないと、その後の器官形成に異常を来し、胚発生が停止してしまいます。そのため、初期発生過程でH3K27me3がどのように確立されるかという問題は発生学的に重要であり、注目を集めていました。しかし、ごく少数の細胞で構成される希少な初期胚のエピジェネティクス(後成遺伝学)解析には技術的な制約が多く、この問題は未解決でした。
研究手法と成果
発生関連遺伝子群のH3K27me3は胚盤胞期に確立し始めます。研究チームは、その確立に至る過程を詳細に調べることを目的に、H3K27me3の前駆体であるH3K27ジメチル化修飾(H3K27me2)[1]がいつどのように確立されるかを解析することにしました。そのために、500個程度の細胞からヒストン修飾のゲノム内分布を高解像度に分析できる最新の微量クロマチン免疫沈降シーケンス法[2]を用いて、マウスの着床前胚におけるH3K27me2の動態を調べました。その結果、H3K27me2はH3K27me3に先行する形で、8から16細胞期胚(桑実胚(そうじつはい))にかけて確立されることが分かりました(図1A、B)。
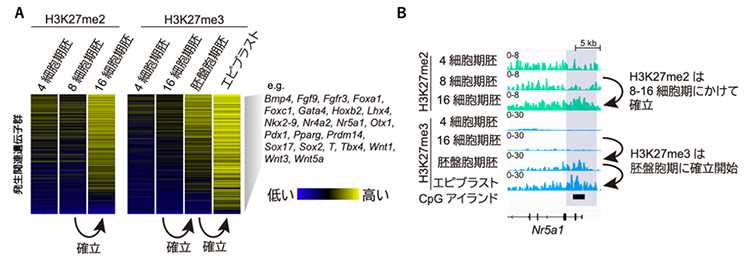
図1 発生関連遺伝子の転写開始点付近におけるH3K27me2、H3K27me3の動態
(A)約1,000個の発生関連遺伝子群のプロモーター領域におけるヒストン修飾の量をヒートマップで示す。右側の遺伝子名は発生関連遺伝子群の一部。
(B)代表的な遺伝子座のヒストン修飾量を示す。H3K27me2は8~16細胞期にかけて、H3K27me3は胚盤胞期以降に確立されることが分かる。
エピブラストは胚盤胞が着床した後、内部細胞塊から発達する細胞層。CpGアイランドはシトシン(C)とグアニン(G)の配列が集まっているポリコーム標的領域。
続いて、H3K27me2の確立を担う因子を同定するために、H3K27メチル化酵素であるポリコーム抑制複合体2(PRC2)[3]に着目しました。PRC2を構成するさまざまなサブユニットの遺伝子発現量を調べたところ、PRC2のサブタイプの一つPRC2.2[3]を構成するアクセサリーサブユニットであるJARID2の発現量が8細胞期以降で大きく上昇していました(図2A)。そこで再び微量クロマチン免疫沈降シーケンス法を用いて、16細胞期におけるJARID2とPRC2のコアサブユニットであるSUZ12のゲノム内分布を調べたところ、JARID2はSUZ12とともに発生関連遺伝子群に集積していることが分かりました(図2B)。
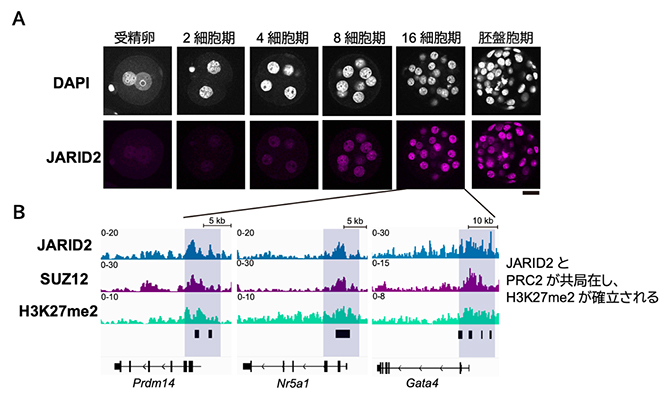
図2 着床前胚におけるJARID2の発現とゲノム内の分布
(A)JARID2抗体を用いた免疫染色の結果を示しており、JARID2の発現が8細胞期以降で大きく上昇することが分かる。DAPIはDNAを示す。右下のスケールバーは20マイクロメートル(μm、μmは100万分の1メートル)。
(B)16細胞期胚において、JARID2とH3K27me2に加えて、PRC2のコアサブユニットの一つであるSUZ12が発生関連遺伝子の制御領域に蓄積する。
JARID2がH3K27me2の確立に必要かどうかを調べるために、次にJarid2遺伝子を欠損させた胚を作製しました(図3A)。微量クロマチン免疫沈降シーケンス法による詳細な解析の結果、Jarid2欠損胚では発生関連遺伝子群へのPRC2の結合量が低下し、H3K27me2が確立されないことが分かりました(図3B、C)。さらにJarid2欠損胚では、胚盤胞期においてH3K27me3が確立されませんでした(図3D、E)。これらの結果から、JARID2を含むPRC2.2がH3K27メチル化の新規確立を担うことが分かりました。
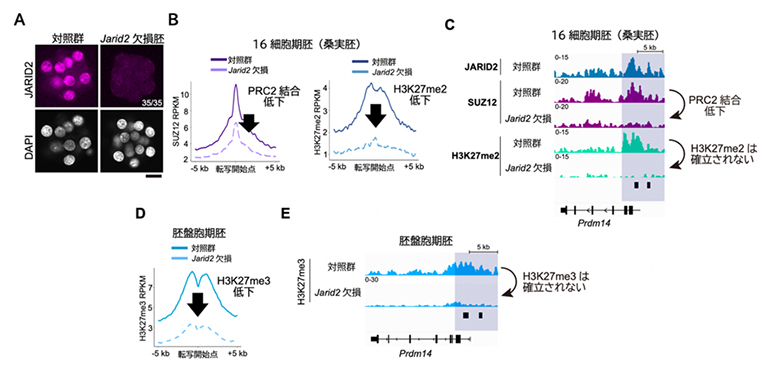
図3 Jarid2欠損胚におけるH3K27メチル化とPRC2のゲノム内分布
(A)桑実胚におけるJARID2の免疫染色。JARID2がノックアウトされていることが分かる。スケールバーは20μm。
(B、C)Jarid2欠損桑実胚では発生関連遺伝子におけるPRC2の結合が低下し、H3K27me2が確立されない。
(D、E)Jarid2欠損胚盤胞ではH3K27me3が確立されない。
JARID2はヒストンH2Aのモノユビキチン化修飾(H2Aub)に結合する活性を有します。井上チームリーダーらは以前の研究で、発生関連遺伝子には2細胞期の段階でH2Aubが導入されることを見いだしていました注1)。今回の研究での発見を合わせると、H3K27me3は、H2Aub→JARID2-PRC2.2→H3K27me2→H3K27me3という段階的な経路で新規確立されることが強く示唆されました(図4)。
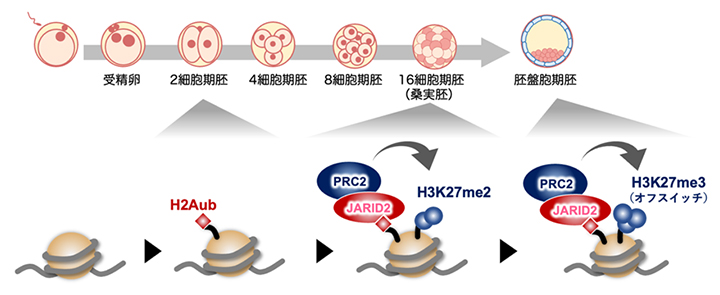
図4 H3K27me3の新規確立に至る分子経路のモデル
2細胞期に導入されたH2Aモノユビキチン化修飾(H2Aub)にJARID2が結合し、ポリコーム抑制複合体2(PRC2)がリクルートされて桑実胚期にH3K27me2が導入される。そして胚盤胞期にオフスイッチ(H3K27me3)ができ上がると考えられる。
注1)2021年4月6日プレスリリース「卵の記憶は胎盤へ」
Mei, H. et al. H2AK119ub1 guides maternal inheritance and zygotic deposition of H3K27me3 in mouse embryos. Nat. Genet. 53, 539-550 (2021).
今後の期待
着床前胚は一見単純な細胞塊のように映ります。しかし、実はその内部では、胎児の発育に向けて、ゲノム環境の整備を着々と進めていることが分かりました。本成果は、遺伝子オフスイッチの作られ方という基礎的で重要なテーマを解明しただけでなく、将来的に生殖医療にも貢献し得るものです。例えば、生殖補助医療では着床前胚を体外で扱ったり凍結させたりしますが、そのような操作がオフスイッチの確立にどのような影響を及ぼすかといった、新たな視点からの生殖医療研究につながることが期待されます。今後は同様の機構がヒトでも保存されているかどうかの解明が待たれます。
補足説明
1.ヒストン修飾、H3K27(ヒストンH3の27番目リジン残基)のトリメチル化修飾(H3K27me3)、H3K27ジメチル化修飾(H3K27me2)
DNAはヒストン8量体に巻き付いて核内に収納される。ヒストンにはH2A、H2B、H3、H4の4種類があり、ヒストンのN末端テールにさまざまな化学修飾が付加される(ヒストン修飾)。H3K27me3はヒストンH3の27番目のリジン残基(K)に三つのメチル基が付加(トリメチル化)したものであり、遺伝子抑制に働く。同様にH3K27me2はH3K27に二つのメチル基が付加(ジメチル化)したものであり、me3に向けた中間体としての役割の他に、遺伝子活性化に働くH3K27アセチル化を阻害する機能を有する。ヒストン修飾がクロマチン上の適切な場所に配置される機構については、現在世界中で活発に研究が行われている。本研究もその一つと位置付けられる。
2.微量クロマチン免疫沈降シーケンス法
クロマチン(染色体)を200~400塩基対(bp)ごとに細断し、特定のヒストン修飾やタンパク質に対する特異的抗体を用いてクロマチン断片を免疫沈降させる。免疫沈降させたクロマチン断片からDNAを抽出し、次世代シーケンサーでその配列を読むことで、ヒストン修飾やタンパク質の結合箇所を同定することができる。この手法には従来100万個以上の細胞が必要であったが、近年の技術革新の結果、1,000個以下の細胞でも解析可能な微量クロマチン免疫沈降シーケンス技術が確立されている。研究チームは、その黎明期から開発・応用に携わっており、世界最高水準の技術を有する。
3.ポリコーム抑制複合体2(PRC2)、PRC2.2
PRC2はH3のN末端から27番目のリジン残基(H3K27)にモノメチル→ジメチル→トリメチルの順に段階的にメチル基を付与する。PRC2はSUZ12を含むコアサブユニットと、クロマチンへの結合を制御するアクセサリーサブユニットから構成される。アクセサリーサブユニットの違いによりPRC2.1とPRC2.2という二つの異なる複合体を形成する(コアサブユニットは共通)。PRC2.2のアクセサリーサブユニットにはJARID2が含まれる。PRC2.1とPRC2.2がどのように使い分けられているかはよく分かっておらず、現在のポリコーム研究分野の焦点の一つとなっている。PRCはpolycomb repressive complexの略。
研究チーム
理化学研究所 生命医科学研究センター 疾患エピゲノム遺伝研究チーム
チームリーダー 井上 梓(イノウエ・アズサ)
テクニカルスタッフⅡ 公文 麻美(クモン・マミ)
大学院生リサーチ・アソシエイト 松若 正篤(マツワカ・マサヒロ)
研究支援
本研究は、文部科学省科学研究費助成事業新学術領域研究(研究領域提案型)「全能性プログラム:デコーディングからデザインへ(領域代表者:小倉淳郎)」における「全能性消失時のエピゲノム制御機構の解明(研究代表者:井上梓)」、RIKEN Pioneering Projects「Genome building from TADs(研究分担者:井上梓)」「Long-timescale molecular chronobiology(研究分担者:井上梓)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業PRIME「経世代ヒストン修飾を介した疾患素因の形成機構(研究代表者:井上梓)」、理研の大学院生リサーチ・アソシエイト制度による助成を受けて行われました。
原論文情報
Masahiro Matsuwaka, Mami Kumon and Azusa Inoue, “H3K27 di-methylation dynamics reveal stepwise establishment of facultative heterochromatin in early mouse embryos”, Nature Cell Biology, 10.1038/s41556-024-01553-1
発表者
理化学研究所
生命医科学研究センター 疾患エピゲノム遺伝研究チーム
チームリーダー 井上 梓(イノウエ・アズサ)
報道担当
理化学研究所 広報室 報道担当