2024-11-14 がん研究会,熊本大学,量子科学技術研究開発機構,PhytoMol-Tech株式会社
ポイント
- 通常、PARP阻害剤はBRCA1/2変異がんに対して使われますが、乳がんのBRCA1/2変異がんの割合は少なく、大多数のがんにPARP阻害薬を効
- くようにする方法の開発が望まれていました。
- 発芽大豆由来の低分子化合物グリセオリンIがミトコンドリア阻害剤として乳がんの代謝を変え、BRCA1/2を低下させ、傷ついたDNAを修復しにくい状態を作り上げることを見出しました。
- PARP阻害剤とミトコンドリア阻害剤を組み合わせることで、BRCA1/2変異を持たない細胞でもその増殖を抑えることを発見しました。正常細胞に対してはこの作用はありませんでした。
- トリプルネガティブ乳がんは、ホルモン受容体が存在しないため、ホルモン療法や分子標的治療の対象にならず、効果的な治療法が確立されていません。ミトコンドリア阻害剤とPARP阻害剤の併用は、特にトリプルネガティブ乳がんに効果的で、新しい治療法となる可能性があります。
概要
公益財団法人がん研究会 がん研究所がん生物部 斉藤典子部長、渡邉健司博士研究員、同じくがん化学療法センター 分子薬理部 旦慎吾部長、熊本大学 発生医学研究所 細胞医学分野 中尾光善教授および日野信次朗准教授、量子科学技術研究開発機構 櫻庭俊サブチームリーダー、河野秀俊副所長、PhytoMol-Tech Inc. 落合孝次代表らの共同研究グループは、乳がんにおいてミトコンドリアを標的とする低分子化合物が、がん特異的にBRCA1/2を失わせ、PARP阻害剤が効くようになることを初めて解明しました。
がんでは、エネルギー代謝の異常や、傷ついたDNAが増えることが知られています。
BRCA1/2は相同組み換え(注1)という方法で損傷DNAを修復するタンパク質で、PARP(ポリADPリボシル化酵素)と補完的に働きます。そのためPARP阻害薬は、BRCA1/2遺伝子に変異がある乳がんの増殖を抑え、これは「合成致死」(注2)とよばれます。しかしBRCA1/2変異がんの割合は少なく、大多数のがんに対してPARP阻害薬が効くようにする方法の開発が望まれていました。
本研究では、発芽大豆由来の低分子化合物グリセオリンIが、ミトコンドリアを阻害し、それにより乳がん細胞では、がん代謝物である乳酸が過剰産生され、BRCA1/2遺伝子の発現が抑制されることを見出しました。BRCA1/2変異がないにもかかわらず、相同組み換え能が低い状態「BRCAness」をもたらしますが、これは、正常細胞ではおきません。
本研究はミトコンドリアを標的とする低分子化合物が、がん特異的にBRCA1/2を失わせ、PARP阻害剤が効くようになることを見出しました。ミトコンドリア標的薬とPARP阻害剤を併用することで、がんを治療できる新しい可能性を提案します。
本研究の成果は、Science Signaling誌に、2024年11月13日付で公開されました。
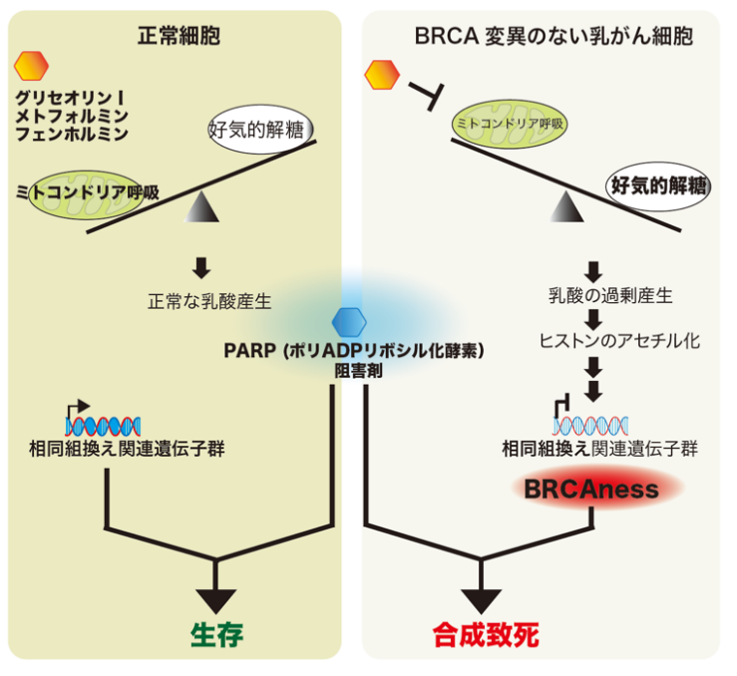
図1.本研究のまとめ
論文名、著者およびその所属
論文名
Metabolically inducing defects in DNA repair sensitizes BRCA–wild-type cancer cells to replication stress.
ジャーナル名
Science Signaling(米国科学振興協会AAAS から発行されるScience 姉妹雑誌)
DOI: 10.1126/scisignal.adl6445
著者
Kenji Watanabe1*, Tatsuro Yamamoto1, Tomoko Fujita1, Shinjiro Hino2, Yuko Hino2, Kanami Yamazaki3, Yoshimi Ohashi3, Shun Sakuraba4,5, Hidetoshi Kono4,5, Mitsuyoshi Nakao2, Koji Ochiai6, Shingo Dan3, and Noriko Saitoh1*
* 責任著者
著者の所属機関
1. 公益財団法人がん研究会がん研究所
2. 国立大学法人熊本大学発生医学研究所
3. 公益財団法人がん研究会がん化学療法センター
4. 国立研究開発法人量子科学技術研究開発機構
5. 国立大学法人千葉大学大学院融合理工学府
6. PhytoMol-Tech株式会社
研究の詳細
背景と経緯
一般的にがんの発生や進展には、エネルギー代謝経路の変換や傷ついたDNAの蓄積が伴います(図1)。
BRCA1/2は相同組換えにより損傷したDNAをなおすタンパク質で、BRCA1/2遺伝子の変異は乳がん、卵巣がん、前立腺がん、膵臓がんでよく見られます。BRCA1/2はPARP(ポリADPリボシル化酵素)と補完しながら損傷DNAを修復するため、BRCA1/2変異を持つ乳がんは、PARP(ポリADPリボシル化酵素)阻害剤で特異的に細胞死が誘導されます(図2)。つまりBRCAの機能不全により増えた損傷DNAはPARPが、そしてPARPの阻害により増えた損傷DNAはBRCA1/2の働きによって修復することができます。しかしこの両者が同時に阻害されると、合成致死と呼ばれる現象でがんが死滅するわけです。従ってPARP阻害薬はBRCA1/2に変異があるがんに対する優れた分子標的薬で臨床でも使われています。一方、BRCA1/2遺伝子に変異を持たないがん細胞に対してはPARP阻害剤は効果がなく、その割合も多いことから、PARP阻害剤の効果を高めるような治療法の開発が望まれています。特に、トリプルネガティブ乳がんは、ホルモン受容体が存在しないため、ホルモン療法や分子標的治療の対象にならず、効果的な治療法が確立されていません。PARP阻害剤を用いたものを含めて、よりがん細胞に特異的な治療法の開発が求められるがんの一種です。
グリセオリンIは発芽大豆から分離された低分子化合物で、乳がんに対して抑制効果を持つことが知られていましたが、その機序はほとんど不明でした。
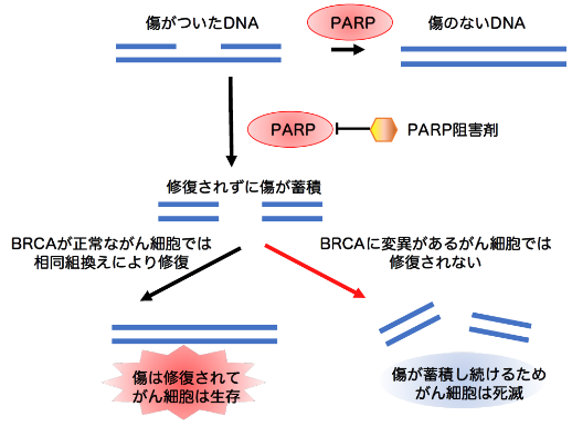
図2. BRCA に変異のあるがんは、PARP(ポリADPリボシル化酵素)阻害剤で増殖が抑えられる。BRCAとPARPが損傷DNAを修復する過程で補完的に働くためである。
研究内容
BRCA1/2に変異がなく正常に存在するトリプルネガティブ乳がん細胞をグリセオリンIで処理したところ、ミトコンドリアでの呼吸が抑制され、代償的に解糖系によるエネルギー代謝が活性化され、その最終代謝産物である乳酸が過剰に産生され、細胞外環境が酸性に傾くことを見出しました。この代謝リプログラミングがきっかけとなり、相同組み換えに関する遺伝子(BRCA1、BRCA2およびRAD51)の転写(図3左)とタンパク質の量(図3右)が減少することを見出しました。つまり、グリセオリンI 処理によって、乳がんにおいてBRCA1/2変異をもたないにもかかわらず、相同組み換え能力が低い、いわゆる「BRCAness」の状態を作り上げることが分かりました。これらは正常細胞では認められない現象でした。BRCA1,2遺伝子の発現抑制は、乳酸過剰産生によるヒストンの低アセチル化に起因することも分かりました。
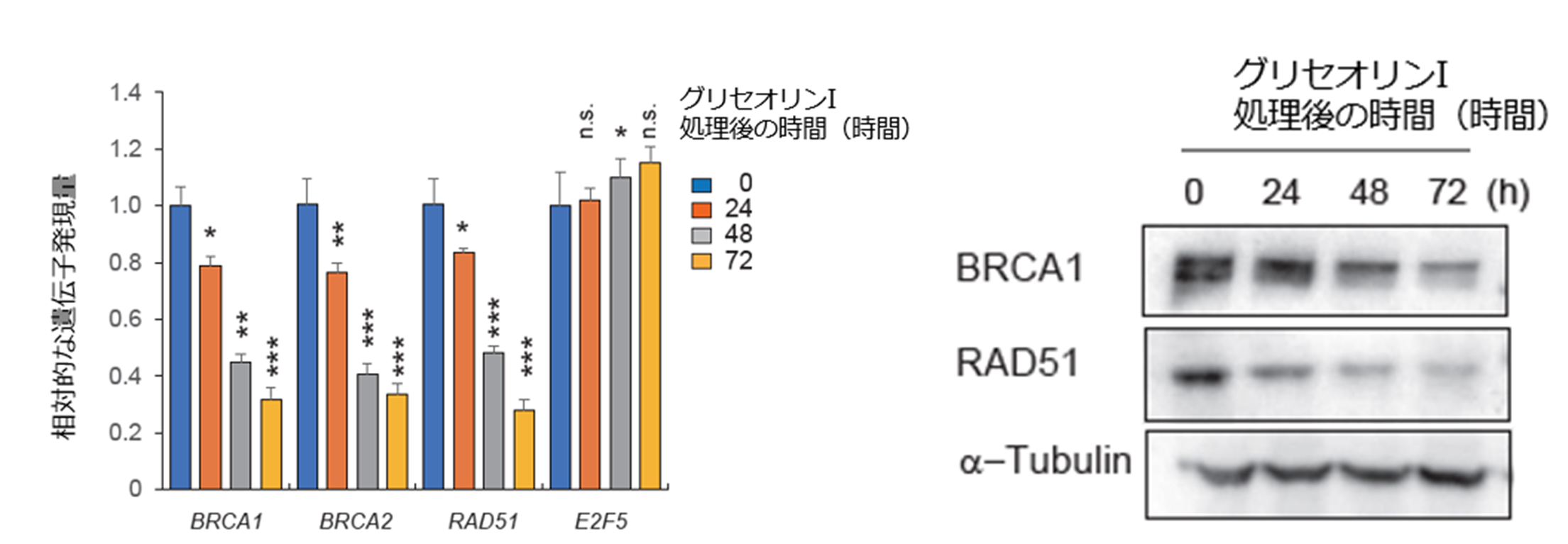
図3. 乳がん細胞株をグリセオリンIで処理すると、相同組み換えに関与する遺伝子の転写量(左)とタンパク質量(右)が低下した。E2F5とa-Tubulinは相同組み換えに関与しない。
コンピュータを用いたシミュレーションでは、グリセオリンIがミトコンドリア複合体Iに安定な状態で直接結合できることを確認できました(図4)。今までは単に形が似ていることからグリセオリンIがエストロゲン様に機能すると示唆されたこともありましたが、それを刷新する新しい知見となりました。
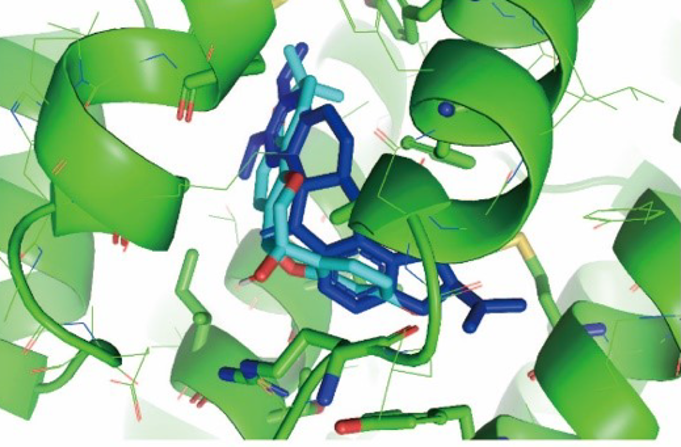
図4. コンピュータを用いたシミュレーションでは、グリセオリンI(うす青)がミトコンドリア複合体I(緑)に安定に直接結合できると示した。青は既知のミトコンドリア阻害化合物ロテノン
さらに重要なことに、細胞株やマウスを使った実験で、グリセオリンIとPARP阻害剤の両方で処理すると、PARP阻害剤単独で処理した場合に比べて乳がん細胞増殖抑制効果があることを明らかにしました(図5)。同様の効果はミトコンドリア阻害剤であり、糖尿病治療薬として既に承認されているメトホルミンでも確認されました(図6)。
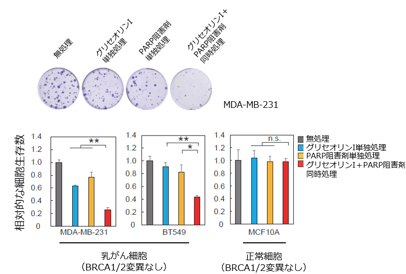
図5. グリセオリンIとPARP阻害剤を組み合わせると、乳がん細胞株の増殖が抑制された。
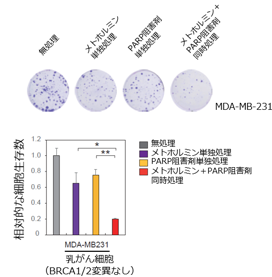
図6. メトホルミンとPARP阻害剤を組み合わせると、乳がん細胞株の増殖が抑制された。
これらのことから本研究では、ミトコンドリアを標的とする低分子化合物が、がん細胞特異的にBRCA1/2の機能を失わせ、PARP阻害剤に対する感受性を高めることを見出しました。乳がんではミトコンドリア機能が阻害されると好気的解糖(注3)系に移行しやすい素地があること、さらにミトコンドリア機能を回復する能力が低いことで“BRCAness”というがんの脆弱性を誘導できることも示唆しました。ミトコンドリア標的薬とPARP阻害薬を併用することで、がんを治療できる新しい可能性を提案します。
なお本研究は、培養細胞株や実験マウスにおける基礎研究であり、未だ乳がん患者を直接に調べたものではありません。
まとめ
本研究では、ミトコンドリアを阻害する低分子化合物とPARP阻害剤を併用することにより、BRCAに変異をもたないがん種においてもPARP阻害剤の効果を高めることができることを発見し、新たながん治療法の可能性が示されました。これは、これまでにミトコンドリア標的治療として提唱されてきた、エネルギー枯渇によるがん治療戦略とは異なるものです。
本研究への支援
本研究は、下記機関より資金的支援等を受けて実施されました。
- 文部科学省科学研究費補助金・新学術領域研究、学術変革領域研究 (JP18H05531, JP24H01382)
- 科学研究費補助金基盤研究、挑戦的研究、研究活動スタート支援 (JP20H03520, JP23H00411, JP22K1946, JP20K07578, JP19K23736)
- 武田報彰医学研究助成
- 内藤記念科学奨励金・研究助成
- 高松宮妃癌研究基金研究助成
- 高深度オミクス医学研究拠点ネットワーク形成事業
- 第一三共生命科学研究振興財団研究助成
- AMED BINDS 事業 「生命科学・創薬研究支援事業 ウェットデータとドライデータの統合解析による分子モデリング支援」 (JP24ama121024j0003 (support number 6082))
- AMED 次世代がん医療加速化研究事業 (JP23ama221428)
- 日本財団
用語解説
(注1)相同組み換え
配列の類似したDNA 間で起きるDNAの組み換え反応。細胞核内で二本鎖DNAの双方ともが切断された場合、相同配列を鋳型にしてこの活性でDNA配列が正確に修復される。
(注2)合成致死
2つの遺伝子が同じ機能の別経路に働くなどの理由により、片方の遺伝子の変異では細胞が死なないが、両方の遺伝子に変異が入ると致死となる現象。がんに特徴的な遺伝子変異を標的にした合成致死療法は、がんに特異的で副作用が少ないことが期待される。
(注3)好気的解糖
がん細胞は酸素が十分存在する条件下でもミトコンドリアでの酸化的リン酸化よりも、解糖系でグルコースをピルビン酸から乳酸へと代謝してATPを作る現象。